клеточная биотехнология. лекция 4. Способы выращивания суспензионной культуры
 Скачать 28.73 Kb. Скачать 28.73 Kb.
|
|
Способы выращивания суспензионной культуры 1. Типы культивирования 2. Непрерывное культивирование 3. Хемостат и турбидостат 1. Культивирование клеток в жидкой среде осуществляется несколькими способами. Наиболее простым и распространенным является накопительное или периодическое культивирование. Клетки растут в постоянном объеме питательной среды на установках качального или роллерного типа. Такая система закрыта для всего, кроме газов и летучих продуктов метаболизма. Оказывается при этом в колбах накапливается значительное количество углекислого газа. После замедления роста суспензия разводится до начальной плотности, и цикл выращивания повторяется. Цикл выращивания - это период от помещения инокулюма в свежую среду до следующего субкультивирования. Для накопительных культур чаще всего используются конические широкогорлые колбы разных размеров на платформенных качалках кругового или полукругового типа со скоростью вращения 60-120 оборотов в минуту. Клетки растений, несмотря на ряд специфических особенностей, подчиняются тем же законам роста, что и микроорганизмы, поэтому для их выращивания применяют технологию и аппаратуру, принятую в работе с микроорганизмами. Микроорганизмы обычно культивируют в особых аппаратах, называемых ферментерами. Накопительные культуры можно выращивать в лабораторных ферментерах рабочим объемом 0,5-10 л. По сравнению с глубинным выращиванием в колбах на качалке при культивировании клеток в ферментерах появляются принципиально новые возможности, связанные с их конструкцией. На культуру клеток в ферментерах можно в любой момент воздействовать различными факторами (температура, свет, газовый режим, физиологически активные вещества, рН и др. ) и отбирать пробы клеток для определения динамики роста и метаболизма популяции в цикле выращивания. То есть, не нарушая режима асептики, можно контролировать рост и продуктивность биомассы, изучать влияние на эти процессы различных воздействий. Вместе с тем культивирование растительных клеток в ферментерах сопряжено с трудностями, вытекающими из специфических особенностей клеток высших растений. Наличие вакуоли и целлюлозно-пектиновой оболочки, придающей клеткам не только прочность, но и хрупкость, обуславливает их подверженность механическому стрессу при перемешивании и аэрации. Опасность механического стресса усиливается на стадии растяжения клеток. Ферментеры различных конструкций обеспечивают перемешивание и аэрацию по-разному: вращаясь вокруг собственной оси, будучи в наклонном состоянии, перемешиванием магнитными и механическими мешалками, продуванием сжатого стерильного воздуха через суспензию. Конструкция лопастей мешалок бывает разной, и вращаются они с разной скоростью. Высокая скорость перемешивания ведет к разрушению клеток, снижение интенсивности перемешивания может привести к оседанию части клеток к их гибели. Рост биомассы, которого так стараются добиться в работе ученые, ведет к возрастанию вязкости, что так осложняет культивирование. В отличие от микроорганизмов растительные клетки слипаются между собой и с поверхностями культиватора. Кроме того, они могут скапливаться в верхней части сосуда, образуя пену. Перечисленные особенности растительных клеток заставляют исследователей очень тщательно подходить к выбору типа культиваторов и режиму перемешивания в зависимости от целей и задач экспериментов с суспензионной культурой. 2. Способ, при котором клетки выращиваются в проточном режиме, называется непрерывным культивированием. В основу создания проточных систем легли опыты, в которых было обнаружено, что добавление в суспензию в фазу экспоненциального роста культуры порций свежей питательной среды позволяет долго поддерживать деление клеток. Непрерывное культивирование может осуществляться в закрытой проточной, полупроточной и открытой проточной системах. В закрытой проточной системе суспензионная культура непрерывно снабжается свежей средой, приток которой сбалансирован оттоком равного количества использованной среды. В такой системе хорошо изучать влияние различных факторов на метаболизм клеток. При полупроточном режиме выращивания определенная часть суспензии время от времени отбирается и оставшаяся часть разбавляется свежей средой. Применяется для получения большой биомассы с целью ее биохимического исследования. Открытая проточная система устроена так, что обеспечивает баланс между притоком свежей питательной среды и удалением равного объема клеточной суспензии. Скорость удаления части клеток из системы должна соответствовать скорости образования новых клеток в результате деления, это создает равновесное состояние между ростом клеток (постоянством скорости клеточного деления) и биосинтезом (постоянством состава и метаболической активности). 3. В открытой проточной системе исследуются взаимосвязи между процессами роста и метаболизма, те изменения, которые происходят при переходе клеток от одного состояния к другому, а также условия оптимального режима культивирования для получения максимального количества вторичных метаболитов. В основу непрерывного культивирования могут быть положены принципы хемостата и турбидостата, разработанные при культивировании микроорганизмов (рис. 2).  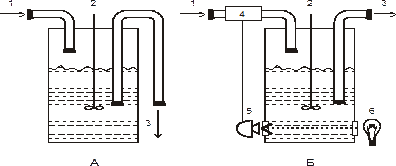 Рисунок 2. Схемы биореакторов для проточного культивирования микроорганизмов А – хемостат; Б – турбидостат с автоматической регуляцией оптической плотности. 1 – поступление среды, 2 – мешалка, 3 – сток культуры, 4 – насос, 5 – фотоэлемент, 6 – источник света В хемостатном режиме непрерывное культивирование идет под воздействием лимитирующего рост фактора. Хемостатная культура представляет собой перемешиваемую суспензию, в которую с постоянной скоростью поддается свежая среда с заданной концентрацией какого-то лимитирующего рост компонента и с такой же скоростью отбирается часть культуры. Общий объем суспензии остается постоянным. При выращивании клеточных суспензий в хемостатном режиме скорость размножения клеток регулируется концентрацией лимитирующего фактора. Скорость роста и плотность клеточной популяции проходят в соответствии с заданной скоростью поступления среды (скорость разбавления), т.е. подачей лимитирующего фактора и других компонентов среды. Это приводит популяцию в стационарное состояние, для которого характерны выравненность физиологического состояния, постоянства концентрации лимитирующего фактора и других компонентов среды. Принцип турбидостата предусматривает непрерывное культивирование без внешнего лимитирования, рост клеток популяции поддерживается на определенном уровне регулированием оптической плотности культуры. Для этого подходят суспензии с низкой плотностью клеток и высокой удельной скоростью роста, т.е. популяции в начальные фазы роста. Турбидостат представляет собой хемостат, дополненный фотоэлектрическим элементом, чувствительным к мутности культуры. Рост клеточной популяции поддерживается на заданном уровне автоматически с помощью фотометрической регуляции подачи среды. Хемостатный и турбидостатный режимы применяют с целью стабилизации клеточной популяции в определенном состоянии роста и поддержания его неограниченное время. Эти приемы культивирования очень ценны для изучения регуляции роста и метаболизма клеток в строго стандартных условиях под влиянием различных лимитирующих и ингибирующих факторов. Однако, таких работ очень мало, что связано с новизной метода и техническими трудностями. Препятствием к культивированию клеток высших растений в проточном режиме является их высокая чувствительность к повреждениям, агрегированность, длительное время генерации. Контрольные вопросы: 1. Способы получения суспензионной культуры. 2. Преимущества суспензионной культуры по сравнению с поверхностным культивированием клеток? 3. Способы культивирования клеток в жидкой среде. 4. Объясните понятия: каллус, тотипотентность, культура клеток, дифференциация, растение-регенерант, эксплант. |
