Сроп2%20Борашова%20Асель. Сроп2 Биологическая химия Борашова Асель
 Скачать 17.12 Kb. Скачать 17.12 Kb.
|
|
СРОП2 Биологическая химия Борашова Асель аминокислота, любая из группы органических молекул, состоящих из основной аминогруппы (―NH2), кислой карбоксильной группы (―COOH) и органической R-группы (или боковой цепи), которая уникальна для каждой аминокислоты. Термин аминокислота является сокращением от α-амино [альфа-амино] карбоновой кислоты. Каждая молекула содержит центральный атом углерода (С), называемый α-углеродом, к которому присоединены как аминогруппа, так и карбоксильная группа. Оставшиеся две связи атома α-углерода, как правило, удовлетворяются атомом водорода (H) и группой R. Формула общей аминокислоты такова: 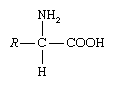 Аминокислоты отличаются друг от друга особой химической структурой группы R. Строительные блоки белков Белки имеют первостепенное значение для продолжения функционирования жизни на Земле. Белки катализируют подавляющее большинство химических реакций, происходящих в клетке. Они обеспечивают многие структурные элементы клетки и помогают связывать клетки вместе в ткани. Некоторые белки действуют как сократительные элементы, делая возможным движение. Другие отвечают за транспортировку жизненно важных материалов снаружи клетки (“внеклеточная”) внутрь (“внутриклеточная"). Белки в форме антител защищают животных от болезней и в форме интерферона осуществляют внутриклеточную атаку на вирусы, которые ускользнули от уничтожения антителами и другими защитными средствами иммунной системы. Многие гормоны являются белками. И последнее, но, безусловно, не менее важное: белки контролируют активность генов (“экспрессию генов"). Это множество жизненно важных задач отражается в невероятном спектре известных белков, которые заметно различаются по своему общему размеру, форме и заряду. К концу 19 века ученые поняли, что, хотя в природе существует много различных видов белков, все белки при их гидролизе дают класс более простых соединений, строительных блоков белков, называемых аминокислотами. Самая простая аминокислота называется глицин, названная так из-за ее сладкого вкуса (глико, “сахар”). Это была одна из первых идентифицированных аминокислот, выделенная из белкового желатина в 1820 году. В середине 1950-х годов ученые, занимавшиеся выяснением взаимосвязи между белками и генами, согласились с тем, что 20 аминокислот (называемых стандартными или обычными аминокислотами) следует считать основными строительными блоками всех белков. Последний из них, треонин, был обнаружен в 1935 году. Хиральность Все аминокислоты, кроме глицина, являются хиральными молекулами. То есть они существуют в двух оптически активных асимметричных формах (называемых энантиомерами), которые являются зеркальными отражениями друг друга. (Это свойство концептуально аналогично пространственному отношению левой руки к правой руке.) Один энантиомер обозначается D, а другой L. Важно отметить, что аминокислоты, содержащиеся в белках, почти всегда имеют только L-конфигурацию. Это отражает тот факт, что ферменты, ответственные за синтез белка, эволюционировали, чтобы использовать только L-энантиомеры. Отражая эту почти универсальность, префикс L обычно опускается. Некоторые D-аминокислоты содержатся в микроорганизмах, особенно в клеточных стенках бактерий и в некоторых антибиотиках. Однако они не синтезируются в рибосоме. Кислотно-основные свойства Другой важной особенностью свободных аминокислот является наличие как основной, так и кислотной группы в α-углероде. Соединения, такие как аминокислоты, которые могут действовать как кислота или основание, называются амфотерными. Основная аминогруппа обычно имеет pKa от 9 до 10, в то время как кислотная α-карбоксильная группа имеет pKa, который обычно близок к 2 (очень низкое значение для карбоксилов). pKa группы-это значение рН, при котором концентрация протонированной группы равна концентрации непротонированной группы. Таким образом, при физиологическом рН (около 7-7, 4) свободные аминокислоты существуют в основном в виде дипольных ионов или “цвиттерионов” (по-немецки “гибридные ионы”; цвиттерион несет равное количество положительно и отрицательно заряженных групп). Любая свободная аминокислота, а также любой белок при определенном рН будут существовать в форме цвиттериона. То есть все аминокислоты и все белки, подвергаясь изменениям рН, проходят через состояние, при котором на молекуле имеется равное количество положительных и отрицательных зарядов. pH, при котором это происходит, известен как изоэлектрическая точка (или изоэлектрический pH) и обозначается как pI. При растворении в воде все аминокислоты и все белки присутствуют преимущественно в их изоэлектрической форме. Другими словами, существует pH (изоэлектрическая точка), при котором молекула имеет чистый нулевой заряд (равное количество положительных и отрицательных зарядов), но нет pH, при котором молекула имеет абсолютный нулевой заряд (полное отсутствие положительных и отрицательных зарядов). То есть аминокислоты и белки всегда находятся в форме ионов; они всегда несут заряженные группы. Этот факт жизненно важен при дальнейшем рассмотрении биохимии аминокислот и белков. |
