Ацетилсалициловая кислота. ФС_Ацетилцистеин__раствор_для_приема_внутрь_. Статья ацетилцистеин, фс раствор для приема внутрь Вводится впервые
 Скачать 38.31 Kb. Скачать 38.31 Kb.
|
|
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ФАРМАКОПЕЙНАЯ СТАТЬЯ Ацетилцистеин, ФС раствор для приема внутрь Вводится впервые Настоящая фармакопейная статья распространяется на лекарственный препарат ацетилцистеин, раствор для приема внутрь. Препарат должен соответствовать требованиям ОФС «Растворы» и ниже приведенным требованиям. Содержит не менее 90,0 % и не более 110,0 % от заявленного количества ацетилцистеина C5H9NO3S. Описание. Прозрачная бесцветная или слегка окрашенная жидкость. Подлинность. ВЭЖХ. Время удерживания основного пика на хроматограмме испытуемого раствора должно соответствовать времени удерживания основного пика на хроматограмме стандартного раствора А (раздел «Количественное определение»). рН. От 6,0 до 7,0 (ОФС «Ионометрия», метод 3). *Плотность. Определение проводят в соответствии с ОФС «Плотность». **Родственные примеси. Определение проводят методом ВЭЖХ. Буферный раствор. 3,45 г атрия дигидрофосфата моногидрата и 3,2 г натрия гептансульфоната моногидрата растворяют в 950 мл воды и доводят до рН 2,15 ортофосфорной кислотой. Полученный раствор переносят в мерную колбу вместимостью 1 л и доводят объем раствора водой до метки. Подвижная фаза. Смесь метанол – буферный раствор 5:95. Испытуемый раствор. Точный объем препарата, содержащий около 0,1 г ацетилцистеина, помещают в мерную колбу вместимостью 100 мл доводят до метки ПФ, перемешивают и фильтруют. Стандартный раствор А. Около 0,1 г (точная навеска) стандартного образца ацетилцистеина помещают в мерную колбу вместимостью 100 мл, растворяют в ПФ и доводят объем раствора тем же растворителем до метки. Стандартный раствор Б. Около 5 мг (точная навеска) стандартного образца ацетилцистеина, около 5 мг (точная навеска) стандартного образца примеси А, около 10 мг (точная навеска) стандартного образца примеси В, около 10 мг (точная навеска) стандартного образца примеси С и около 10 мг (точная навеска) стандартного образца примеси D взбалтывают с 1,0 мл 1 М раствора хлористоводородной кислоты и доводят объём раствора ПФ до 100,0 мл. 1,0 мл полученного раствора помещают в мерную колбу вместимостью 10 мл и доводят объем раствора ПФ до метки. Примечание. Примесь A: 3,3'-дисульфандиилбис[(2R)-2-аминопропановая кислота], CAS 56-89-3; примесь B: (2R)-2-амино-3-сульфанилпропановая кислота, CAS 52-90-4; примесь C: 3,3'-дисульфандиилбис[(2R)-2-ацетамидопропановая кислота], CAS 5545-17-5; примесь D: (2R)-2-ацетамидо-3-(ацетилсульфанил)пропановая кислота, CAS 5545-17-5; продукт циклизации: 2-метил-4,5-дигидро-1,3-тиазол-4-карбоновая кислота, CAS 84184-18-9. Хроматографические условия
Хроматографируют испытуемый раствор и стандартный раствор Б. Пригодность хроматографической системы. На хроматограмме стандартного раствора Б: – разрешение (R) между любыми пиками должно быть не менее 1,5; – относительное стандартное отклонение для площадей пиков любых примесей должно быть не более 6,0 %. Относительные времена удерживания компонентов: примесь А – около 3; примесь В – около 1,8; ацетилцистеин – 1,00 (около 5 мин); примесь С – около 2; примесь D – около 2,2. Допустимое содержание примесей. Содержание любой примеси в процентах (Х) от заявленного количества ацетилцистеина вычисляют по формуле: 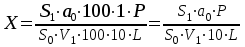
Содержание примесей в препарате должно быть: – примесь А – не более 0,5 %; – примесь B – не более 1,0 %; – примесь C – не более 3,5 %; – примесь D – не более 1,0 %; – любая другая примесь – не более 0,5 % для каждой примеси; – сумма примесей – не более 4,5 %. Извлекаемый объем. В соответствии с ОФС «Извлекаемый объем». Микробиологическая чистота. В соответствии с ОФС «Микробиологическая чистота». Количественное определение. Определение проводят методом ВЭЖХ одновременно с определением родственных примесей. Хроматографируют испытуемый раствор и стандартный раствор А. Пригодность хроматографической системы. На хроматограмме стандартного раствора А: – относительное стандартное отклонение площади пика ацетилцистеина должно быть не более 2,0 %; – эффективность хроматографической колонки (N), рассчитанная по пику ацетилцистеина должна составлять не менее 2500 теоретических тарелок; – фактор асимметрии пика (AS) ацетилцистеина должен быть не более 1,25. Содержание ацетилцистеина C5H9NO3S.в препарате в процентах от заявленного количества (Х) вычисляют по формуле: 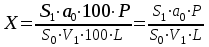
Хранение. В защищенном от света месте. *Контроль по показателю качества «Плотность» проводится в случае, если плотность препарата больше или меньше 1,0. При этом, для проведения испытаний «Родственные примеси» и «Количественное определение» препарат отвешивают, а полученное значение плотности учитывают в соответствующих расчетах. **В случае, если содержание какой-либо неидентифицированной примеси или их сумма влияет на установленные нормы, превышая их, то анализируют «Раствор плацебо». Для приготовления плацебо используют навески всех вспомогательных веществ в том же соотношении, как и при приготовлении препарата. Для проведения испытания готовят «Раствор плацебо» по той же схеме, как описано для «Испытуемого раствора». | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
