Заячья губа реферат. Заячья губа. Статья информация
 Скачать 496.39 Kb. Скачать 496.39 Kb.
|
|
Мутации GADD45G у кроликов вызывают заячью губу из-за нарушения пролиферация, апоптоз и эпителиально-мезенхимальный переход (ЭМП) Йи Луа, 1 , Миньмин Лианга, 1 , Цюаньцзюнь Чжанб , Чжицюань Люа Юнин Сонга , Лянсюэ Лайя, б, ⁎ , Чжаньцзюнь Лия, Ключевая лаборатория исследований зоонозов, Министерство образования, Институт зоонозов, Колледж ветеринарной медицины, Университет Цзилинь, Чанчунь 130062, Китай b Ключевая лаборатория регенеративной биологии CAS, Ключевая лаборатория стволовых клеток и регенеративной медицины провинции Гуандун, Южно-Китайский институт биологии стволовых клеток и регенеративной медицины, Институт биомедицины и здравоохранения Гуанчжоу, Китайская академия наук, Гуанчжоу, 510530, Китай СТАТЬЯ ИНФОРМАЦИЯ Ключевые слова: GADD45G Заячья губа Кролик CRISPR / Cas9 BE4-Gam АННОТАЦИЯ Заячья губа с волчьей пастью или без нее (CL / P) - один из наиболее распространенных врожденных дефектов у людей. Полногеномные ассоциативные исследования (GWAS) широко используются для идентификации генов-кандидатов и различных гены или хромосомные области продемонстрировали убедительные доказательства наличия причинных генов в CL / P. На сегодняшний день два независимые GWAS определили, что GADD45G влияет на риск CL / P. Однако животной модели нет. свидетельства о GADD45G, относящемся к CL / P. Здесь мы сообщили о создании нового кролика с мутацией GADD45G. модель от CRISPR / Cas9 и систем BE4-Gam на основе CRISPR. Гомозиготные (GADD45G - / -), но не гетерозиготные (GADD45G +/-) детеныши умерли после рождения из-за серьезных черепно-лицевых дефектов односторонней или двусторонней щели. губа (CL). Кроме того, были выявлены нарушения пролиферации, апоптоза и эпителиально-мезенхимального перехода (ЭМП). также определяется в медиальных и латеральных отростках носа (MNP и LNP) на 13-й день эмбриона (E13) GADD45G - / - кроликов, которые сравнивали с нормальными кроликами дикого типа (WT). Таким образом, наше исследование подтвердило Впервые потеря GADD45G привела к развитию ХЛ на уровне животных и дала новое понимание важной роли GADD45G для формирования и слияния верхней губы 1. Введение Заячья губа с волчьей пастью или без нее (CL / P) - одна из самых распространенных общие врожденные заболевания у людей, примерно от 1/500 до Во всем мире родилось 2500 новорожденных [1,2]. Клинически заячья губа (CL) относится к односторонний или двусторонний разрыв между боковой стороной верхней губы и желобок, обычно простирающийся от верхней губы и нижней челюсти до ноздри и сопровождается волчьей пастью [3]. Другая распространенная расщелина неба на лице - это расщелина неба (CP), которая появляется во вторичной щели. нёбо и верхняя губа кажутся законченными. Причина CL / P - сложные, включая факторы окружающей среды и генетические факторы [4]. Эпидемиологические исследования показали, что у монозиготных близнецов сильная семейная агрегация и постоянство, что указывает на генетическую предрасположенность. к CL / P [5]. Некоторые полногеномные ассоциативные исследования (GWAS) были разработаны с использованием как тройного исследования случай-контроль, так и тройного исследования случай-родитель, и различные гены или хромосомные области продемонстрировали убедительные доказательства того, что гены CL / P [6–10]. Остановка роста и повреждение ДНК 45G (GADD45G) является членом Семейство GADD45 (семейство 45, вызывающее остановку роста и индуцируемое повреждением ДНК), которое участвует в регуляции клеточного ответа на стрессы, Ремонт ДНК, ингибирование клеточного цикла и выживаемость [11–13]. Несмотря на то что изначально считалось неважным для развития мышей [14], исследования потери функции показали, что GADD45G играет роль в определение пола через эффекты на экспрессию p38 MAPK и Sry [15,16]. В недавних исследованиях несколько GWAS выявили GADD45G в качестве гена-кандидата, связанного с CL / P [6,9,10]. Отмечено, что экспрессия GADD45G в эмбриональных эмбрионах мыши на 9.5 (E9.5) день также был обнаружен в спинном мозге, нервной трубке, черепной и ганглии задних корешков [17]. Эти наблюдения подразумевают, что GADD45G возможно связано с CL / P, но неизвестно, Сокращения: CL / P - заячья губа с волчьей пастью или без нее; CL, заячья губа; EMT, эпителиально-мезенхимальный переход; WT, дикий тип; CP - волчья пасть; GWAS, полногеномный ассоциативные исследования; ФНП - лобно-носовая выпуклость; MXP, верхнечелюстные отростки; MAN, нижнечелюстные отростки; МНП, медиальный носовой отросток; LNP, боковой носовой отросток; λ, лямбдоидный переход; КО, нокаут; Шшш, звуковой ёжик; POTS, потенциальные нецелевые последовательности ⁎ Авторы-корреспонденты: Ключевая лаборатория исследований зоонозов, Министерство образования, Институт зоонозов, Колледж ветеринарной медицины, Университет Цзилинь, Чанчунь 130062, Китай. Адреса электронной почты: lai_liangxue@gibh.ac.cn (Л. Лай), lizj_1998@jlu.edu.cn (З. Ли). 1 Эти авторы внесли равный вклад в эту работу. связь является причинной или случайной на животном уровне. Верхняя часть лица (губа и нос) млекопитающих производится несколькими парные и непарные ткани во время раннего органогенеза [18,19]. В формирование верхней губы начинается на 9-й день эмбриона (E9) у мыши, и дополнено E12.5 [19]. Оригинальный рот состоит из 5 отдельных протрузии, лобно-носовой выступ (ФНП) находится на верхней стороне, пара верхнечелюстных отростков (MXP) находятся снаружи и пара нижнечелюстные отростки (MAN) находятся на нижней стороне [19]. ФНП растет непрерывно и делится на медиальный носовой отросток (МНП) и боковой носовой отросток (LNP), который выступает вокруг носовых плакод для формирования носовых ямок. В районе E11, слияние в лямбдоидном соединении (λ) которые LNP, MXP и MNP приводят к образованию ноздрей и губа [19]. Морфогенез и рост лица требуют точной координации клеточных программ, включая пролиферацию, дифференцировку и апоптоз [20]. Вмешательство любого события развития может привести к расщелина лица [21]. На λ клетки эпителиального шва между слиянием процессы должны быть разрушены [22]. Активную гибель клеток можно наблюдать в эпителиальные швы между MNP и LNP у мышей [19]. Тем не мение, мыши, у которых наблюдается апоптоз из-за ингибирования передачи сигналов каспазы путь не показал ХЛ, а только вторичные пороки развития и экстрацеребральные пороки [23,24]. Эти результаты позволяют предположить, что есть другие механизмы, приводящие к удалению эпителиальных клеток. Некоторые исследования показали, что эпителиально-мезенхимальный переход (ЭМП) происходит в клетках эпителиального шва во время лицевого слияния [25,26]. Кроме того, Куросака Х. обнаружил, что тревожный звуковой сигнал ежа (Шш) приводили к стойким SSEA1-положительным клеткам перидермы на MNP, которые возможно, привело к нарушению баланса пролиферации клеток и апоптоз эпителиального шва, вызвавший фенотип ХЛ [27]. В этом исследовании мы сообщили, что гены GADD45G высоко экспрессируются. на MNP и LNP во время формирования и слияния верхней губы у кроликов. Создав у кроликов дефицит гена GADD45G, мы продемонстрировали эта потеря GADD45G приводит к CL на уровне животных. Кроме того, увеличение пролиферации клеток, снижение апоптоза клеток и ЭМП при λ кроликов E13 GADD45G - / -, что приведет к сохранению шов в МНП и ЛНП и патогенез ХЛ. В целом эти данные предоставили первое прямое доказательство того, что GADD45G представляет собой генетический риск коэффициент для CL 2. Материалы и методы 2.1. Заявление об этике Новозеландские кролики были получены от экспериментального животного. Центр Цзилиньского университета (Чанчунь, Китай). Все эксперименты с кроликами проводились в соответствии с экспериментальными спецификациями и стандартами, утвержденными Центром по уходу за животными Цзилиньского университета. и Используйте рекомендации Комитета. 2.2. CRISPR / Cas9-опосредованный нокаут гена GADD45G (KO) у кроликов SgRNAs, нацеленные на GADD45G, были сконструированы, собраны и в vitro транскрибируется, как описано ранее [28]. Олигонуклеотиды sgRNA были отожжены и вставлены в pUC57-Simple-gRNA. вектор (Addgene ID 51306), как описано [29]. Устройство pSpCas9 (PX165) вектор был получен от Addgene (# 48137). Протокол микроинъекции и переноса эмбрионов был описан в нашем предыдущем обзоре. опубликованные данные [30]. Вкратце, смесь мРНК Cas9 (200 нг / мкл) и sgRNA (50 нг / мкл) совместно вводили в цитоплазму зигот кролика. а затем переведены в кроликов-реципиентов. 2.3. BE4-Gam-опосредованное редактирование базы в GADD45G кролика SgRNA BE4-Gam была сконструирована, собрана и транскрибирована in vitro, как описано ранее [31]. Вектор BE4-Gam был получен из Addgene (# 100806). Протокол микроинъекции и эмбриона перенос был описан [31]. 2.4. Обнаружение мутаций и нецелевой анализ Обнаружение мутации выполняли, как описано ранее [32]. Праймеры ПЦР для сайтов-мишеней sgRNA были следующими: прямой, 5'-ACCCCGACAATGTGACCTTC-3 'и обратный, 5'-ACCACGTCGATCAG ACCAAG-3 '(размер фрагмента аллеля GADD45G-KO: 447 п.н.), вперед, 5'-GAAGCTTGCCGGAGCAG-3 'и обратный, 5'-TCACACGTTCAGGACT TTGG-3 '(размер фрагмента аллеля GADD45G (p.Q36Stop): 253 п.н.). В Т-клоны секвенировали и анализировали с помощью BLAST и SnapGene. Потенциальные нецелевые последовательности (POTS) были предсказаны для анализа согласно CRISPR Design Tool (http://crispr.mit.edu/) и CasOFFinder (http://www.rgenome.net/cas-offinder/) [33]. ПЦР продукты были подвергнуты анализу T7EI и секвенированию по Сэнгеру. 2.5. Сканирующая электронная микроскопия Эмбрионы кроликов E13 и E15 фиксировали в 4% глутаровом альдегиде в PBS при 4 ° C. Образцы промывали PBS, обезвоживали в этаноле. серию, высушенную в углекислом газе и опрысканную золотом, затем наблюдали под электронным микроскопом (Hitachi, Токио, Япония) при ускоряющем напряжении 10 кВ [34]. E13 и E15 были определены как сроки развитие верхней губы и лица путем получения кроличьих эмбрионов разных дней (E11 – E16). 2.6. Гистологическое исследование и иммуноокрашивание Эмбрионы кролика E13 фиксировали в 4% параформальдегиде (PFA). и переработаны в залитые парафином серийные секции. Гематоксилин и Эозин (H&E), иммуногистохимический анализ выполняли, как описано ранее [35,36]. Антитело, используемое для иммуногистохимии, было Антитело против GADD45G [2F12] (Abcam, ab140378; 1: 150). В окрашенные срезы визуализировали с помощью микроскопа (Nikon, Токио, Япония). Для анализа пролиферации проводили иммуноокрашивание фосфогистон H3 (pH 3) (Abcam, ab14955; 1: 200). PH3-положительный количество ячеек и общее количество ячеек определяли по трем случайным образом. выбранные разделы из каждой экспериментальной группы. Анализы апоптоза были выполняется с использованием иммуноокрашивания каспазой-3 (активное) (Beyotime, AF1150; 1: 200) согласно протоколу производителя. Разделы были контрастировали с DAPI. Между тем обнаружение апоптотических клеток в TdT-опосредованный анализ мечения ник-концов dUTP (TUNEL) с использованием in situ набор для анализа клеточной гибели (Roche Applied Science, Верхняя Бавария, Германия). Анализы EMT проводили с использованием E-Cadherin Mouse Monoclonal Антитело (Beyotime, AF0138; 1: 200) и мышиный моноклональный виментин Антитело (Abacam, ab8978; 1: 1000). Изображения были сняты с использованием лазерный сканирующий конфокальный микроскоп (Olympus, Токио, Япония) [36]. 2.7. Количественная ПЦР в реальном времени (q-PCR) q-ПЦР выполняли, как описано ранее [28]. Вкратце, всего РНК экстрагировали из MNP и LNP WT и E13 GADD45G - / - эмбрионы с использованием Тризола (Тяньген, Пекин, Китай) и обратным транскрибированием в кДНК с помощью PrimeScript RT Master Mix (TaKaRa, Tokyo, Japan). В Праймеры для q-ПЦР были следующими: GADD45G вперед, 5'-CAGATCCACTT CACGCTGAT-3 'и GADD45G обратные, 5'-CCACGTCGATCAGACC AAG-3 ', GAPDH вперед, 5'-TCCATTCATTGACCTCCACTAC-3' и GAPDH обратный, 5'-GACCAGCTTCCCGTTCTC-3 '. q-ПЦР была проведена с TB Green Premix Ex Taq II (TaKaRa, Япония) и GAPDH. как внутренний контроль. 2.8. Вестерн-блоттинг Буфер RIPA (Beyotime, Шанхай, Китай) с добавлением 0,01% PMSF (BOSTER, Ухань, Китай) использовали для экстракции общего белка. из тканей уха и λ-области эмбрионов кролика E13. Белки были разделены 12% гелем SDS-PAGE, перенесены на нитроцеллюлозный фильтр мембранные (NC) мембраны. Затем блокировали и инкубировали с первичным антитела к антителу Anti-GADD45G [2F12] (Abcam, ab140378; 1: 150) и β-актина (Beyotime, AA128; 1: 1000). Впоследствии мембраны зондировали вторичным антителом (Beyotime, A0216; 1: 1000). Мембраны визуализировали на ECL Plus Western. Система блоттинга (Beyotime, Шанхай, Китай). Интенсивность измеряли с помощью программного обеспечения Image J (NIH, США). Модели трехмерной структуры мутантных белков WT и GADD45G были построены из их аминокислотных последовательностей согласно веб-сайту: http://swissmodel.expasy.org/ [37]. 2.9. статистический анализ Данные выражены как среднее ± SEM, по крайней мере, с тремя индивидуальными определения во всех экспериментах. Данные двух групповых сравнений были определялись непарным t-критерием Стьюдента, и множественные сравнения групп были проанализированы с помощью однофакторного дисперсионного анализа с пост-тестами Бонферрони. с помощью Prism 6.0 (программное обеспечение GraphPad). Статистически значимым считалось р <0,05. Происхождение этих эмбриональных животных-мутантов который для анализа морфологии, пролиферации, апоптоза и гена экспрессия была получена из гетерозиготных эмбрионов F1-2 G1-2 путем ткани спаривания и хвоста собирали для обнаружения мутаций. 3. Результаты 3.1. CRISPR / Cas9-опосредованный нокаут GADD45G (KO) приводит к CL в кролики На сегодняшний день GWAS идентифицировал GADD45G как ген-кандидат, связанный с CL / P [6,9,10]. В настоящее время из-за высокой степени сохранности орофациального развития человека и грызунов мышь считается широко используется в качестве эффективной модели для изучения орофациального развития и дефекты [38,39]. Хотя кролика в основном использовали в качестве хирургического модель для создания и ремонта расщелины в настоящее время кролик делится более сходство с людьми с точки зрения физиологии, анатомии и генетики чем мышь [40,41]. Во-первых, мы разработали пару sgRNAs, нацеленных на экзон 2 и экзон 3 GADD45G у кролика (рис. 1А). Для проверки эффективности гена КО GADD45G в зиготах, смесь мРНК Cas9 и sgRNA совместно вводили в зиготы кролика, а культивируемые зиготы кролика - в зиготы кролика. стадия бластоцисты. Как показано в дополнительной таблице S1, 78,4% ± 6,7 инъецированные эмбрионы (N = 154) развились до стадии бластоцисты и 76,3% ± 3,9 содержали мутации в GADD45G в целевых сайтах. Там не было существенной разницы в скорости развития между неинъектированные эмбрионы и микроинъекционные эмбрионы (p <0,05). Эти результаты показали, что система CRISPR / Cas9 эффективна для нацеливания на ген GADD45G в зиготах кроликов. Чтобы получить кролика GADD45G KO, 60 инъецированных зигот были перенесены в двух суррогатных кроликов и дали 11 живых детенышей. (Дополнительная таблица S2). Как показано на фиг. 1B и S1, 10 из 11 новорожденные детеныши несли гомозиготные мутации GADD45G (GADD45G- / -). Кроме того, данные генотипа показали, что 50% кроликов F0 имели Мозаицизм GADD45G (№ 3, № 4, № 6, № 7 и № 11), показывающий, что CRISPR генерируемый мозаицизм обычно обнаруживался в поколении F0 (рис. S1) [32,42–44]. Чтобы изучить нецелевые эффекты в этих GADD45G - / - кроликов, мы обнаружили первые 10 потенциальных нецелевых сайтов ПЦР продукты с использованием секвенирования по Сэнгеру и анализа T7E1. Грунтовки для нецелевые анализы перечислены в дополнительных данных 1. Результаты показали, что в этих потенциальных сайтах в Кролики GADD45G KO (рис. S3). Следует отметить, что все кролики GADD45G - / - умерли в течение трех дней после рождения. и обнаружена односторонняя (10%) или двусторонняя (90%) заячья губа (CL) на постнатальные 3 дня (P3) (рис. 1C, D и G). Обычно ХЛ часто сопровождается волчьей пастью (КП) [27,45,46], которая геометрически разделена на четыре (передний, средний, задний и задний конец) области вдоль передне-задняя (AP) ось [47–49]. В этом исследовании нет доказательств наличия CP у этих кроликов GADD45G - / - (рис. 1E и F). Кроме того, детеныши кроликов GADD45G - / - с односторонним или двусторонним КЛ не мог нормально сосать соску (фильмы 1, 2 и 3). Таким образом, было предположили, что причиной ранней смерти кроликов GADD45G - / - было от проблемы сосания, которая также является серьезной проблемой младенчества с КЛ в клинике [50]. 3.2. Создание кролика GADD45G (p.Q36Stop) с использованием BE4-Gam система Хотя ожидается, что CRISPR / Cas9 станет инструментом редактирования генов, значимость целевых мутаций, таких как большие делеции и др. о сложных геномных перестройках, вызванных DSB, также сообщалось в предыдущем исследовании [51]. Недавно появился программируемый цитидин. Было показано, что дезаминаза на основе системы CRISPR / Cas9 преобразуется из C-в-T (система BE4-Gam) [52] без генерации DSB [31]. Чтобы еще раз подтвердить роль GADD45G в черепно-лицевом морфогенезе, одно преобразование C-to-T было разработано для преждевременной остановки кодон (p.Q36stop) в экзоне 1 кролика GADD45G (рис. 2А). Эта мутация деактивирует ген, напрямую преобразовывая нормальный кодированные кодоны в кодон СТОП. Чтобы проверить эффективность базового редактирования BE4-Gam GADD45G в зиготах, смесь мРНК BE4-Gam и sgRNA были совместно инъецированы в зиготы кролика и культивированные зиготы кролика в зиготы кролика. стадия бластоцисты. Как показано в дополнительной таблице S3, 77,6% ± 9,8 инъецированные эмбрионы (N = 152) развились до стадии бластоцисты и 76,1% ± 6,3 несли p.Q36stop в GADD45G на целевых участках. Эти Результаты показали, что система BE4-Gam эффективна для генерации p.Q36stop в гене GADD45G в зиготах кроликов. Для получения кроликов GADD45G (Q36Stop) 52 инъецированных зиготы были перенесены в двух суррогатных кроликов (дополнительная таблица S4) и произвел 8 живых детенышей. Базовое редактирование определялось Секвенирование продуктов ПЦР по Сэнгеру. Как показано на фиг. 2B, единичное преобразование Cto-T дает преждевременный стоп-кодон (p.Q36Stop) в целевой области gRNA, как было определено у всех детенышей (100%). Результат от Секвенирование по Сэнгеру и EditR [53] также продемонстрировали эффективное преобразование C-toT у кролика GADD45G (Q36Stop) (рис. 2C и D). В качестве ожидается, 7 из 8 (87,5%) кроликов GADD45G (p.Q36stop), кроме G1- 2, демонстрирует двусторонний CL (рис. 2E и G), и все GADD45G (P.Q36stop) кролики с CL умерли в течение 3 дней после рождения из-за проблема сосания (рис. 2F). Кроме того, не было выявлено мутаций, не соответствующих цели. обнаружен на 22 потенциальных нецелевых сайтах в GADD45G (p.Q36stop) кролики (рис. S4). Праймеры для нецелевого анализа: перечислено в дополнительных данных 2. 3.3. Отсутствие ХЛ у гетерозиготных кроликов GADD45G (p.Q36stop) Благодаря высокой эффективности системы CRISPR / Cas9 и BE4-Gam, нет гетерозиготных кроликов с мутацией GADD45G (GADD45G +/-) (Рис. S1 и S2), что ограничивало определение фенотипа ХЛ у GADD45G +/− кролики. К счастью, кролик G1-2 GADD45G (p.Q36stop) без CL и могли дожить до полового созревания (рис. 3A и B). Мы предположить, что это связано с мутацией мозаицизма из-за микроинъекции [54], которые широко наблюдались у рыбок данио [55], мышей [56] и Drosophila [57] при использовании системы редактирования генов на основе CRISPR. Чтобы определить, является ли гетерозиготный GADD45G (p.Q36stop) кролики (GADD45G +/- кролики) будут CL, кролики-самки G1-2 будут скрещивали с самцами новозеландских кроликов WT и родили 5 живых детенышей. Результаты секвенирования по Сэнгеру показали, что гетерозиготный GADD45G (p.Q36stop) мутация была определена у всех детенышей, при этом CL у этих кроликов GADD45G +/- (рис. 3C и D). Однако возможно что в G1-2 могут присутствовать модификаторы, которые могут изменить скорость расщепления. Следовательно, скрещивая гетерозиготы F1, мы получили кроликов GADD45G - / - с заячьей губой и кроликов GADD45G +/- без заячьей губы. Это еще раз подтвердило отсутствие заячьей губы в 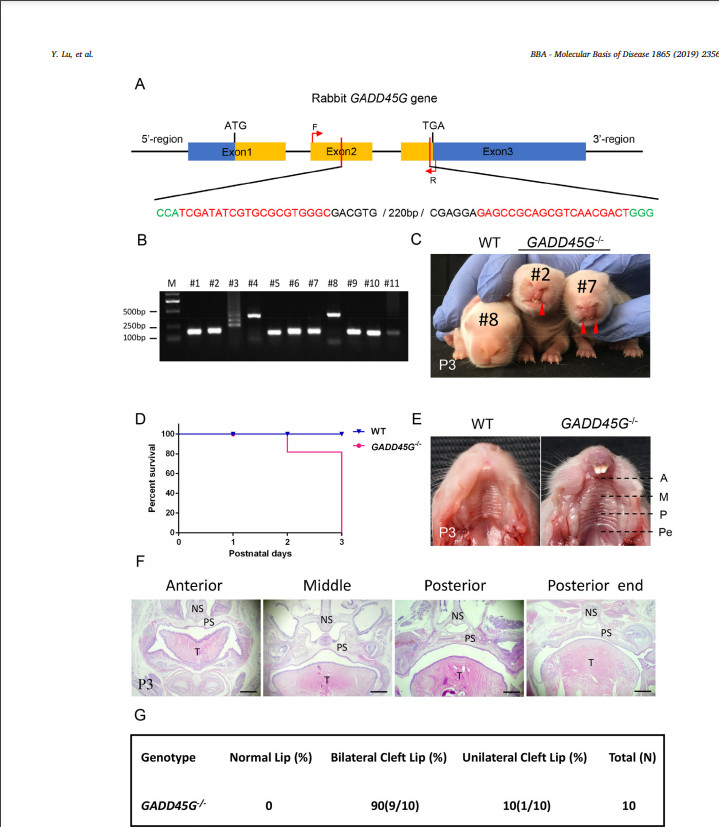 Рис. 1. Генерация кроликов GADD45G KO с использованием системы CRISPR / Cas9. (A) Схематическая диаграмма двух сайтов-мишеней sgRNA, расположенных в экзоне 2 и экзоне 3 локуса GADD45G кролика. CDS (последовательность, кодирующая аминокислоты в белке) GADD45G обозначен оранжевыми рамками; целевые сайты двух последовательностей sgRNA (sgRNA1 и sgRNA2) выделены красным, мотив, прилегающий к протоспейсер (PAM) последовательности выделены зеленым. Праймеры F и R использовали для обнаружения мутаций. (B) Обнаружение мутации с помощью ПЦР у детенышей №1– №11. M, лестница ДНК (DL2000). №1– №11, детеныши кроликов с мутацией GADD45G. (C) Фотографии кроликов GADD45G - / - с односторонней или двусторонней заячьей губой (CL) (красные стрелки) в постнатальные 3 дня. (P3). (D) Кривые выживаемости Каплана-Мейера для кроликов GADD45G - / - и WT (E) Нижний вид небных полок P3 GADD45G - / - и кроликов WT. Пунктирные линии указать эквивалентное положение коронковых сечений; А, передний; М, средний; P, задний; Пе, задний конец. (F) окрашенные H и E коронарные срезы головы кролика P3 показаны передняя, средняя, задняя и задняя концевые области. NS, носовая перегородка; Т, язычок; ПС, небные полки. (G) Распределение CL у кроликов GADD45G - / - показан как процент мутантов, которые демонстрируют нормальную губу или CL, по сравнению с общим количеством проанализированных мутантов. WT: контроль дикого типа. Масштабные линейки: 1 мм (панель F). (Для интерпретации ссылок на цвет в легенде этого рисунка, читателю отсылается к онлайн-версии этой главы.) 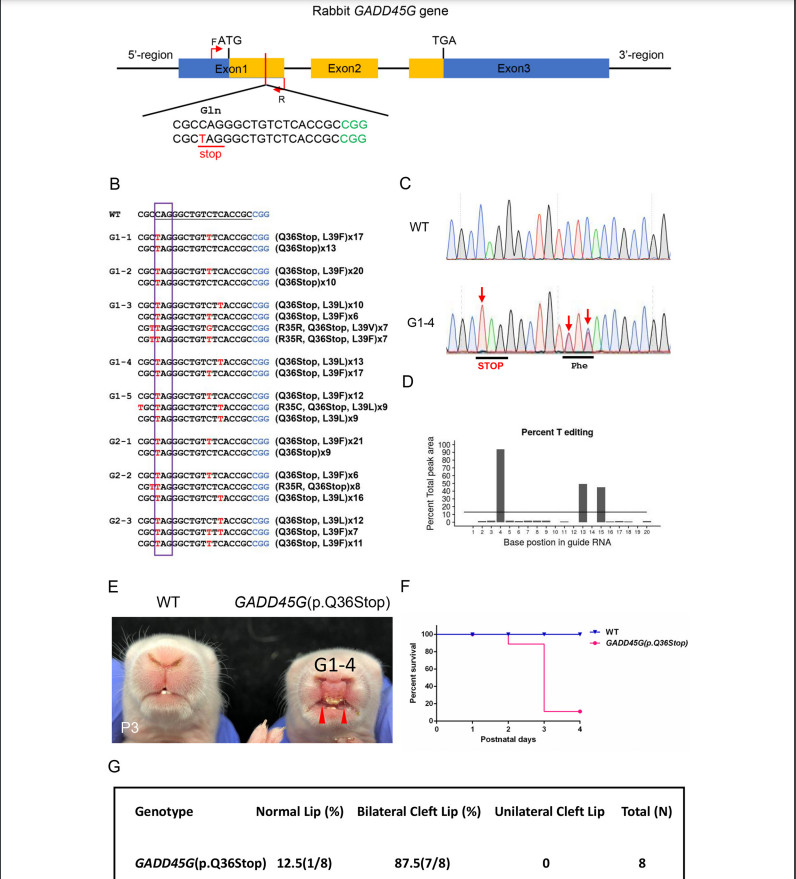 \Рис. 2. Создание модели кролика GADD45G (p.Q36Stop) с использованием системы BE4-Gam. \Рис. 2. Создание модели кролика GADD45G (p.Q36Stop) с использованием системы BE4-Gam.(A) Целевая последовательность в локусе GADD45G. Последовательность-мишень (черный), область PAM (зеленый), область CDS (оранжевый) и замещенный нуклеотид (красный, C = T). Соответствующие идентичности кодонов в целевом сайте представлены под последовательностью ДНК. Праймеры F и R использовали для обнаружения мутаций. (B) ПЦР-ампликоны сайт-мишень из геномной ДНК мутантных кроликов субклонировали в вектор pGM-T и секвенировали. Указывается количество клонов для каждого образца последовательности. Последовательность-мишень (подчеркнута), область PAM (синий) и замещенный нуклеотид (красный). Фиолетовый прямоугольник указывает кодон терминации. (C) Хроматограммы секвенирования по Сэнгеру ДНК кроликов WT и GADD45G (p.Q36Stop) (G1-4). Красная стрелка указывает на замещенный нуклеотид. Соответствующие идентификаторы кодонов на целевом сайте представлены под последовательностью ДНК. (D) Прогнозируемая линейчатая диаграмма редактирования, основанная на хроматограммах секвенирования Сэнгера из G1-4 от EditR. (E) GADD45G (p.Q36Stop) кролики показали двустороннюю заячью губу (красные стрелки) в точке P3. (F) Кривые выживания Каплана-Мейера для кроликов GADD45G (p.Q36Stop) и WT. (G) Распределение ХЛ в мутантах GADD45G (p.Q36Stop) показано как процент мутантов, которые демонстрируют нормальную губу или ХЛ, по сравнению с общим числом проанализированных мутантов. (Для интерпретации ссылок на цвет в легенде этого рисунка, читателю отсылается к онлайн-версии этой главы.) гетерозиготные кролики GADD45G (рис. 3E и S5). В дополнение предсказанные 3D-модели показали нарушенную структуру белка GADD45G (Рис. 3F), что также подтверждается вестерн-блоттингом. Как показано в Рис. 3G и H, белок GADD45G был значительно снижен в GADD45G +/- кроликов при полной потере экспрессии у GADD45G - / - кролики по сравнению с кроликами WT (p <0,01). 3.4. GADD45G необходим для формирования и слияния верхней губы Ранее исследование показало высокую экспрессию GADD45G в дорсальный средний мозг, нервная трубка, черепные и задние корневые ганглии Эмбрионы мыши E9.5 [17]. Между тем, формирование верхней губы начинается на E9.5 эмбриогенеза мыши [19], это означает, что GADD45G может играют роль в формировании губ и их слиянии. Кроме того, верхняя губа образуется в результате синергетического роста и слияния MXP с LNP и МНП [58]. Таким образом, мы исследовали черепно-лицевую морфологию GADD45G - / - кролик на 3-й день отела (P3) по окрашиванию H&E. В результат показал нарушение сращения предчелюстной и боковой стенок губ, двусторонние расщелины в области верхней губы (черная пунктирная рамка), и отсутствующие волосяные фолликулы (черная стрелка) у кроликов GADD45G - / - (Рис. 4A). Чтобы выяснить, требуется ли GADD45G для верхних формирование и слияние губ, сканирующая электронная микроскопия и иммуногистохимия (ИГХ) проводились между днём зарождения 13 (E13) WT и GADD45G - / - кролики. Сканирующая электронная микроскопия подтвердила двусторонние расщелины области верхней губы, LNP и MNP. явно недостаточно развиты, и MNP не удалось распространить на LNP в E13 GADD45G - / - кролики (белая стрелка). Кроме того, E15 Эмбрионы GADD45G - / - показали четкую полностью двустороннюю ХЛ (белая пунктирная линия). box), что по сравнению с кроликами WT нормального развития (рис. 4B). Кроме того, результат IHC подтвердил высокую экспрессию GADD45G в эпителий против мезенхимы MNP и LNP WT E13 кролики, в то время как у кроликов GADD45G - / - экспрессии нет (фиг. 4C). Этот результат был также подтвержден q-ПЦР, выявившим значительно сниженную экспрессию GADD45G у кроликов GADD45G - / - (p <0,001) (Рис. 4D). Таким образом, результаты показывают, что GADD45G играет ключевую роль в формирование и срастание верхней губы за счет регулирования роста лицевые отростки и / или слияние MNP и LNP. 3.5. Повышенная пролиферация клеток и снижение EMT в MNP и LNP GADD45G - / - эмбрион Обширные исследования показали важную роль пролиферации клеток. и EMT в черепно-лицевом развитии [20,25,34,59]. Таким образом, ячейка пролиферация и EMT между эмбрионами E13 WT и GADD45G - / - сравнивали анализ с использованием фосфогистона H3 (PH3), E-кадгерина и окрашивание виментином соответственно. Результат IHC показал значительно увеличенное количество митотических клеток (PH3-положительных) в MNP и LNP E13 GADD45G - / - эмбрионы (p <0,01), что по сравнению с E13 Эмбрионы WT (рис. 5А и В). Кроме того, иммуноокрашивание на екадгерин показало, что E-кадгерин значительно увеличился в эпителии λ (белая пунктирная линия) у эмбрионов E13 GADD45G - / - (красное окрашивание). (Рис. 5C), а иммуноокрашивание на виментин показало, что виментин значительно снизился в пределах мезенхимы (белая пунктирная линия) в E13 GADD45G - / - эмбрионы (зеленое окрашивание) (рис. 5D). Эти результаты предполагают, что повышенная пролиферация клеток и снижение EMT связаны с нарушением слияния губ у E13 GADD45G - / - эмбрионов. 3.6. Снижение апоптоза в MNP и LNP GADD45G - / - эмбриона При λ происходят множественные клеточные процессы, включая апоптоз, опосредуют удаление эпителиальных клеток по швам [19,20,60]. Апоптоз обеспечивает что достаточное количество клеток удалено из эпителиального шва, чтобы способствует адгезии промежуточного процесса конвергенции и происходит до и во время слияния в MNP и LNP [19]. Таким образом, чтобы Чтобы определить наличие аномального апоптоза у эмбрионов GADD45G - / -, мы провели иммунофлуоресценцию (IF) расщепленной каспазы-3 и Окрашивание TUNEL между кроликами E13 WT и GADD45G - / -. В качестве Как показано на фиг. 6B и D, сниженный апоптоз в MNP и LNP были определены в эмбрионах E13 GADD45G - / -, которые сравнили с эмбрионами E13 WT (p <0,05). Более того, мы обнаружили апоптотические клетки на швах в контроле, но не у GADD45G - / - эмбрионов. Интересно, что мы обнаружили, что апоптотические клетки регулярно располагаются на LNP и MNP (белая пунктирная линия) у WT E13 эмбриона, в то время как беспорядочное расположение у E13 GADD45G - / - эмбрионов (Рис. 6A и C). Эти результаты показали, что снижение апоптоза в эпителиальных швах во время морфогенеза верхней губы у эмбрионов E13 GADD45G - / -. Взятые вместе, эти результаты предполагают, что потеря GADD45G приводит к повышенной пролиферации клеток при снижении ЭМП и апоптоза в MNP и LNP, что в конечном итоге приводит к возникновению CL в эмбрионе GADD45G - / - (рис. 6E) 4. Обсуждение Хотя GADD45G был идентифицирован как кандидатный ген CL / Prelated [6,9,10], прямая демонстрация связи между О GADD45G и CL / P не сообщалось. В этом исследовании путем инактивации GADD45G на кроликах, мы предоставляем первую прямую модель на животных доказательства функции GADD45G в формировании и слиянии верхней губы. Эти кролики показали CL, и все погибли в течение трех дней из-за сосания проблема. Хотя предыдущие исследования показали, что GADD45G не необходимо для эмбрионального развития, кроме определения пола [14–16,61], это может быть связано с различиями в генетическом фоне мышей и кроликов. В этом исследовании мы впервые получили кроликов GADD45G KO путем инъекции мРНК Cas9 и пары sgRNAs, нацеленных на экзон 2 и экзон 3 GADD45G и продемонстрировали, что кролики GADD45G KO выставили CL. Однако нецелевые эффекты являются серьезной проблемой в системе редактирования генов, опосредованной Cas9 [62,63]. Недавно редакторы основ цитозина (CBEs) и системы редакторов основ аденина (ABEs) были разработаны которые непосредственно выполняют преобразование нуклеотидов без введения двухцепочечные разрывы (DSB) и низкий нецелевой эффект [64,65]. Таким образом, как CRISPR / Cas9, так и BE4-Gam были использованы для мутации Ген GADD45G в этом исследовании. Эти результаты подтвердили, что наше животное результаты уровня, в частности, связаны с мутацией GADD45G, хотя не нецелевые эффекты. Кроме того, функциональные домены GADD45G белок были предсказаны с использованием веб-ресурса (http://smart.embl.de) [66], где показано, что в Рис. 3. Отсутствие ХЛ у гетерозиготных кроликов GADD45G +/-. (A) Хроматограммы секвенирования по Сэнгеру ДНК кроликов WT и GADD45G (p.Q36Stop) (G1-2). Красная стрелка указывает на замещенный нуклеотид. Соответствующие 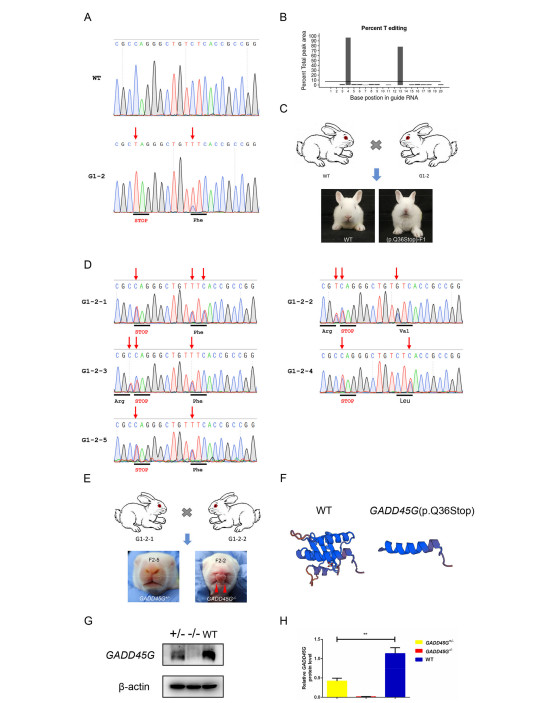 Рис. 3. Отсутствие ХЛ у гетерозиготных кроликов GADD45G +/-. Рис. 3. Отсутствие ХЛ у гетерозиготных кроликов GADD45G +/-.(A) Хроматограммы секвенирования по Сэнгеру ДНК кроликов WT и GADD45G (p.Q36Stop) (G1-2). Красная стрелка указывает на замещенный нуклеотид. Соответствующие Идентичность кодонов в целевом сайте представлена под последовательностью ДНК. (B) Прогнозируемый график редактирования на основе хроматограмм секвенирования Сэнгера из G1-2 пользователя EditR. (C) Кролик-самец (WT) был повязан с кроликами-самками (G1-2), и у этих детенышей F1 отсутствует CL. (D) Хроматограммы секвенирования по Сэнгеру ДНК из F1 щенки. Красная стрелка указывает на замещенный нуклеотид. Соответствующие идентичности кодонов в целевом сайте представлены под последовательностью ДНК. (E) Женский G1-2-2 кролик был повязан с кроликом-самцом G1-2-1, и у гетерозиготных кроликов GADD45G отсутствует заячья губа. (F) Компьютерное моделирование трехмерной структуры между WT и GADD45G (p.Q36Stop). (G) Вестерн-блоттинг ткани уха кроликов с мутантным геном GADD45G. Использовали равные количества белка, и β-актин был внутренний контроль. (H) Анализ результатов вестерн-блоттинга по шкале серого с помощью программного обеспечения ImageJ. Планки погрешностей представляют ± SEM. ** р <0,01 Белок GADD45G (позиции: с 24 по 113), а также CRISPR / Cas9 и Опосредованная BE4-Gam мутация гена разрушит этот домен и повлияет на его деятельность. На сегодняшний день был проведен ряд генетических мутаций модельных животных. созданы для изучения человеческих трещин, таких как Irf6, p63, Wnt и Bmp гены [46,67–69]. Хотя расщелины вторичного неба часто встречаются у трансгенных или нокаутных эмбрионов животных, изолированные животные с CL модель очень редка [70–72]. По сравнению с кроликами WT GADD45G Кролики-мутанты демонстрировали ХЛ без ЦП. Таким образом, эта модель обеспечивает один из немногих, CL без CP животных моделей черепно-лицевого заболевания и позволяет нам лучше понять и изучить различные аспекты развитие губ и неба в эмбриональном периоде. Кроме того, скрещивая мозаичную самку кролика G1-2 с дикими самцами и скрещивая гетерозиготы F1, мы не обнаружили ХЛ у гетерозиготных GADD45G (p.Q36stop) кролики. Таким образом, мы предполагаем, что GADD45G - рецессивный ген CL. Аналогичным образом, общие гены CL, такие как IRF6, Lrp6 и patched1 являются рецессивными генами в CL [34,60,73]. Предыдущие исследования показали, что морфогенез лица требует точная координация процедур, включая пролиферацию, дифференциацию и апоптоз [20]. Мы исследовали связь между ЕМТ и развитие губ с использованием мутанта GADD45G в эмбриональном период. E13 GADD45G - / - эмбрионы, демонстрирующие белок E-кадгерин, были Рис. 4. GADD45G необходим для формирования и сращения верхней губы. (A) Поперечная срединная область лица наблюдалась у кроликов P3 WT и GADD45G - / - при окрашивании H&E. GADD45G - / - кролики с двусторонней расщелиной губы и отсутствием волосяные фолликулы в предчелюстной области (черные стрелки). (B) Ген GADD45G необходим для формирования средней зоны лица. Сканирующая электронная микроскопия (SEM) E13 и E15 эмбрионы кроликов. У кроликов GADD45G - / - заячья губа (белая пунктирная рамка). Белые стрелки указывают на дефект слияния в месте слияния LNP / MNP. (С) Иммуногистохимия (ИГХ) показывает, что GADD45G высоко экспрессируется в эпителии LNP и MNP и мезенхиме эмбрионов E13. (D) q-ПЦР подтвердила высокая экспрессия GADD45G в λ эмбрионов E13. GAPDH использовался в качестве контроля загрузки. Были проанализированы три образца. Планки погрешностей представляют ± SEM. *** р <0,001. N = 3 биологически независимых образца. Масштабные линейки: 100 мкм (панели A и C). 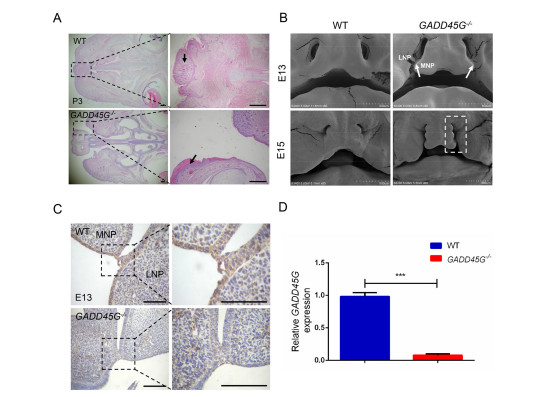 Рис. 5. Повышенная пролиферация клеток и снижение EMT в MNP и LNP эмбриона E13 GADD45G - / -. Рис. 5. Повышенная пролиферация клеток и снижение EMT в MNP и LNP эмбриона E13 GADD45G - / -.(A) Окрашивание фосфорилированного гистона H3 (PH3) показывает повышенную пролиферацию клеток в LNP и MNP эмбрионов кролика E13 GADD45G - / -. (B) Сравнение процента пролиферации клеток в обозначенной области в контрольных и E13 GADD45G - / - эмбрионах кроликов. (C) Иммунофлуоресценция (IF) показывает низкий E-кадгерин у WT. элементы управления; наоборот, высокий E-кадгерин в мутантных λ-точках (белая пунктирная линия) E13 GADD45G - / - эмбрионов кролика. (D) Иммунофлуоресценция (IF) показывает высокую виментин в контроле WT; наоборот, низкий уровень виментина у эмбрионов кролика E13 GADD45G - / -. N = 3 биологически независимых образца. Масштабные линейки: 100 мкм. ** р <0,01. значительно увеличился по сравнению с WT в эпителии λ, и Белок виментина был значительно снижен по сравнению с диким животным в течение мезенхима. Они согласуются с другими, которые указали выяснилось, что трансформация шовного эпителия в мезенхиму через процесс EMT имеет решающее значение для сращения губ [20,25,26]. Следовательно аберрантный EMT, наблюдаемый у мутанта GADD45G, вероятно, частично ответственен за CL. Кроме того, эмбрионы GADD45G - / - показали снижение гибель эпителиальных клеток и увеличение пролиферации клеток в MNP и LNP. Мы постулируем, что баланс между пролиферацией и гибелью клеток был сломан, в результате чего образовался стойкий эпителиальный шов. Наша работа согласуется с другими исследованиями, которые показывают, что стойкость эпителиального шов является результатом снижения гибели клеток и увеличения пролиферации, связанной с CL / P [45,58,60]. Более того, мы были удивлены, обнаружив апоптотические клетки регулярно располагаются на мезенхимальном крае LNP и MNP на E13 (рис. 6A и C). Это явление может быть связано с миграция клеток во время слияния губ и лежащий в основе механизм этого наблюдения еще предстоит изучить. Насколько нам известно, это первый отчет на уровне животных, КЛ, вызванная мутантом GADD45G у кроликов. Кроме того, текущий исследование предоставляет доказательства того, что GADD45G необходим для пролиферации клеток, EMT и апоптоза LNP и MNP, что важно для формирование и слияние верхней губы. Дополнительные данные к этой статье можно найти в Интернете по адресу https: // doi.org/10.1016/j.bbadis.2019.05.015. Документ прозрачности Документ прозрачности, связанный с этой статьей, можно найти, в онлайн-версии. Заявление о конкурирующих интересах Авторы заявляют об отсутствии конкурирующих интересов. Благодарности Авторы благодарят Пейрана Ху за прекрасную техническую помощь в Центре разработки эмбрионов. Финансирование Это исследование финансировалось Национальным ключевым исследованием. и Программа развития китайских стволовых клеток и трансляционных Исследования (2017YFA0105101), Программа для ученых Чанцзяна и Группа инновационных исследований в университете (№ IRT_16R32), Стратегическая Программа приоритетных исследований Китайской академии наук 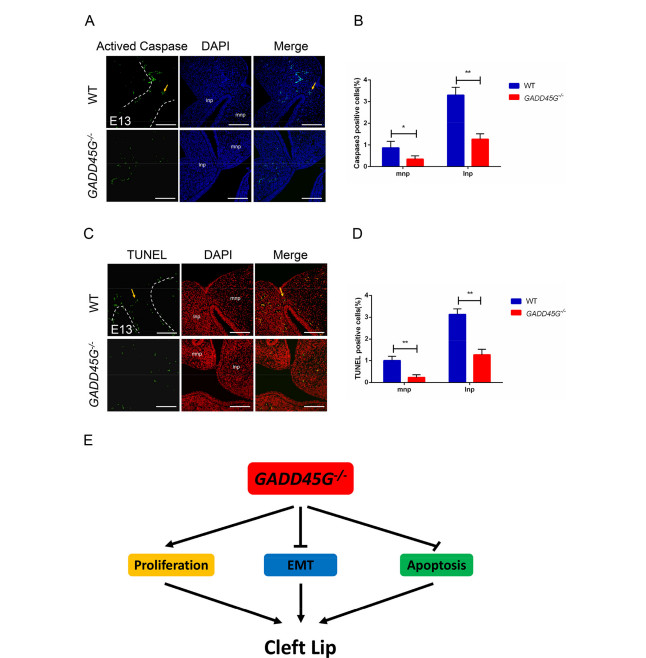 Рис. 6. Снижение апоптоза в MNP и LNP GADD45G - / - эмбриона. Рис. 6. Снижение апоптоза в MNP и LNP GADD45G - / - эмбриона.(A) Активированная антикаспаза 3, демонстрирующая локализованный апоптоз на краю LNP и MNP (белая пунктирная линия) в контрольном WT, в то время как сниженный апоптоз на λ из E13 GADD45G - / - эмбрионы. Между тем, активированная анти-каспаза 3 показывает локализованные клетки апоптоза в швах в контроле, но не в эмбрионах GADD45G - / - (оранжевый стрелка на вставке). (B) Сравнение процента положительных по каспазе 3 клеток в обозначенной области λ в контроле WT и эмбрионах E13 GADD45G - / -. (C) ТУНЕЛЬ окрашивание показывает, что гибель клеток значительно снижается по λ эмбрионов GADD45G - / - на E13. (D) Количественная оценка количества TUNEL-положительных клеток в обозначенная область в контроле WT и эмбрионах E13 GADD45G - / -. (E) Модель для важной роли GADD45G в морфогенезе средней зоны лица. Причины потери GADD45G непрерывная пролиферация клеток, увеличение количества клеток, положительных по E-кадгерину, и подавление апоптоза λ и, в конечном итоге, приводит к CL. Планки погрешностей представляют ± SEM. * р <0,05. ** р <0,01. N = 3 биологически независимых образца. Масштабные линейки: 100 мкм. (Для интерпретации ссылок на цвет на этом рисунке Легенда, читатель может обратиться к онлайн-версии этой главы.) Ю. Лу и др. BBA - Molecular Basis of Disease 1865 (2019) 2356–2367 2365 (XDA16030501, XDA16030503) и провинции Гуандун. Проект технологического плана (2014B020225003). Вклад авторов И Лу и Чжаньцзюнь Ли разработали исследование; Чжицюань Лю, Цюаньцзюнь Чжан и Минмин Лян проанализировали данные; И Лу, Чжаньцзюнь Ли, Минмин Лян и Юнин Сун провели исследование; И Лу, Лянсюэ Лай и Чжаньцзюнь Ли написал статью; Минмин Лян и Юнин Сун предоставили новые реагенты или аналитические инструменты; и все авторы прочитали и одобрил окончательный вариант рукописи. |
