Организационный этап
|
Организация начала урока (3 мин)
Деление на группы способом «МОЗАИКА».Берется две картинки с рисунками термометра и стакана с водой, разрезаются на части по числу участников. Каждому участнику выдается по кусочку открытки. Когда открытки будут сложены, образуются группы.
2. Психологический настрой
Все сумели мы собраться,
За работу дружно взяться,
Будем думать, обсуждать,
Можем мы урок начать!Формулировка и запись темы урока и цели урока (1 мин)
Задание для повторение
Фронтальный опрос:
Закончить предложение:
1). Электролитическая диссоциация – это….
2). Электролиты – это….
3). Неэлектролиты – это…
4). Дайте определение кислотам с точки зрения ТЭД. Приведите примеры.
5). Дайте определение щелочам с точки зрения ТЭД. Приведите примеры.
6). Дайте определение солям с точки зрения ТЭД. Приведите примеры.
7). Что показывают уравнения: а) NaCl – Na++Cl- и б) Na++Cl- - NaCl ? Как осуществить эти процессы в домашних условиях?
|
Ученики делятся на группы. Осмысливают поставленную цель.
|
Интерактивное обучение
|
Диалогическое обучение
Саморегулируемое обучение
Критическое мышление
|
Изучение нового материала
|
Самостоятельная работа в группах.
Степень электролитической диссоциации.
Отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе, называют степенью диссоциации.
Степень диссоциации(α–греческая буква альфа) - это отношение числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N):
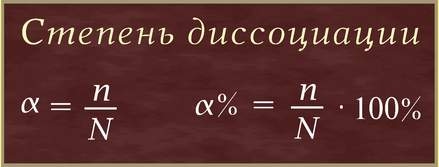
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.
Степень диссоциации зависит от природы электролита и растворителя, от концентрации электролита, температуры.
1. Зависимость степени диссоциации от добавления одноименных ионов: при добавлении одноименных ионов в раствор, степень диссоциации уменьшается.
2. Зависимость степени диссоциации от концентрации электролита: с уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается.
3. Зависимость степени диссоциации от температуры: степень диссоциации возрастает при повышении температуры.
Сильные и слабые электролиты
В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% — средними, менее 3% — слабыми электролитами.
Сильные электролиты
|
Слабые электролиты
|
В водных растворах полностью диссоциируют на ионы; молекул электролитов в таких растворах нет
|
В водных растворах не полностью диссоциируют на ионы; в таких растворах одновременно содержатся продукты диссоциации и ассоциации (ионы и молекулы электролита)
|
а —> 100%
|
а —> 0
|
Примеры: щелочи — растворимые основания щелочных и щелочноземельных металлов: LiOH, NaOH, КОН, CsOH, Са(ОН)2, Sr(OH)2, Ва(ОН)2; сильные кислоты: НС1, HBr, HI, H2S04, HNO3,НС104; почти все растворимые соли
|
Примеры: плохо растворимые в воде основания: Сu(ОН)2, Fe(OH)2, Mg(OH)2- и щелочь NH4OH; слабые кислоты: Н2С03, H2S, H2S03, HN02, Н3РО4,HF, CH3COOH,H2Si03; вода H20
|
Задание для группам
1.Чему равна степень диссоциации электролита, если при растворении его в воде из каждых 100 молекул на ионы распалось: а) 5 молекул, б) 80 молекул?
2.В перечне веществ подчеркните слабые электролиты.
H2SO4; H2S; CaCl2; Ca(OH)2; Fe(OH)2; Al2(SO4)3; Mg3(PO4)2; H2SO3; КОН, KNO3; HCl; BaSO4; Zn(OH)2; CuS; Na2CO3.
Критерии оценивания
|
Дескрипторы
|
Учащийся умеет решать задачи, используя числа, записанные в стандартном виде
|
Верно решает задачу делением чисел, записанных в стандартном виде
|
Верно решает задачу умножение чисел, записанных в стандартном виде
|
Верно решает задачу вычитанием чисел, записанных в стандартном виде
|
Верно решает задачу выполняя несколько действий с числами, записанными в стандартном виде
|
Работа в парах Задача 2
Запишите уравнение поэтапной диссоциации веществ:
• H2CО3;
• Mg(ОH)2;
• H3PО4;
• Ca(OH)2.
Задание 3
Что означает выражение: степень диссоциации равна 0,25; 50 %; 15 %; 0,0017?
Задание 4
Вычислите степень диссоциации, если известно, что при температуре 25 °С в воде растворилось молекул вещества:
• 20 из 200;
• 10 из 80;
• 30 из 100;
• 50 из 150.
Индивидуальная работа
Составить уравнения диссоциации сильных электролитов: Ca(N03)2, HN03, LiOH.
Составить уравнения диссоциации слабых электролитов: HN02, Fe(OH)2, H2S.
Вычислить степень диссоциации электролита (в %), если из:
а) 1000 молекул продиссоциировало 500 (0,5 (в долях), или 50%);
б) 50 молекул продиссоциировало 5 (0,1, или 10%);
в) 1000 молекул продиссоциировало 3 (0,003, или 0,3%). Помните, что перевод долей в проценты осуществляетсяумножением на 100.
|
Работая в группах, ученики самостоятельно изучают новый материал.
Дети решают задание в парах
|
Словесная оценка учителя
. Взаимооценивание
Стратегия «Стикер
|
Критическое мышление.
Саморегулируемое обучение (самонаправленность в процессе работы над заданиями).
Презентация к уроку 2
https://www.youtube.com/watch?v=SAWr-KZhD0E
Распечатки с заданиями
|
 Скачать 43.61 Kb.
Скачать 43.61 Kb.