Методичка СТРОЕНИЕ АТОМА. Строение атома методические указания к практическим занятиям по курсу общей и неорганической химии для студентов химических и нехимических специальностей дневной и вечерней форм обучения Нижний Новгород 2007
 Скачать 321.5 Kb. Скачать 321.5 Kb.
|
|
ТЕСТЫ 1. Какая комбинация элементарных частиц приводит к образова-нию нейтрального атома? ОТВЕТЫ: 1) 8p, 8n, 7e; 2) 8p, 10n, 10e; 3) 6p, 7n, 7e; 4) 8p, 10n, 8e. 2. Какой заряд имеет частица (ион), состоящая из 3 электронов, 4 протонов и 6 нейтронов? ОТВЕТЫ: 1) +1; 2) -3; 3) +4; 4) -1. 3. По представленным ниже комбинациям протонов и нейтронов в атомных ядрах укажите ту, которая отвечает элементу с наибольшим порядковым номером в периодической системе. ОТВЕТЫ: 1) 20n и 20p; 2) 21n и 18p; 3) 20n и 19p; 4) 22n и 19p. 4. Укажите значение массового числа атома, состоящего из 4 протонов, 4 электронов и 6 нейтронов. ОТВЕТЫ: 1) 4; 2) 6; 3) 8; 4) 10. 5. Ниже представлен состав ядер некоторых элементов. Укажите пару нуклидов, являющихся изотопами. ОТВЕТЫ: 1) 6р, 6n и 6p, 7n; 2) 8p, 8n и 7p, 7n; 3) 4p, 4n и 5p, 5n; 4) 4p, 5n и 5p, 5n. 6. Изотопы элементов различаются: 1) числом протонов; 2) числом нейтронов; 3) числом электронов; 4) зарядом ядра. 7. В переходе Na → Na+ изменяется число: 1) нейтронов; 2) протонов; 3) электронов. Запишите переход с помощью электронных формул. 8. Частица некоторого элемента содержит 2 электрона, 3 протона и 4 нейтрона. Укажите правильную комбинацию порядкового номера элемента, его массового числа и заряд частицы. 33 ОТВЕТЫ: 1) 5, 7, -2; 2) 3, 5, +1; 3) 3, 7, +1; 4) 7, 5, +3. 9. Частица с массой протона, но не имеющая заряда называется: ОТВЕТЫ: 1) изотоп; 2) тритий; 3) нейтрон; 4) дейтерий. 10. Главное квантовое число характеризует: 1) форму электронного облака; 2) подуровень энергии; 3) ориентацию электронного облака в пространстве; 4) размер электронного облака; 5) основной запас энергии электрона в атоме; 6) спин электрона. 11. Орбитальное квантовое число определяет: 1) основной запас энергии уровня; 2) форму атомной орбитали; 3) ориентацию атомной орбитали в пространстве; 4) удаленность атомной орбитали от ядра. 12. Атомная орбиталь – это состояние электрона в невозбужден-ном атоме, характеризуемое набором следующих квантовых чисел: 1) n +l; 2) n + l +ml; 3) n + l + ms; 4) l + ms + ms. 13. Электронный подуровень (подслой) – это состояние электрона в атоме, характеризуемое следующим набором квантовых чисел: ОТВЕТЫ: 1) n, ml, ms; 2) n, l; 3) n, l, ml; 4) n, l, ml, ms. 14. Электронный уровень (слой) – это состояние электрона в атоме, характеризуемое следующим набором квантовых чисел: ОТВЕТЫ: 1) n; 2) n, l; 3) n, l, ml; 4) n, l, ml, ms. 15. Укажите атомную орбиталь, для которой сумма значений главного и орбитального квантовых чисел равна 5. ОТВЕТЫ: 1) 5p; 2) 3d; 3) 4s; 4) 3p. 16. Для 4 - го энергетического уровня недопустимым значением орбитального квантового числа является значение: 1) 0; 2) 1; 3) 3; 4) 4. 17. Какие квантовые числа являются одинаковыми для указанных электронов на 3d подуровне?      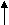 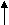 ОТВЕТЫ: 1) n, l, ms; 2) n, l; 3) n, l, ml. 34 18. Сколько разрешенных положений в пространстве имеют атомные орбитали с квантовым числом l = 3? ОТВЕТЫ: 1) 5; 2) 1; 3) 3; 4) 7. 19. Максимальное число атомных орбиталей на третьем энергетическом уровне равно: 1) 18; 2) 32; 3) 8; 4) 9. 20. Число электронных слоев у атомов четвертого периода равно: 1) 5; 2) 3; 3) 8; 4) 4. 21. Какое максимальное число электронов может содержать атом в электронном слое с главным квантовым числом n = 4? ОТВЕТЫ: 1) 8; 2) 36; 3) 14; 4) 18; 5) 32. 22. Число электронных слоев у атомов четвертого периода равно: 1) 5; 2) 3; 3) 8; 4) 4. 23. Сколько значений магнитного квантового числа возможно для электронов энергетического подуровня, орбитальное квантовое число которого l = 3? ОТВЕТЫ: 1) 0; 2) 1; 3) 3; 4) 7; 5) 5. 24. Какие значения магнитного квантового числа возможны для электронов p-подуровня? ОТВЕТЫ: 1) 0;+1; 2) -1; 0;+1; 3) -3;-2;-1;0;+1;+2;+3; 4) -2;-1;0;+1;+2; 5) 0;+1;+2. 25. Каковы значения главного и орбитального квантовых чисел для электрона, находящегося на подуровне 4d? ОТВЕТЫ: 1) n=2, l=0; 2) n=4, l=0; 3) n=4, l=1; 4) n=4, l=2. 26. Чему равно максимальное число электронов на уровне «n»? ОТВЕТЫ: 1) n2; 2) 2n2; 3) n; 4) 2n. 27. Какой из энергетических подуровней является запрещенным? ОТВЕТЫ: 1) 4f; 2) 2d; 3) 3d; 4) 2p. 28. У элементов одного периода одинаковое число: 1) электронов; 2) заполняемых энергетических уровней; 3) внешних электронов; 4) валентных электронов. 29. Какая из электронных конфигураций не противоречит правилу Хунда? ОТВЕТЫ: 1) p1x p1y p1z; 2) p1x p1y p2z; 3) p2x p2y p1z; 4) p1x p2y p2z. 35 30. Как изменяется полная энергия электронов в атоме по мере его удаления от ядра? ОТВЕТЫ: 1) уменьшается; 2) увеличивается; 3) постоянна. 31. Как изменяется энергия электронов в атоме в пределах одного квантового слоя с увеличением орбитального квантового числа? ОТВЕТЫ: 1) уменьшается; 2) увеличивается; 3) постоянна. 32. Элементы d-семейства не появляются в третьем периоде потому, что: 1) у элементов III периода отсутствуют d-орбитали; 2) энергия 3d–орбитали выше энергии 4s атомных орбиталей; 3) энергия 3d–орбитали ниже энергии 4s атомных орбиталей. 33. Элементы d-семейства характеризуются заполнением электронами подуровней энергий в последовательности ( n – главное квантовое число и номер внешнего электронного слоя): 1) ns→np→ nd; 2) ns→(n-1)d→np; 3) (n-1)d→ns→np; 4) (n-1)d→np→ns. 34. Какие из электронных конфигураций противоречат правилу Хунда? 1) p2x p2y p1z; 2) p1x p1y p2z; 3) p2x p2y p1z; 4) p1x p2y p2z. 35. Какая из электронных конфигураций не соответствует принципу Паули? 1) p1x p1y p1z; 2) p1x p1y p3z; 3) p2x p2y p2z; 4) p1x p2y p2z. 36. Электронная формула элемента 1s22s22p63s23p63d24s2. В каком периоде, группе, подгруппе, семействе находится данный элемент? Назовите его. 37. Какая из следующих электронных конфигураций отвечает основному состоянию атома алюминия (атомный номер Al=13)? 1) [Ne]3s23p1; 2) [Ne]3s3; 3) [Ne]3d3; 4) [Ne]3p3; 5) [Ne]3s23d1. 38. Как объяснить наблюдаемую закономерность в изменении ионизационных потенциалов элементов II периода ( JLi =5,39 эВ; JBe =9,32 эВ )? ОТВЕТЫ: 1) электроотрицательность у Li больше, чем у Be; 2) сродство к электрону у Li больше, чем у Be; 3) атомный радиус у Li меньше, чем у Be; 4) требуется большая энергия для отрыва электрона от Be(г) по сравнению с Li(г). 36 39. Как объяснить наблюдаемую закономерность в изменении первых потенциалов ионизации элементов II периода ( JC=11,26 эВ; JN=14,53 эВ)? ОТВЕТЫ: 1) требуется меньшая энергия для отрыва электрона от С(г) по сравнению с N(г); 2) требуется большая энергия для отрыва электрона от С(г) по сравнению с N(г); 3) атомный радиус С меньш е N; 4) электроотрицательность у С больше, чем у N; 5) сродство к электрону у С больше, чем у N. 40. Какой элемент имеет в атоме 1 электрон, для которого n=3 и l=1? ОТВЕТЫ: 1) Na; 2) S; 3) As; 4) P; 5) Al. 41. Какая из следующих электронных конфигураций отвечает основному состоянию атома титана (атомный номер Ti=22)? 1) [Ar]4s13d3; 2) [Ar]3d4; 3) [Ar]3p4; 4) [Ar]4s23d2; 5) [Ar]4s24p2. 42. В атоме пять электронов. Какая конфигурация атомных орбиталей соответствует минимальному значению энергии? ОТВЕТЫ: 1) 1s22p3; 2) 2s22p3; 3) 1s22s22p1; 4) 1s22p23s1. 43. Определите местоположение в периодической системе элемента, валентная формула которого 4d55s2? ОТВЕТЫ: 1) 5 период VII-В группа; 2) 4 период II-В группа; 3) 2 период V-А группа; 4) 5 период II-а группа. 44. Укажите элемент, который не размещен в V группе периодической системы. ОТВЕТЫ: 1) 5s22p3; 2) 4s24p3; 3) 6s26p3; 4) 4d45s1. 45. У какого из элементов валентные электроны расположены на одном энергетическом уровне? ОТВЕТЫ: 1) 22Ti; 2) 14Si; 3) 24Cr; 4) 26Fe. 46. Укажите порядковый номер элемента по заданной электронной формуле: 1s22s22p63s23p64s1. ОТВЕТЫ: 1) 6; 2) 39; 3) 12; 4) 19. 47. Какой ряд содержит только d- элементы? ОТВЕТЫ: 1) Ca, Sc, Ti; 2) Al, Ga, In; 3) Fe, Co, Ni; 4) F, Cl,Br. 48. Определите элемент в периодической системе, валентная формула которого в возбужденном состоянии 4s14p34d2. 37 ОТВЕТЫ: 1) 5-й период VI-В группа; 2) 4-й период VI-А группа; 3) 2-й период V-А группа; 4) 4-й период III-А группа. 49. На 4d- подуровне атома находится 5 электронов. Определите место элемента в периодической системе. ОТВЕТЫ: 1) 5-й период VII-В группа; 2) 4-й период VI-А группа; 3) 2-й период V-А группа; 4) 4-й период III-А группа. 50. Определите место элемента в периодической системе, если он имеет следующее распределение электронов по валентным орбиталям в возбужденном состоянии:          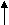 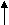 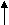 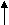 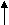 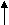 3s 3p 3d ОТВЕТЫ: 1) 4-й период, IV-В группа; 2) 3-й период, IV-А группа; 3) 3-й период, VI-А группа; 4) 5-й период, IV-В группа. 51. Количество электронов на валентных 3d-орбиталях равно 7. Определите место элемента в периодической системе. ОТВЕТЫ: 1) 3-й период, VII-А группа; 2) 4-й период, VIII-В группа; 3) 3-й период V-А группа; 4) 5-й период IV-В группа. 52. Количество электронов на валентных орбиталях атома равно 7. Суммарный спин электронов = 2,5. Определите группу элемента в периодической системе. ОТВЕТЫ: 1) VII-А 2) VII-В; 3) II-А; 4) IV-В. 53. В каких периодах могут находиться элементы, для которых максимальное значение суммарного спина электронов (невозбужденное состояние атома) может быть равным 3,5? ОТВЕТЫ: 1) 4-7 периоды; 2) 5-7 периоды; 3) 6-7 периоды; 4) 1-4 периоды. 54. Какой из элементов относится к p-элементам? ОТВЕТЫ: 1) Mg; 2) Zn; 3) Al; 4) Fe. 55. Какая из электронных формул валентного уровня является правильной? ОТВЕТЫ: 1) 4d25p3; 2) 4s14p2; 3) 6s26p3; 4) 3d54s1. 56. Укажите элемент с наибольшим атомным радиусом. 38 ОТВЕТЫ: 1) O; 2) F; 3) S; 4) Cl. 57. Укажите атом с наибольшим значением энергии ионизации. ОТВЕТЫ: 1) Se; 2) Ar; 3) S; 4) Cl. 58. Как изменяется радиус в ряду ионов: K+, Ca2+, Sc3+ ? ОТВЕТЫ: 1) увеличивается; 2) уменьшается; 3) не изменяется. 59. Для какого элемента Be, Mg, Ca, Sr плотность 1s электронного облака больше? ОТВЕТЫ: 1) Be; 2) Mg; 3) Ca; 4) Sr. 60. Какой из элементов K, Zn или Br имеет большую энергию ионизации? ОТВЕТЫ: 1) К; 2) Zn; 3) Br. 61. Как изменяется радиус атомов в ряду ионов F- - Cl- - Br- - I-? ОТВЕТЫ: 1) увеличивается; 2) уменьшается; 3) не изменяется. 62. Для какого элемента B, P или Ca плотность 1s электронного облака больше? ОТВЕТЫ: 1) В; 2) Р; 3) Са. 63. Как изменяется радиус частиц в ряду Fe – Fe2+- Fe3+? ОТВЕТЫ: 1) увеличивается ; 2) уменьшается; 3) не изменяется. 39 Государственное образовательное учреждение высшего профессионального образования НИЖЕГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ им. Р.Е.АЛЕКСЕЕВА Кафедра «Общая и неорганическая химия» СТРОЕНИЕ АТОМА Методические указания к практическим занятиям по курсу общей и неорганической химии для студентов химических и нехимических специальностей дневной и вечерней форм обучения Нижний Новгород 2007 Составители: Л.А.Смирнова, Ж.В.Мацулевич, Г.А.Паничева, Г.Ф.Володин, Л.Н.Четырбок, С.В.Краснодубская. УДК 54 (07) СТРОЕНИЕ АТОМА : метод. указания к практ. занятиям по курсу общей и неорганической химии для студентов химических и нехимических специальностей дневной и вечерней форм обучения/ НГТУ; сост.: Л.А.Смирнова и др. Н.Новгород, 2007-39 с. Методические указания включают задания для текущего контроля знаний в виде вопросов и задач по строению атома. Научный редактор Ю.М.Тюрин Редактор Э.Б.Абросимова Подп. к печ. 6.09.07. Формат 60х84 1/16. Бумага газетная Печать офсетная. Печ.л. 2,4. Уч.-изд.л. 2,4. Тираж 1500 экз. Заказ Нижегородский государственный технический университет им. Р.Е. Алексеева. Типография НГТУ. 603950, Н.Новгород, ул.Минина, 24. Нижегородский государственный технический университет им. Р.Е. Алексеева, 2007 |
