Строение и свойства атома химического элемента (Fe)
 Скачать 0.53 Mb. Скачать 0.53 Mb.
|
     МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ  ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ «МОСКОВСКИЙ АВИАЦИОННЫЙ ИНСТИТУТ (национальный исследовательский университет)» Кафедра «Технология композиционных материалов, конструкций и материалов» Реферат По дисциплине: Общая Химия ТЕМА: Строение и свойства атома химического элемента (Fe)
Москва 2018г. Оглавление:
История Открытия.Железо англ. Iron, франц. Fer, нем. Eisen) - один из семи металлов древности. Весьма вероятно, что человек познакомился с железом метеоритного происхождения раньше, чем с другими металлами. Метеоритное железо обычно легко отличить от земного, так как в нем почти всегда содержится от 5 до 30% никеля, чаще всего - 7-8%. С древнейших времен железо получали из руд, залегающих почти повсеместно. Наиболее распространенны руды гематита (Fe2O3,), бурого железняка (2Fe2O3, ЗН2О) и его разновидностей (болотная руда, сидерит, или шпатовое железо FeCO,), магнетита (Fe304) и некоторые другие. Все эти руды при нагревании с углем легко восстанавливаются при сравнительно низкой температуре начиная с 500oС. Получаемый металл имел вид вязкой губчатой массы, которую затем обрабатывали при 700-800oС повторной проковкой. Этимология названий железа на древних языках довольно отчетливо отражает историю знакомства наших предков с этим металлом. Многие древние народы, несомненно, познакомились с ним, как с металлом, упавшим с неба, т. е. как с метеоритным железом. Так, в древнем Египте железо имело название би-ни-пет (бенипет, коптское - бенипе), что в буквальном переводе означает небесная руда, или небесный металл. В эпоху первых династий Ур в Месопотамии железо именовали ан-бар (небесное железо). В папирусе Эберса (ранее 1500 г. до н.э.) имеются два упоминания о железе; в одном случае о нем говорится как о металле из города Кэзи (Верхний Египет), в другом - как о металле небесного изготовления (артпет). Древнегреческое название железа, так же как и северокавказское - зидо, связано с древнейшим словом, уцелевшим в латинском языке,-- sidereus (звездный от Sidus - звезда, светило). На древнем и современном армянском языке железо называется еркат, что означает капнувшее (упавшее) с неба. O том, что древние люди пользовались вначале именно железом метеоритного происхождения, свидетельствуют и распространенные у некоторых народов мифы о богах или демонах, сбросивших с неба железные предметы и орудия, - плуги, топоры и пр. Интересен также факт, что к моменту открытия Америки индейцы и эскимосы Северной Америки не были знакомы со способами получения железа из руд, но умели обрабатывать метеоритное железо.. Железные изделия из метеоритного железа найдены в захоронениях, относящихся к очень давним временам (IV - V тысячелетиях до н.э.), в Египте и Месопотамии. Однако железный век в Египте начался лишь с ХIIв. до н. э., а в других странах еще позднее. В древнерусской литературе слово железо фигурирует в древнейших памятниках (с XI в.) под названиями желъзо, железо, жельзо. Нахождение в природе Железо - самый распространенный после алюминия металл на земном шаре; оно составляет около 5% земной коры. Встречается железо в виде различных соединений: оксидов, сульфидов, силикатов. В свободном виде железо находят в метеоритах, изредка встречается самородное железо (феррит) в земной коре как продукт застывания магмы. Железо входит в состав многих минералов, из которых слагаются месторождения железных руд. Основные рудные минералы железа: Гематит (железный блеск, красный железняк) - Fe2O3 (до 70% Fe); Магнетит (магнитный железняк) - Fe3O4 (до 72,4% Fe); Гетит - FeOOH Гидрогетит - FeOOH*nH2O (лимонит) - (около 62% Fe); Сидерит - Fe(CO3) (около 48,2% Fe); Пирит - FeS2 Месторождения железных руд образуются в различных геологических условиях; с этим связано разнообразие состава руд и условий их залегания. Железные руды разделяются на следующие промышленные типы: Бурые железняки - руды водной окиси железа (главный минерал - гидрогетит), 30-55% железа. Красные железняки, или гематитовые руды (главный минерал - гематит, иногда с магнетитом), 51-66% железа. Магнитные железняки (главный минерал - магнетит), 50-65% железа. Сидеритовые или карбонатные осадочные руды, 30-35% железа. Силикатные осадочные железные руды, 25-40% железа. Большие запасы железных руд находятся на Урале, где целые горы (например Магнитная, Качканар, Высокая и др.) образованы магнитным железняком. Большие залежи железных руд имеются вблизи Курска, на Кольском полуострове, в Западной и Восточной Сибири, на дальнем Востоке. Богатые залежи имеются на Украине. Железо является также одним из наиболее распространенных элементов в природных водах, где среднее содержание его колеблется в интервале 0,01-26 мг/л. 3.ПолучениеПромышленное железо получают выплавкой чугуна и стали. Чугун - это сплав железа с примесями кремния, марганца, серы, фосфора, углерода. Содержание углерода в чугуне превышает 2% (в стали менее 2%). Чистое железо получают:
Чугун получают из железных руд восстановлением оксидов железа. Выплавку чугуна осуществляют в доменных печах. В качестве источника тепла в доменной печи используется кокс. Доменная печь является очень сложным техническим сооружением высотой в несколько десятков метров. Она выкладывается из огнеупорного кирпича и защищается внешним стальным кожухом. По состоянию на 2013 год самая крупная доменная печь была построена в Южной Корее сталелитейной компанией POSCO на металлургическом заводе в городе Кванъян (объем печи после модернизации составил 6000 кубометров при ежегодной производительности 5 700 000 тонн).  Рис. Доменная печь. Процесс выплавки чугуна в доменной печи идет непрерывно в течение нескольких десятилетий, пока печь не выработает свой ресурс. 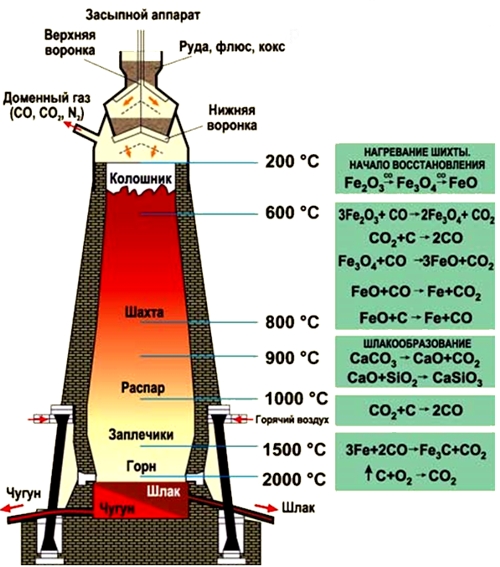 Рис. Процесс выплавки чугуна в доменной печи.
Сталь выплавляют из чугуна и металлолома конверторным способом (мартеновский уже устарел, хотя еще и применяется) или электроплавкой (в электропечах, индукционных печах). Суть процесса (передела чугуна) заключается в понижении концентрации углерода и других примесей путем окисления кислородом. Как уже было сказано выше, концентрация углерода в стали не превышает 2%. Благодаря этому, сталь в отличие от чугуна достаточно легко поддается ковке и прокатке, что позволяет изготавливать из нее разнообразные изделия, обладающие высокой твердостью и прочностью. Твердость стали зависит от содержания углерода (чем больше углерода, тем тверже сталь) в конкретной марке стали и условий термообработки. При отпуске (медленном охлаждении) сталь становится мягкой; при закалке (быстром охлаждении) сталь получается очень твердой. Для придания стали нужных специфических свойств в нее добавляют лигирующие добавки: хром, никель, кремний, молибден, ванадий, марганец и проч. 4.Физические свойстваЖелезо — типичный металл, в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Часто выделяют так называемую «триаду железа» — группу трёх металлов (железо Fe, кобальт Co, никель Ni), обладающих схожими физическими свойствами, атомными радиусами и значениями электроотрицательности. Для железа характерен полиморфизм, оно имеет четыре кристаллические модификации:
Металловедение не выделяет β-Fe как отдельную фазу, и рассматривает её как разновидность α-Fe. При нагреве железа или стали выше точки Кюри (769 °C ≈ 1043 K) тепловое движение ионов расстраивает ориентацию спиновых магнитных моментов электронов, ферромагнетик становится парамагнетиком — происходит фазовый переход второго рода, но фазового перехода первого рода с изменением основных физических параметров кристаллов не происходит. Для чистого железа при нормальном давлении, с точки зрения металловедения, существуют следующие устойчивые модификации:
Наличие в стали углерода и легирующих элементов существенным образом изменяет температуры фазовых переходов (см. фазовую диаграмму железо—углерод). Твёрдый раствор углерода в α- и δ-железе называется ферритом. Иногда различают высокотемпературный δ-феррит и низкотемпературный α-феррит (или просто феррит), хотя их атомные структуры одинаковы. Твёрдый раствор углерода в γ-железе называется аустенитом.
Явление полиморфизма чрезвычайно важно для металлургии стали. Именно благодаря α—γ переходам кристаллической решётки происходит термообработка стали. Без этого явления железо как основа стали не получило бы такого широкого применения. Железо относится к умеренно тугоплавким металлам. В ряду стандартных электродных потенциалов железо стоит до водорода и легко реагирует с разбавленными кислотами. Таким образом, железо относится к металлам средней активности. Температура плавления железа 1539 °C, температура кипения — 2862 °C
Электронное строение атомаАтом железа состоит из положительно заряженного ядра (+26), внутри которого есть 26 протонов и 30 нейтронов (массовое число равно 56), а вокруг, по шести орбитам движутся 26 электронов. 5.1 Электронная формула Fe. 1s22s22p63s23p63d64s2. 5.2 Физический смысл индексовЖелезо
Номер периода показывает количество энергетических уровней в атоме элемента. В атоме железа их 4. Номер группы показывает количество электронов на внешнем уровне. В атоме железа их 8.Порядковый номер показывает заряд ядра атома (количество протонов/электронов). Атом железа имеет заряд 26. Подгруппа «В» является побочной, что показывает содержание d – элементов в атоме. (В атомах побочных групп электроны могут появляться на d - и f – орбитаталях). Электронная конфигурация атома железа - 1s22s22p63s23p63d64s2 . В образовании химических связей с другими элементами могут участвовать 2 электрона, находящихся на внешнем 4s-уровне + 6 электронов 3d-подуровня (всего 8 электронов), поэтому в соединениях железо может принимать степени окисления +6, +3, +2, (наиболее часто встречаются +3, +2). Железо обладает средней химической активностью. 5.3 Валентные подуровни. Принадлежность s,p,d,f элементовЖелезо является d-элементом, к которому причисляется еще 31 элемент таблицы Менделеева (это 4-7 периоды). С возрастанием порядкового номера, свойства д-элементов приобретают небольшие изменения. Атомный радиус у этих веществ также медленно возрастает. Они обладают переменной валентностью, которая зависит от того, что пред-внешний d-электронный подуровень является незавершенным. Потому для железа валентными есть не только s-электроны, находящиеся во внешнем слое, но и неспаренные 3d-электроны пред-внешнего слоя. И, как следствие, валентность Fe в химических соединениях может равняться 2, 3, 4, 5, 6. В основном, она равна 2 и 3 – это более устойчивые соединения железа с другими веществами. В менее устойчивых - он проявляет валентность 4, 5, 6. Но, такие соединения встречаются реже. 5.4 Квантовые числа для валентных электронов.
5.5 Степени окисленияЖелезо может существовать в виде простого вещества – металла, а степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно. Для железа характерны степени окисления (+2) и (+3): Fe+2O, Fe+32O3, Fe+2(OH)2, Fe+3(OH)3, Fe+2Cl2, Fe+3Cl3, Fe+2SO4, Fe+32(SO4)3. Известны соединения железа со степенью окисления (+6), они носят название «ферраты» (K2Fe+6O4). 5.6 Принцип наименьшей энергии (правило Гунда)Энергетическая диаграмма (внешнего энергетического уровня)основного состояния принимает следующий вид: 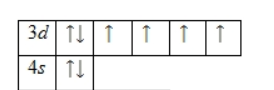 5.7 Бинарные соединения Fe. Фторид железа. В бинарных соединениях железо проявляет лишь степень окисления +2 и +3,причем более устойчивое соединение Fe(+3). Оксид Fe Fe2O3 взаимодействует со щелочами, оксидами и карбонатами различных металлов (обычно при сплавлении) с образованием ферритов: Fe2O3 + 2NaOH → 2NaFeO2 + H2O. Гидроксид Fe При добавлении щелочей к растворам, содержащим Э2+, выпадают в осадок гидроксиды Э(ОН)2. Гидроксид железа (II) желтовато-белого цвета, на воздухе легко окисляется в красно-коричневый Fe(OH)3: 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3. Гидроксид Fe(OH)3 выпадает в осадок при действии щелочей на растворы солей Fe3+: FeCl3 + 3KOH → Fe(OH)3 + 3KCl. Э(ОН)3 являются слабыми основаниями, плохо растворимыми в воде, причем для Fe(ОН)3 характерны амфотерные свойства: Fe(OH)3 + 3HCl → FeCl3 + 3H2O; Fe(OH)3 + 3KOH → K3[Fe(OH)6] Соли Соли Э3+ гидролизуются сильнее, чем соли Э2+. При окислении Fe(OH)3 в щелочной среде образуются ферраты – соли не выделенной в свободном состоянии железной кислоты H2FeO4, где степень окисления железа равна +6: 2Fe(OH)3 + 10KOH + 3Br2 → 2K2FeO4 + 6KBr + 8H2O. Ферраты являются очень сильными окислителями: 2K2FeO4 + 2NH3×H2O → 2Fe(OH)3 + N2 + 4KOH. Фторид железа (III) FeF3 Фторид железа(III) – неорганическое соединение, соль металла железа и плавиковой кислоты, зеленые кристаллы, слабо растворяется в воде, образуя кристаллогидраты. Физические свойства: Фторид железа(III) образует зелёные кристаллы тригональной сингонии, пространственная группа R 3c, параметры ячейки a = 0,523 нм, c = 0,6702 нм, Z = 3. Образует кристаллогидраты состава FeF3•n H2O, где n = 3, 4½, 6 и 9. Слабо растворяется в воде с сильным гидролизом (стабильны только сильно подкисленные растворы). Не растворяется в этаноле и эфире. Химические свойства: Разлагается при нагревании на воздухе:{\displaystyle {\mathsf {4FeF_{3}+3O_{2}\ {\xrightarrow {T}}\ 2Fe_{2}O_{3}+6F_{2}\uparrow }}} 4FeF3+3O2 → 2Fe2O3+6F2 В водных растворах подвергается гидролизу: FeF3+H2O → Fe(OH)3+3HF {\displaystyle {\mathsf {FeF_{3}+H_{2}O\ {\xrightarrow {}}\ Fe(OH)_{3}+3HF}}}Ступенчато восстанавливается водородом: FeF3+H2 → FeF2→Fe {\displaystyle {\mathsf {FeF_{3}+H_{2}\ {\xrightarrow[{-HF}]{T}}\ FeF_{2}\ {\xrightarrow[{-HF}]{T}}\ Fe}}}С фторидами щелочных металлов образует комплексные соединения:{\displaystyle {\mathsf {FeF_{3}+3LiF\ {\xrightarrow {}}\ Li_{3}[FeF_{6}]}}} FeF3+KF → K[FeF4] FeF3+3LiF → Li[FeF6] Получение: Реакция фтора с порошкообразным железом: 2Fe+3F2 → 2FeF3{\displaystyle {\mathsf {2Fe+3F_{2}\ {\xrightarrow {}}\ 2FeF_{3}}}} Действие фтора на дихлорид железа: 2FeCl2+3F2 → 2FeF3+2Cl2 {\displaystyle {\mathsf {2FeCl_{2}+3F_{2}\ {\xrightarrow {}}\ 2FeF_{3}+2Cl_{2}}}}Нагревание оксида железа(III) в атмосфере фторида водорода: Fe2O3+6HF → 2FeF3+3H2O{\displaystyle {\mathsf {Fe_{2}O_{3}+6HF\ {\xrightarrow {T}}\ 2FeF_{3}+3H_{2}O}}} Нагревание хлорида железа(III) с фторидом аммония: FeCl3+3NH4F → FeF3+3NH4Cl {\displaystyle {\mathsf {FeCl_{3}+3NH_{4}F\ {\xrightarrow {T}}\ FeF_{3}+3NH_{4}Cl}}} Свойства соединений Fe6.1 Характер ОксидовОксид железа (II) - FeOПорошок черного цвета, в воде не растворятся. Характер соединения – основный. Способен быстро окисляться, однако и восстанавливаться до простого вещества множества может легко. Растворяется в кислотах, образуя соответствующие соли. Оксид железа (III) - Fe2O3. Порошок мелкокристаллический, красно-бурого цвета. В воде не растворяется, проявляет свойства слабо кислотные, больше амфотерные. 6.2 Характер Гидроксидов Гидроксид железа (II) - Fe(OH)2. Представляет собой белый аморфный осадок. Образуется при реакции солей с основаниями (щелочами). Проявляет слабые основные свойства, способен быстро окисляться на воздухе до соединений железа +3. Гидроксид железа (III) - Fe(OH)3. Вещество, выпадающее в осадок при действии щелочами на соответствующие соли железа. Характер его выраженный амфотерный, цвет буро-коричневый. 6.3 Соли, образуемые FeСоли железа во (II) степени имеют, как правило, бледно-зеленую окраску раствора, хорошо окисляются даже на воздухе, приобретая темно-бурый цвет и переходя в соли железа 3. Растворяются в воде. Примеры соединений: FeCL2, FeSO4, Fe(NO3)2. Соль Мора - FeSO4*(NH4)2SO4*6H2O Это соединение, которое представляет собой кристаллогидрат сульфата железа и аммония. Одно из соединений железа (II), которое получило широкое применение на практике. Основные области использования человеком следующие. Соли, в состав которых входит катион Fe3+. Таких выделено множество, за исключением карбоната, так как происходит гидролиз и выделяется углекислый газ. Примеры формул некоторых солей: Fe(NO3)3, Fe2(SO4)3, FeCL3, FeBr3 и прочие. Применение элемента и его соединенияОбласти применения железа и его сплавовПод железом зачастую подразумевают вовсе не вещество как таковое, а низкоуглеродистую электротехническую сталь – так называется сплав металла по ГОСТ. Действительно чистое железо получить непросто, и используется оно исключительно для производства магнитных материалов. Железо является ферромагнетиком, то есть, намагничивается в присутствии магнитного поля. Однако это его свойство сильно зависит от примесей и структуры металла. Магнитные свойства абсолютного чистого железа в 100–200 раз превышают аналогичные показатели технической стали. То же самое можно сказать о величине зерна: чем крупнее зерно, тем лучше магнитные свойства вещества. Имеет значение и механическая обработка, хотя ее влияние и не столь впечатляющее. Только такое железо применяют для получения всех магнитных материалов для электротехники и магнитоприводов. СоединенияВсе металлы, используемые в производстве, делят на цветные и черные. Черные – это сплавы железа, в частности, сталь и чугун, остальные – медные, никелевые, серебряные, относятся к цветным. Соответственно, производство, занимающееся выплавкой чугуна и стали, называется черной металлургией, а всех остальных – цветной. На долю черной металлургии приходится 95% всех металлургических процессов. Разделяются черные сплавы таким образом:
Конечно, наибольшее применение находят сталь и чугун, а их использование зависит от доли углерода в составе. По этому признаку различают углеродистые и легированные стали. В первом случае примеси носят постоянный характер, то есть, попадают в сплав из-за особенностей процесса выплавки. В легированные добавки вводят специально для придания материалу особых свойств. В качестве легирующих элементов применяют ванадий, титан, хром, никель и так далее.
Перлит широко используют в садоводчестве в качестве удобрений, мульчи, для повышения влажности воздуха и т.д.
8.Список литературы1) Дымов А. М., Савостин А. П. Аналитическая химия галлия. М., 1968; 2) К. А. Гемпел. Справочник по редким металлам. — Рипол Классик, 2013 3) Геннадий Авласенко, Юлия Добрыня, Дмитрий Ковзун. Увлекательная химия 4) Процессы экстракции и сорбции в химической технологии галлия. Алма-Ата, 1985; 5) Федоров П. И., Мохосоев М. В.. Алексеев Ф. П. Химия галлия, индия и таллия. 6) https://ru.wikipedia.org/wiki | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
