Реферат по химии, элемент Германий. Химия, германий. Строение и свойства атомов химических элементовгерманий
 Скачать 124.91 Kb. Скачать 124.91 Kb.
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «МОСКОВСКИЙ АВИАЦИОННЫЙ ИНСТИТУТ (национальный исследовательский университет)» ИНСТИТУТ №12 Кафедра «Технология испытаний и эксплуатации» Реферат На тему: «Строение и свойства атомов химических элементов-германий» Выполнил: М.А. Лысяков Группа: Т12О-101С-18 Проверил: Белая А.В. Москва 2018 Содержание 1 История открытия……………………………………………………………….3 2 Нахождение в природе………………………………………………………….3 3 Получение……………………………………………………………………….4 4 Физические свойства……………………………………………………………4 5 Электронное строение атома…………………………………………………...5 5.1 Электронная формула атома германия…………………………………….5 5.2 Физический смысл индексов германия в Периодической системе Д.И. Менделеева………………………………………………………………………...5 5.3 Наборы квантовых чисел германия………………………………………..5 5.4 Степени окисления германия………………………………………………6 5.5 Типы бинарных соединений германия…………………………………….6 6 Свойства соединений германия………………………………………………..6 6.1 Характер оксидов германия………………………………………………..6 6.2 Характер гидроксидов………………………………………………………7 6.3 Соли германия………………………………………………………………7 7 Применение германия и его соединений……………………………………...8 8 Список использованных источников…………………………………………..9 История открытия Открытие германия было предсказано еще в 1869 году русским химиком Дмитрием Ивановичем Менделеевым в докладе о периодическом законе химических элементов. В статье 1870 года Д.И. Менделеев называет неоткрытый элемент экасилицием (из-за нахождения в Периодической таблице), также предсказал его атомную массу и другие свойства. В 1885 году в одной из шахт Саксонии был обнаружен новый минерал аргиродит. Немецкий химик Клеменс Винклер провел химический анализ данного минерала и смог обнаружить новый химический элемент. В 1886 году ученому удалось выделить этот элемент, также Клеменс Винклер отметил схожесть данного элемента с сурьмой. Об открытии нового элемента Винклер сообщил в двухстраничной статье, которая датируется 6 февраля 1886 года, в ней же он предложил название для нового элемента Germanium и символ Ge. Позже он издал две большие статьи 1886-1887 гг., в которых подробно описал все свойства германия. Первоначально Клеменс Винклер хотел назвать новый элемент “нептунием”, но это название уже было дано одному из предполагаемых элементов, поэтому элемент получил название в честь родины ученого-Германии. С помощью анализа тетрахлорида германия Винклер определил атомный вес германия, открыл несколько новых соединений этого металла. Нахождение в природе Общее содержание германия в земной коре больше, чем, например содержание сурьмы, серебра, висмута. Германий из-за незначительного содержания в земной коре и геохимического сродства с другими широко распространенными элементами почти не имеет склонности к образованию собственных минералов. Поэтому собственные минералы германия в природе встречаются крайне редко, обычно они представляют собой сульфосоли, такие как: германит, аргиродит, конфильдит и другие. В основном германий рассеян в большом числе горных пород и минералов. В сфалеритах содержание германия достигает 1 килограмма на тонну, в энаргитах до 5 килограмм на тонну, в пирагиритах до 10 килограмм на тонну, в других сульфидах и силикатах-сотни и десятки грамм на тонну. Германий концентрируется в месторождениях многих металлов, например, в сульфидных рудах цветных металлов, в железных рудах, в залежах некоторых окисных металлов (хромит, магнетит, рутил), в гранитах, диабазах и базальтах, присутствует почти во всех силикатах, в некоторых месторождениях каменного угля и нефти. Получение Германий в природе встречается в виде примеси к полиметаллическим, никелевым, вольфрамовым рудам, в силикатах. Процесс обогащения руды очень сложный и трудоемкий, после концентрирования руды германий выделяют в виде оксида GeO2, который восстанавливают водородом при 600 градусов Цельсия до простого вещества. GeO2+2H2=Ge+2H2O Получение чистого германия проводится методом зонной плавки, что делает его одним из самых химически чистых материалов. Физические свойства Германий это хрупкий, серебристо-белый полуметалл. Кристаллическая решетка устойчивой при нормальных условиях аллотропной модификации-кубическая типа алмаза. Температура плавления германия-938,25 градусов Цельсия, кипения-2850 градусов Цельсия. Плотность германия 5,33 грамм на сантиметр кубический. Германий является одним из немногих аномальных веществ, которые увеличивают плотность при плавлении. Плотность твердого германия 5,327 грамм на сантиметр кубический (25 градусов Цельсия), жидкого – 5,557 грамм на сантиметр кубический (1000 градусов Цельсия). Вещества обладающие этим свойством-вода, кремний, галлий, сурьма, висмут, церий. Теплоемкость германия имеет аномальный вид, она содержит пик над уровнем нормальной колебательной составляющей, которая не может быть объяснена никаким физическим законом, но это объясняется больцмановским фактором, такую же аномальную теплоемкость имеет гафний, алмаз, графит. Германий по электрофизическим свойствам является непрямозонным полупроводником. Основные полупроводниковые свойства нелегированного монокристаллического германия Статическая диэлектрическая проницаемость ε = 16,0 Ширина запрещенной зоны (при 300 К) Eg = 0,67 Эв Собственная концентрация ni=2,33·1013 см−3 Эффективная масса: электронов, продольная: mII=1,58m0, mII=1,64m0 электронов, поперечная: m┴=0,0815m0 , m┴=0,082m0 дырок, тяжелых: mhh=0,379m0 дырок, легких: mhl=0,042m0 Энергия сродства к электрону: χ = 4,0 эВ. Легированный галлием германий в виде тонкой плёнки переходит при низких температурах в сверхпроводящее состояние. Германий в природе состоит из смеси пяти изотопов, первые четыре изотопа стабильны, пятый слабо радиоактивен и испытывает двойной бета-распад с периодом полураспада 1,58*1021 лет. Искусственно всего было получено 27 радиоизотопов с атомными массами от 58 до 89. Наиболее стабильным из радиоизотопов является 68Ge, с периодом полураспада 270,95 суток, наименее стабильным-60Ge, с периодом полураспада 30 мс. Электронное строение атома Электронная формула атома германия 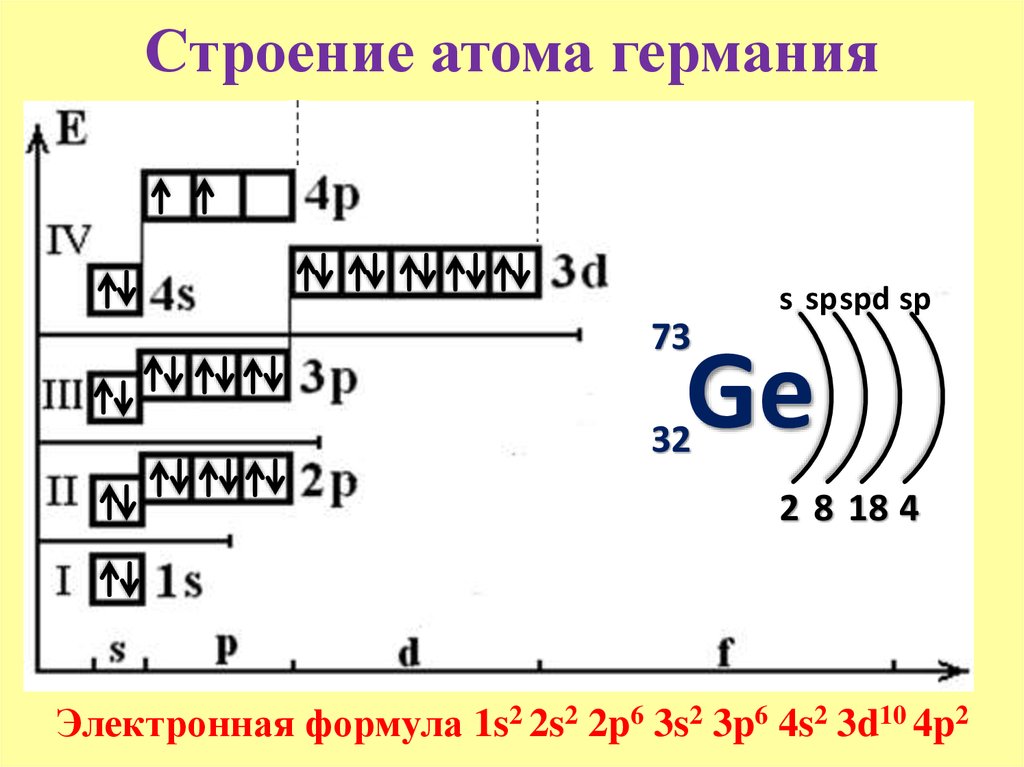 Рис. 1-Электронная формула германия. Физический смысл индексов германия в Периодической системе Д.И. Менделеева Германий находится в 4 периоде, что указывает на количество энергетических уровней в атоме, в 4 группе, что говорит о количестве электронов на внешнем подуровне, принадлежит к главной подгруппе, номер группы также указывает на высшую степень окисления германия. Порядковый номер указывает на количество протонов в ядре и электронов вокруг ядра. Наборы квантовых чисел германия У германия 4 валентных электрона, значит главное квантовое число для всех валентных электронов равно n=4, орбитальное квантовое число I для двух s-электронов равно 0, для p-электронов равно 1, магнитное квантовое число m для s-электронов равно -1/2 и +1/2, для каждого p-электрона оно равно -1/2. Набор квантовых чисел валентных электронов атома германия: N=4, I=0, m=0, s=-1/2 N=4, I=0, m=0, s=+1/2 N=4, I=1, m=-1, s=-1/2 N=4, I=1, m=0, s=-1/2 Степени окисления германия В соединениях германий может обладать тремя степенями окисления: -4, +2, +4. Типы бинарных соединений германия Германий способен образовывать соли, оксиды и гидроксиды, кислоты. Свойства соединений германия Характер оксидов германия Известно о двух оксидах германия, оксиде германия (II) и оксиде германия (IV). Оксид германия (II) имеет формулу GeO, это бинарное неорганическое соединение, имеет вид серо-черных кристаллов, слабо растворим в воде. Получается прокаливанием гидроксида германия (II) Ge(OH)2=GeO+H2O Сплавлением германия и оксида германия Ge+GeO2=2GeO Это основный оксид. Оксид германия (IV) имеет формулу GeO2 и представляет собой бинарное неорганическое соединение германия с килородом, является амфотерным оксидом. При температуре выше 700 градусов Цельсия при окислении германия образуется двуокись германия. Ge+O2=GeO2 Данный оксид используется при получении чистого германия и его соединений, данный оксид используют в качестве оптического материала для широкоугольных объективов и в линзах объективов оптических микроскопов. Характер гидроксидов Известен один гидроксид германия, который имеет формулу Ge(OH)2, он имеет основный характер. Соли германия Германий способен образовывать соли с галогенами, азотом, серой. Среди галогенидов германия выделяют: бромид германия (IV), иодид германия (II), иодид германия (IV), хлорид германия (IV), фторид германия (IV). Бромид германия представляет из себя бинарное неорганическое соединение германия и брома, это серые кристаллы или бесцветная жидкость, реагирует с водой, растворяется в абсолютном спирте, эфире и других органических растворителях. Иодид германия (II)-бинарное неорганическое соединение германия и йода, желтые кристаллы, растворяется в холодной воде, гидролизуется в горячей воде. Иодид германия (IV) это соединение германия и йода, желто-оранжевые кристаллы, медленно гидролизуются водой, растворяется в сероуглероде, хлороформе, бензоле и других органических растворителях. Хлорид германия-бесцветная жидкость, являющаяся промежуточным продуктом при производстве полуметалла германия. В последнее время его применение значительно возросло благодаря применению его в качестве реагента при производстве оптического волокна. Фторид германия — это бинарное неорганическое соединение германия и фтора, бесцветный газ дымящийся на воздухе, гидролизуется водой. Сильно раздражает дыхательные пути. При взаимодействии с азотом германий образует нитрид германия, который выглядит как коричневые кристаллы. При взаимодействии с серой образуется две соли с разными степенями окисления германия, сульфид германия (II) представляет из себя серо-черные с красным оттенком кристаллы, не растворимые в воде. А сульфид германия (IV) представляет из себя белые кристаллы, плохо растворимые в воде. При взаимодействии германия с серной кислотой образуется сульфат германия (IV), бесцветные кристаллы, гидролизуются в воде. Применение германия и его соединений Основными потребителями германия являются: волоконная оптика, тепловизорная оптика, химические катализаторы, электроника, небольшие количества германия потребляет металлургия. В оптике германий используется благодаря прозрачности в инфракрасной области спектра, германий имеет стратегическое значение в производстве оптических элементов инфракрасной оптики, линз, призм, оптических волокон, оптических окон датчиков. Наиболее важная область применения-оптика тепловизорных камер работающих в диапазоне длин волн от 8 до 14 микрон. Это диапазон для наиболее популярных инфракрасных матриц, используемых в системах пассивного тепловидения, военных системах инфракрасного наблюдения, приборах ночного видения, противопожарных системах. Германий также используется в ИК-спектроскопии в оптических приборах, использующих высокочувствительные ИК-датчики. Для оптических деталей из германия обязательно требуется просветляющее покрытие, обычно используется покрытие из твердого алмазоподобного углерода. Зачастую для изготовления широкоугольных объективов камер, микроскопии и оптического волокна используется оксид германия. До 1970-х годов германий был основным полупроводниковым материалом электронной промышленности и широко использовался в производстве транзисторов и диодов. Позже германий был полностью вытеснен кремнием. На данный момент германий используется в СВЧ-устройствах. Германий также широко применяется в ядерной физике в качестве материала для детекторов гамма-излучения. Используется в ювелирных сплавах. Список использованных источников 1 Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др. 2 Советская энциклопедия, 1988. — Т. 1. — 623 с. 3 Германий // Энциклопедический словарь Брокгауза и Ефрона: в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907. 4 Интернет ресурсы |
