Биокатализаторы. Структурнофункциональные особенности биологических катализаторов Понятие катализатор
 Скачать 158.4 Kb. Скачать 158.4 Kb.
|
|
Занятие 1 Структурно-функциональные особенности биологических катализаторов 1. Понятие «катализатор». Сходства и различия биологического и синтетического катализа. Инженерная энзимология – это новое перспективное научно-техническое направление биотехнологии, в котором удачно сочетаются самые современные достижения биохимии, молекулярной биологии, энзимологии и химической технологии. Катализатор – это вещество, которое повышает скорость химической реакции, не претерпевая при этом необратимых химических изменений. Исходя из природы катализатора, можно выделить два типа катализа – биологический (ферментативный) и неорганический (синтетический). К биологическим катализаторам, или ферментам, применимы основные критерии, которые характерны и для неорганических катализаторов. Во-первых, биологические катализаторы подобно неорганическим остаются после реакции неизменными. Во-вторых, ферменты оказывают свое действие в ничтожно малых концентрациях. В-третьих, ферменты не влияют на величину константы равновесия реакции и изменение свободной энергии. Оба типа катализаторов лишь повышают скорость, с которой система приближается к термодинамическому равновесию, не сдвигая при этом точки равновесия. Общие принципы химической кинетики применимы и к ферментативным реакциям. Математические выражения скорости реакций, ускоряемых обоими типами катализаторов, очень близки, а иногда даже идентичны. Это объясняется общим механизмом каталитических процессов. В обоих случаях в качестве промежуточного соединения образуется комплекс субстрата с катализатором, который в конце реакции распадается с освобождением катализатора и продуктов реакции. Наряду с чертами сходства между двумя типами катализа существуют значительные различия, которые в первую очередь обусловлены белковой природой ферментов. Подавляющее большинство синтетических катализаторов неспецифично. Синтетические катализаторы могут катализировать реакции с участием самых разнообразных реагентов. Например, мелко измельченные платина и палладий могут катализировать реакцию восстановления молекулярным водородом нескольких десятков тысяч химических соединений различной структуры. Ферменты в целом обладают высокой специфичностью действия и избирательно катализируют протекание одного типа реакции с крайне ограниченным числом субстратов. Специфичность фермента, как правило, соответствует его биологической функции. Высокая специфичность не нужна, например, ферменту, основной задачей которого является гидролиз белков до пептидов и аминокислот. В свою очередь, фермент, катализирующий реакцию изомеризации лишь одного соединения, должен быть в высшей степени специфичным. Другой отличительной чертой является то, что многим ферментам для проявления каталитической активности нужны кофакторы и коферменты. При неферментативном катализе скорость реакции практически не зависит от концентрации катализатора. В случае биокатализа концентрация фермента влияет, причем не всегда однозначно, на скорость протекания реакции. В процессе катализа как неорганические, так и биологические катализаторы постепенно утрачивают свою активность. Например, для катализа окисления диоксида серы используют платину. В ходе катализа платина сорбирует примеси из диоксида серы и постепенно теряет свою активность, или, как говорят химики, быстро “отравляется”. Однако биологические катализаторы по сравнению с синтетическими, как правило, менее долговечны. В первую очередь это обусловлено сложной пространственной структурой ферментов, которая обеспечивает специфичность и высокую скорость катализа. В результате воздействия на фермент различных агрессивных факторов пространственная структура фермента достаточно легко нарушается, что приводит к его инактивации. Характерной чертой биологического катализа является возможность его гибкой регуляции различными веществами, которые называются модуляторами или эффекторами. К подобным веществам относятся активаторы и ингибиторы. Первые увеличивают скорость ферментативной реакции, вторые ее тормозят. Ферменты могут подвергаться как обратимому, так и необратимому ингибированию. Таким образом, биологические катализаторы имеют ряд неоспоримых достоинств. Однако нельзя забывать и об их существенных недостатках, которые, впрочем, в отдельных случаях можно устранить с помощью инженерной энзимологии. Структура,_свойства_и_механизм_действия_биокатализаторов'>2. Структура, свойства и механизм действия биокатализаторов Уникальные свойства ферментов (высокая каталитическая активность и субстратная специфичность) обусловлены сложным пространственным строением и наличием в составе молекул определенных комбинаций химических групп. В структуре белков можно условно выделить несколько уровней организации (табл. 1).
Первичная структура. Линейная последовательность аминокислотных остатков, соединенных пептидными связями, называется первичной структурой. Последовательности аминокислот в полипептидных цепях белков всегда точно заданы генетически. Боковые цепи аминокислотных остатков взаимодействуют друг с другом и непосредственным окружением белка, тем самым определяя геометрическую конфигурацию белковой молекулы. Вторичная структура.Это способ расположения полимерной цепи в пространстве, обусловленный главным образом водородными связями между близко расположенными аминокислотными остатками. Существуют две основные формы вторичной структуры белков: α-спираль и β-структура (β-слой). Некоторые аминокислоты, например глутаминовая кислота, аланин и лейцин, способствуют образованию α-спирали. Другие аминокислоты, в частности метионин, валин и изолейцин, чаще встречаются в составе β-структуры. Глицин, пролин и аспарагин обычно расположены в местах изгиба цепи. Таким образом, очевидно, что способ укладки полипептида прямо детерминируется его первичной структурой. Если в каком-либо месте цепи сосредоточено несколько остатков, способствующих образованию спирали, то образуется спираль. Спираль растет в обоих направлениях до тех пор, пока не натолкнется на остаток, препятствующий ее образованию. Подобным же образом в местах, где сгруппированы соответствующие остатки, формируется β-структура. Третичная структура.Вторичные структуры – α-спирали и β-слои – представлены в белке лишь частично. Они перемежаются неупорядоченными участками, в которых белковая цепь обладает значительной гибкостью. В результате белковая молекула сворачивается в глобулу, приобретая определенную пространственную, третичную структуру. Другими словами, третичная структура – это трехмерное расположение всех атомов одной полипептидной цепи. Именно эта структура является биологически функциональной. Основной движущей силой в формировании трехмерной структуры является взаимодействие радикалов аминокислот с молекулами растворителя (воды). При этом неполярные гидрофобные радикалы аминокислот как бы погружаются внутрь белковой молекулы, образуя там «сухие» зоны, в то время как полярные радикалы ориентированы в сторону воды. В какой-то момент возникает термодинамически наиболее выгодная конформация молекулы в целом, и она стабилизируется. В такой форме белковая молекула обладает минимальной свободной энергией и характеризуется согласованностью между всеми видами внутримолекулярных взаимодействий. Свойственный белкам способ организации пространственной структуры – формирование гидрофобного ядра и мозаичной поверхности, содержащей как гидрофильные, так и гидрофобные элементы, – накладывает ограничение на размер глобулы. Начиная с молекулярной массы примерно 14–16 кДа прослеживается тенденция к формированию белковой молекулы из двух (и более) в той или иной степени независимо образованных глобул, каждая из которых имеет свое гидрофобное ядро. Такие глобулы – домены – формируются различными отрезками одной и той же полипептидной цепи. Размеры известных доменов варьируют в диапазоне 40–400 аминокислотных остатков. Таким образом, доменами называют области в третичной структуре белка, которым свойственна определенная автономия структурной организации. Кроме участия в формировании белковой молекулы некоторые домены могут выполнять и собственные задачи. Такие домены называются функциональными. Например, нуклеотидсвязывающий домен дегидрогеназ отвечает за взаимодействие с коферментом НАД+ или НАДФ. Аминоконцевые домены (кринглы) ферментов системы свертывания крови обеспечивают связывание с липидами мембраны и другими белками. Аминоконцевые домены иммуноглобулинов формируют центр связывания антигена. В стабилизации пространственной структуры белков основную роль играют нековалентные связи или так называемые слабые взаимодействия. К ним относятся вандерваальсовы силы, водородные связи, электростатические взаимодействия заряженных групп и гидрофобные взаимодействия. В создании устойчивых конформаций белков важную роль играют также ковалентные связи. Между SH-группами двух остатков цистеина может образовываться дисульфидная связь. Дисульфидные мостики играют роль поперечных связей в полипептидной цепи. Иногда они связывают две различные цепи. Энергия дисульфидной связи – около 293 кДж/моль. По сравнению со слабыми взаимодействиями дисульфидные ковалентные мостики более устойчивы к термическому воздействию. В то же время дисульфидные связи легко восстанавливаются избытком сульфгидрильных соединений, например β-меркаптоэтанолом. Дисульфидные связи довольно часто встречаются в белках, секретируемых клетками, и значительно реже образуются во внутриклеточных ферментах. По-видимому, внутри клеток ферменты защищены от многих воздействий и не нуждаются в дополнительной стабилизации. Четвертичная структура. В том случае, когда белок состоит из нескольких полипептидных цепей, рассматривают еще и четвертый уровень организации – четвертичную структуру. Под четвертичной структурой подразумевают характер упаковки в пространстве отдельных полипептидных цепей (субъединиц), обеспечивающий формирование единого в структурном и функциональном отношениях белка. Субъединицы могут обладать одинаковой или разной первичной, вторичной и третичной структурами. Причем каждая из субъединиц может иметь свой независимый активный центр. Считается, что олигомеризация обеспечивает субъединицам повышенную термостабильность и устойчивость к действию протеиназ. Четвертичная структура стабилизируется теми же силами, что и третичная. Модели действия ферментов как биокатализаторов. Конформация фермента существенно определяет его биологическую активность. Многочисленные экспериментальные факты свидетельствуют о том, что фермент способен выполнять свойственную ему каталитическую функцию, только находясь в определенной трехмерной структуре. Этот принцип, в частности, лег в основу двух моделей фермент-субстратного взаимодействия: так называемой модели «замка и ключа», предложенной Фишером, и общепринятой в настоящее время теории индуцированного соответствия, выдвинутой в середине прошлого века Кошландом. Модель Фишера достаточно наглядно объясняет высокую специфичность ферментов. Согласно этой модели, фермент обладает специфическим участком – «замком», который по своей структуре комплементарен молекуле субстрата – «ключу». Следовательно, с ферментом могут связываться и подвергаться дальнейшим каталитическим превращениям только субстраты, обладающие необходимой пространственной структурой. Если фермент находится в условиях, отличающихся от его обычного окружения, он может подвергаться структурным изменениям, которые обычно сопровождаются потерей его каталитической активности. В теории Фишера активный центр фермента рассматривается как жесткая структура, строго комплементарная структуре субстрата. Согласно теории Кошланда, исходная структура активного центра фермента не соответствует строго субстрату. Однако присутствие субстрата индуцирует структурные изменения активного центра, обеспечивающие связывание субстрата. Одновременно с этим происходит изменение структуры субстрата, благодаря чему достигается его комплементарность измененному активному центру. Предполагается, что активные центры большинства ферментов расположены в области, которая является более гибкой и мобильной, чем остальная часть молекулы белка. Результаты рентгеноструктурных исследований показали, что активные центры обычно располагаются в шарнирных областях, связывающих два структурных домена. В связи с этим активный центр фермента по сравнению со всей молекулой белка более чувствителен к действию денатурирующих агентов и физических факторов. Поэтому фермент может инактивироваться при относительно невысоких концентрациях денатурирующих агентов или при незначительных физических воздействиях, когда глобальные изменения конформации белковой молекулы еще не наблюдаются. Для превращения субстрата в продукт следует затратить энергию, необходимую для ориентации реагирующих групп, образования нестабильных зарядов, перегруппировки связей и т. д. Это иллюстрируется «холмом» на энергетическом профиле реакции. 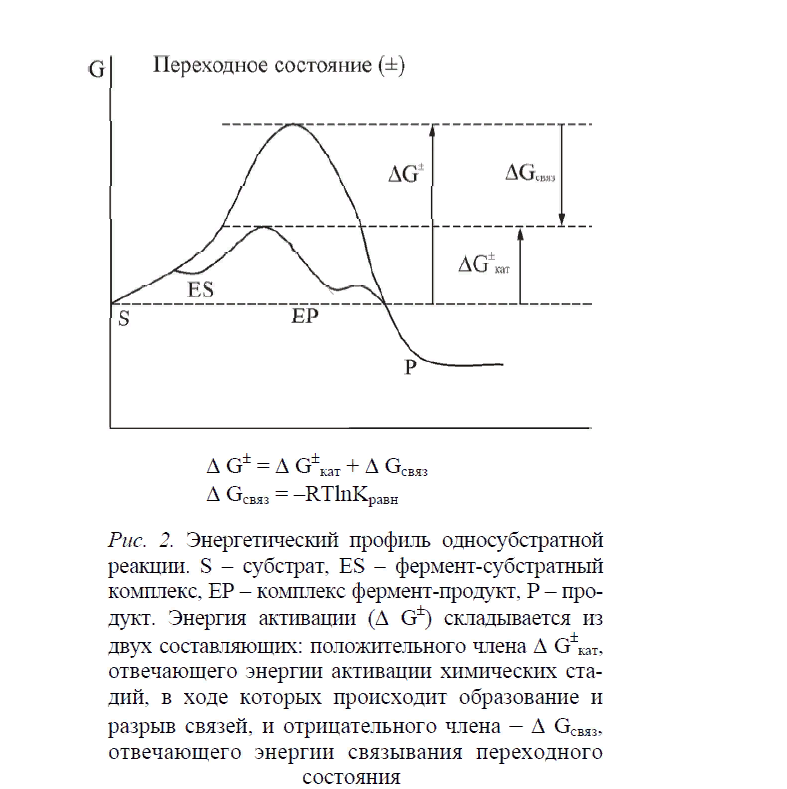 Участники реакции должны преодолеть этот барьер и перейти на более высокий энергетический уровень, то есть оказаться в переходном состоянии. Энергия, необходимая для достижения переходного состояния, называется энергией активации (ΔG±). Переходное состояние – это геометрическая и электронная структура, отражающая комбинированное состояние фермента и субстрата, в котором реализуется оптимальная ориентация реагирующих групп и происходит постоянное образование и разрыв связей. Концентрация переходного состояния и его время жизни крайне малы, в связи с чем переходное состояние трудно зафиксировать. Скорость реакции находится в обратной зависимости от величины энергии активации: чем выше ΔG±, тем ниже скорость. Это понятно, поскольку скорость реакции пропорциональна концентрации активированного комплекса, которая тем выше, чем ниже энергия активации. Мало с чем сравнимая эффективность ферментов как катализаторов объясняется их способностью снижать энергию активации и смещать равновесие в сторону образования переходного состояния. Достигается это благодаря очень прочному связыванию структуры переходного состояния. Энергия связывания переходного состояния (ΔGсвяз = – RTlnKравн) является отрицательной величиной, поэтому ее возрастание будет снижать энергию активации: ΔG± = ΔG±кат + (–RTlnKравн) Таким образом, увеличение энергии связывания лиганда по мере перехода от субстрата к переходному состоянию фактически обеспечивает ферментативный катализ. В настоящее время не существует единой теории, объясняющей необычайно высокую специфичность и каталитическую активность ферментов. Тем не менее можно выделить несколько основных факторов (эффектов), которые в совокупности могут обусловливать каталитический феномен ферментов. 1. Фермент обеспечивает пространственное сближение двух субстратов (эффект сближения) и их строгую взаимную ориентацию в активном центре (эффект ориентации). Субстраты при этом приобретают оптимальное положение для образования переходного состояния. 2. Связывание субстрата в активном центре приводит к удалению гидратной оболочки субстрата (эффект исключения воды), в результате чего создаются, по сравнению с раствором, совершенно другие условия для катализа. 3. Эффект стабилизации переходного состояния вследствие взаимодействия между субстратом и аминокислотными остатками фермента. 4. Фермент индуцирует напряжение (конформационное изменение) в молекуле субстрата, приводящее к ослаблению специфических связей (эффект индуцированного контакта). 5. Определенная ориентация кислотных и основных групп активного центра фермента делает возможным перенос протонов в субстрате (эффект кислотно-основного катализа). 6. Определенные (чаще всего нуклеофильные) группы активного центра могут образовывать ковалентные связи с субстратом, приводя к образованию более реакционноспособных по сравнению с субстратом структур (эффект ковалентного катализа). Для проявления каталитической активности многие ферменты нуждаются в присутствии коферментов и кофакторов. Кофактор – это вещество небелковой природы, которое связывается с неактивным белком – апоферментом с образованием каталитически активного комплекса. Последний называется (холо)голоферментом. Простейшими кофакторами являются ионы металлов (Са2+, Mn2+, Fe2+, Fe3+, Co2+, Zn2+, Mg2+). В качестве кофакторов могут выступать сложные органические молекулы, которые называются коферментами. К ним относятся НАД, НАДФ, FAD, FMN, тиаминпирофосфат, кофермент А. Коферменты могут быть разделены на косубстраты и простетические группы. Простетическая группа прочно связана с белком, и ее химическая модификация и регенерация происходят на одном и том же ферменте. Модификация и регенерация косубстрата осуществляется разными ферментами. Типичными косубстратами являются НАД и НАДФ. К простетическим группам относятся FMN, FAD и тиаминпирофосфат. Для ферментов характерна специфичность действия и субстратная специфичность. Под специфичностью действия понимают способность фермента из многих возможных с данным субстратом реакций ускорять лишь одну. Например, с одной и той же аминокислотой возможны три различные реакции, каждая из которых катализируется отдельным ферментом. Субстратная специфичность может быть абсолютной, относительной (групповая субстратная специфичность) и недостаточной. 3. Классификация биокатализаторов. На основании специфичности действия и субстратной специфичности выделяют шесть классов ферментов. Оксидоредуктазы. К этому классу относятся ферменты, которые катализируют окислительно-восстановительные реакции. Трансферазы. Ферменты этого класса осуществляют межмолекулярный перенос различных атомов, групп атомов и радикалов. Гидролазы. Этому классу принадлежат ферменты, которые катализируют гидролитическое расщепление (при участии молекулы воды) внутримолекулярных связей С–О, С–N, С–С. Лиазы. Лиазы катализируют присоединение определенных групп к двойным связям или же, наоборот, обеспечивают негидролитический разрыв связей С–С, С–О, С–N путем отщепления определенных групп от субстрата с образованием двойной связи. Изомеразы. Эти ферменты катализируют структурные изменения в пределах одной молекулы. Лигазы (синтетазы). К лигазам относятся ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии распада АТФ или другого нуклеозидтрифосфата. |
