дв.фосфат. Суперфосфат смесь Ca H
 Скачать 167.85 Kb. Скачать 167.85 Kb.
|
|
Введение Суперфосфат – смесь Ca(H2PO4)2*H2O и CaSO4. Это наиболее распространённое минеральное фосфорное удобрение. Фосфор в суперфосфате присутствует в основном в виде монокальцийфосфата и свободной фосфорной кислоты. Удобрение содержит гипс и др. примеси (фосфаты железа и алюминия, кремнезём, соединения фтора и др.). Получают суперфосфат из природных фосфатов (апатита и фосфорита) или апатитового концентрата, обрабатывая их серной кислотой, по реакции: Са3(РО4)2 + 2H2SO4 = Сa(H2PO4)2 + 2CaSO4. Для получения двойного суперфосфат апатит или фосфорит обрабатывают фосфорной кислотой. Производят несколько видов суперфосфатов. Простой суперфосфат – серый порошок, почти не слёживаемый, среднерассеваемый; в удобрении 14-19,5% усвояемой растениями P2O5. Его получают действием H2SO4 на природные фосфаты (апатиты, фосфориты). Гранулированный суперфосфат получают из простого (порошковидного), увлажняя его и окатывая в гранулы (диаметр их в основном 2-4 мм) во вращающихся барабанах. Имеет повышенную рассеваемость. Обогащенный суперфосфат получают при разложении фосфатного сырья смесью H2SO4 и Н3РО4; по составу это продукт промежуточный между простым и двойным суперфосфатами и содержит 24-32% усвояемого Р2О5. Двойной суперфосфат производят действием Н3РО4 на природные фосфаты. Он содержит 45-48% усвояемой растениями P2O5, очень мало гипса, выпускается преимущественно гранулированным. В состав аммонизированного суперфосфата, кроме 14-19,5% Р2О5 входит не менее 1,6% аммиака; марганизированного суперфосфата – 1,5-2,5% марганца; борного суперфосфата – 0,1-0,3% бора; молибденового суперфосфата – 0,1% молибдена. Суперфосфат применяют на всех почвах в качестве основного предпосевного, припосевного (лучше гранулированный суперфосфат) удобрения и в подкормки. Особенно эффективен на щелочных и нейтральных почвах. В кислой почве фосфорная кислота удобрения превращается в труднодоступные растениям фосфаты алюминия и железа. В этом случае действие суперфосфата повышается при смешивании его перед внесением с фосфоритной мукой, известняком, мелом, перегноем при применении на известкованных полях. Суперфосфат ускоряет рост и цветение растений, способствует быстрому созреванию плодов и развитию корневой системы. Хранится в закрытых складских помещениях, исключающих попадание осадков и грунтовых вод. 1.1. Назначение, краткая характеристика проектируемого процесса и обоснование выбора схемы проектируемого процесса Простые фосфорные удобрения – это кальциевые соли фосфорной (ортофосфорной) кислоты различного состава. В отличии от калийных и азотных удобрений фосфорные удобрения обладают различной растворимостью, которая зависит от природы соли. По растворимости фосфорные удобрения подразделяются на: водорастворимые (группа I), растворимые в органических кислотах или усвояемые (группа II), нерастворимые или растворимые только в сильных минеральных кислотах (группа III). По содержанию питательного элемента фосфорные удобрения делятся на концентрированные (более 30% P2O5) и неконцентрированные (менее 30% P2O5). В таблице 1.1 приведены характеристики и удельный вес в общем балансе производства основных фосфорных удобрений. Таблица 1.1 - Ассортимент и характеристики фосфорных удобрений
Из табл. 1.1 следует, что ассортимент фосфорных удобрений существенно меняется. Резко снижается производство низкоконцентрированных удобрений (фосфоритная мука, шлаки, простой суперфосфат), после некоторого роста наметилась тенденция снижения производства двойного суперфосфата. Это можно объяснить существенным увеличением объема производства комплексных (многосторонних) удобрений, содержащих фосфор. Сырьем для производства фосфорных удобрений, фосфорной кислоты и элементарного фосфора служат природные фосфатные руды: апатиты и фосфориты. Основным фосфорсодержащим компонентом в них являются двойные соли трикальций-фосфата состава 3Ca3(PO4)2 CaX, где Х = F, OH, Cl. В соответствии с этим различают фторапатиты (Х = F) и гидроксилапатиты (Х = OH). Апатиты представляют собой породы вулканического происхождения, имеют крупнозернистую структуру и, помимо фтор(гидроксил)апатита, содержат нефосфатные минералы, основным из которых является нефелин состава Na2O(K2O) Al2O3 2SiO2. Поэтому для производства фосфорных удобрений используется продукт предварительного обогащения апатитовых руд – апатитовый концентрат, содержащий до 40% P2O5, выход которого составляет около 20% от массы апатитово-нефелиновой руды. Фосфориты – руды осадочного происхождения, высокодисперсны и содержат фосфор в виде фторапатита и апатитоподобных минералов переменного состава. Содержание фосфора в фосфоритах колеблется от 11 до 30% P2O5. Методы переработки фосфатного сырья существенно зависят от состава руды и могут быть механическими и химическими. Механической обработкой (измельчением) получают простейшие фосфорные удобрения – фосфоритную муку и металлургические шлаки. Задачей химической переработки природных фосфатов в фосфорные удобрения является превращение нерастворимого трикальцийфосфата (ТКФ) в такие соединения фосфора, которые легко усваиваются растениями и являются высококонцентрированными, то есть содержат возможно больше P2O5 в усвояемой форме при минимальном количестве балласта и вредных примесей. Химическая переработка природных фосфатов может быть осуществлена тремя методами: химическим разложением, восстановлением углеродом и термической обработкой. Наиболее распространенный метод переработки фосфатного сырья – его разложение серной, фосфорной или азотной кислотами, используемое в промышленных масштабах для производства фосфорных удобрений, фосфорной кислоты, фосфора и комплексных удобрений на основе соединений фосфора (рис.1.1). 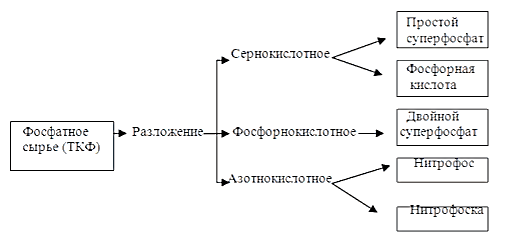 Рисунок 1.1 - Схема кислотной переработки фосфатного сырья В результате кислотной обработки нейтральный ТКФ последовательно превращается в гидрофосфат и дигидрофосфат кальция, что сопроводжается переходом соли из III группы растворимости во II и в I и повышением содержания в ней P2O5 (табл. 1.2) Таблица 1.2 - Свойства фосфатов кальция
Ниже из простых фосфорных удобрений рассматривается производство двойного суперфосфата, который сохранил свое значение, несмотря на интенсивное внедрение в сельское хозяйство комплексных минеральных удобрений. Двойной суперфосфат получают фосфорнокислотным разложением природных фосфатов. Так как для производства фосфорной кислоты используется то же фосфорное сырье, то производство двойного суперфосфата складывается из двух последовательных стадий: производства фосфорной кислоты (стадия I), используемой как реагент во II стадии; фосфорнокислотного разложения фосфатов с получением двойного суперфосфата (стадия II), что представлено на рис. 1.2. Фосфорную кислоту производили ранее исключительно кислотным разложением фосфатов, поэтому производство двойного суперфосфата можно рассматривать как процесс двойного воздействия кислот на фосфат, откуда и получил свое название «двойной». 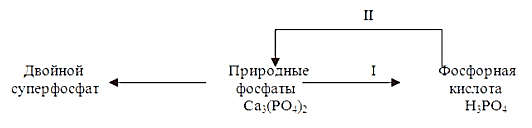 Рисунок 1.2 - Общая схема получения двойного суперфосфата Двойным суперфосфатом называется концентрированное безбалластное простое фосфорное удобрение, получаемое разложением природных фосфатов фосфорной кислотой. Он представляет твердый гигроскопичный продукт серого цвета и выпускается в гранулированном виде. В отличие от простого суперфосфата не содержит балласта – сульфата кальция и поэтому, обладая той же агрохимической активностью, имеет большую концентрацию фосфорсодержащего компонента. Двойной суперфосфат содержит 45 – 51% общего P2O5, в том числе 42 – 49% в усвояемой форме в виде водорастворимых соединений (H3PO4)2; Ca(H2PO4)2; Mg(H2PO4)2; и цитратно-растворимых соединений (CaHPO4;Mg HPO4; фосфаты железа). Физико-химические основы процесса. Разложение природных фосфатов фосфорной кислотой представляет гетерогенный необратимый процесс, протекающий по уравнению Ca5(PO4)3F+7H3PO4+ 5H2O = 5Ca(H2PO4) · H2O + HF–132 кДж. В этом процессе фосфорная кислота является не только реагентом кислотного разложения, но и носителем фосфора, что обеспечивает получение продукта с высоким содержанием усвояемого Р2О5. Процесс взаимодействия фосфорной кислоты с трикальцийфосфатом протекает в две стадии. На первой стадии компоненты реагируют в подвижной суспензии, жидкая фаза которой содержит фосфорную кислоту, монокальцийфосфат и другие растворимые продукты реакции. Эта стадия, идущая сначала с высокой скоростью, замедляется по мере нейтрализации кислоты и заканчивается при насыщении жидкой фазы фосфатами кальция. Продолжительность этой стадии зависит от организации технологического процесса и типа аппаратуры и колеблется от секунд до нескольких часов. На второй стадии происходит кристаллизация монокальцийфосфата (дигидрофосфата кальция), приводящая к изменению состава жидкой и твердой фаз реакционной смеси. Выделение кристаллов, отлагающихся на частицах фосфата, затрудняет доступ к ним ионов H+, процесс разложения фосфата резко замедляется и, когда жидкая фаза насыщается дигидрофосфатом и моногидрофосфатом кальция, процесс прекращается. Скорость растворения фосфатов в растворах фосфорной кислоты, не насыщенных продуктами реакции, лимитируется скоростью диффузии ионов кальция Ca2+ от частиц фосфата в жидкую фазу. Поэтому высокая степень разложения фосфата на первой стадии может быть достигнута лишь при определенной концентрации фосфорной кислоты, равной 30 -40% Р2О5. На второй стадии, которая является определяющей для процесса разложения фосфата в целом, наибольшая скорость разложения достигается в растворах, содержащих около 45% Р2О5. С учетом этих требований выбирается технологический режим производства суперфосфата. Так, например, в бескамерном методе сырье обрабатывается при 50 – 100ºС фосфорной кислотой концентрацией 28 – 40% Р2О5, что отвечает оптимальным условиям первой стадии. Так как при этой концентрации кислоты вторая стадия процесса практически не идет, то процесс завершают при сушке реакционной массы, когда вследствие испарения воды повышается ее активность. 1.2. Характеристика сырья, готовой продукции и вспомогательных материалов Сырье является одним из основных элементов, определяющих в значительной степени технологию производства, себестоимость и качество продукта. Сырьем называют природные материалы и полупродукты, используемые в производстве промышленных продуктов. Потребности развивающейся химической промышленности в разнообразном, доступном и дешевом сырье постоянно заставляют вводить в производство новые виды сырья. Для приготовления ряда химических материалов используют полупродукты или отходы других предприятий. Как исходное сырье, так и готовые продукты должны отвечать определенным требованиям, соответствующим стандарту (ГОСТ, ОСТ). Сырьем для производства элементарного фосфора, фосфорных удобрений и других соединений фосфора служат природные фосфатные руды: апатиты и фосфориты. В этих рудах фосфор находится в нерастворимой форме, главным образом, в виде фторапатита Ca5F(PO4)3 или трикальцийфосфата Ca3(PO4)2. Апатиты представляют собой породы вулканического происхождения, имеют крупнозернистую структуру и помимо фтор(гидроксил)апатита, содержат нефосфатные минералы. Поэтому для производства фосфорных удобрений используют продукт предварительного обогащения апатитовых руд - апатитовый концентрат, содержащий до 40% P2O5, выход которого составляет около 20% от массы апатитово-нефелиновой руды. Апатито-нефелиновую породу разделяют флотацией на апатитовый концентрат, содержащий 39-41% P2O5, и нефелиновую фракцию, содержащую до 30% Al2O3, - сырье для алюминиевой промышленности. Фосфориты - порода осадочного происхождения, содержащая фосфор, главным образом, в виде фторапатита и различные примеси. Содержание P2O5 в обогащенных фосфоритах колеблется в пределах 20-30% P2O5. Самое мощное в мире фосфоритное месторождение Кара-Тау в Казахстане. Часть фосфатного сырья используется непосредственно как удобрение в тонкоразмолотом виде под названием фосфоритная мука. Для получения легкоусвояемых фосфорных удобрений, применяемых на любых почвах, требуется перевести нерастворимые фосфорные соли природных фосфатов в водорастворимые или легкоусвояемые соли. В этом и состоит основная задача технологии фосфорных удобрений. Растворимость фосфорнокислых солей повышается по мере увеличения их кислотности. Средняя соль Ca3(PO4)2 растворима лишь в минеральных кислотах, CaHPO4 растворима в воде. Естественно, что в производстве фосфорных удобрений стремятся получить возможно большую часть фосфора в виде монокальцийфосфата Ca(H2PO4)2. Перевод нерастворимых природных солей в растворимые осуществляется разложением их кислотами, щелочами, нагреванием (термическая возгонка фосфора). Одновременно с получением растворимых солей, естественно, стремятся получить фосфорные удобрения с возможно большей концентрацией фосфора. Двойной суперфосфат – концентрированное водорастворимое удобрение, получаемое разложением молодого природного фосфата фосфорной кислотой. По внешнему виду это гранулированный продукт серого цвета различных оттенков – от светло-серого, почти белого, до темно-серого, – содержащий некоторое количество жидкой фазы. Основным компонентом двойного суперфосфата является моногидрат монокальцийфосфата Са(Н2РО4)2*Н2О. Монокальцийфосфат – самое концентрированное водорастворимое бесхлорное фосфорно-калийное удобрение с общим содержанием питательных элементов 86%. Высокое содержание фосфора и калия обеспечивает его эффективное использование на почвах с низким уровнем плодородия. Состав монокальцийфосфата
Двойной суперфосфат отличается небольшим содержанием других компонентов, образующихся из примесей фосфорной кислоты и природных фосфатов (сульфат кальция, фосфаты железа и алюминия, мономагний-фосфат, кремнефториды, а также непрореагировавший фосфат, дикальцийфосфат, свободная фосфорная кислота и свободная влага). 1.3. Теоретические основы процесса При разложении фосфатов фосфорной кислотой происходят следующие основные реакции: Ca5(PO4)3F + 7Н3РO4 + 5Н2O = 5Са(Н2РО4)2*Н2О + НF CaCO3 + 2H3PO4 = Ca(H2PO4)2*H2O + CO2 (Ca, Mg)CO3 + 4H3PO4 = Са(Н2РО4)2*Н2О + Mg(Н2РО4)2*Н2О 2CO2 Оксиды железа и алюминия образуют средние фосфаты: (Al, Fe)2O3 + 2H3PO4 + H2O = 2(Al, Fe)PO4*2H2O Средние фосфаты алюминия и железа обладают отрицательным температурным коэффициентом растворимости: с повышением температуры ускоряется их кристаллизация. Аморфный АlРО4*2H2О медленно превращается в комплексные соли СаАlН(Р04)2*6Н2O, СаАl6H4(PO4)8*2H2O и СаАl6Н4(РО4)8*2Н2О. Аморфный фосфат FеРO4*H2O образуется только при избытке Fе2О3 в жидкой фазе. Чаще всего при достижении рН 2 реакция идет с образованием СаFе2Н4(РО4)4*5Н2O. Выделяющийся НF взаимодействует с диоксидом кремния с образованием Н2SiF6 и SiF4: 4HF + SiO2 = SiF4 + 2H2O SiF4 + 2HF = H2SiF6 Кремнефтористоводородная кислота превращается в кремнефториды кальция, натрия и калия, а тетрафторид кремния частично выделяется в газообразном состоянии. Причем степень его выделения возрастает с повышением температуры и концентрации P2О5 в жидкой фазе. Протекание основных реакций сопровождается возрастанием температуры, а следовательно, и парциального давления паров SiF4. В процессе сушки при температуре более 70°С кремнефторид кальция разлагается по реакции: СаSiF6(тв) + 2Н+(ж) → Н2SiF6(ж) + Са2+(ж) → SiF4(газ) + СаF2(тв) + 2Н+(ж) Ион алюминия, попадающий в раствор в результате разложения побочных минералов фосфатных руд (нефелина, глауконита и глин), взаимодействует с ионами F- и SiF62- с образованием более прочных комплексов [АlF]2+, чем аналогичные соединения кремния. Образование их задерживает выделение фтористых соединений в газовую фазу. Норма фосфорной кислоты Стехиометрическую норму НзРО4 (n) на 100 массовых частей фосфорита подсчитывают по формуле: 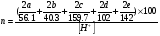 где  , , 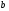 , ,  , , 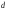 и и  – содержание в фосфате соответственно СаО, МgО, Fе2О3, Аl2О3 и Р2О5, %; – содержание в фосфате соответственно СаО, МgО, Fе2О3, Аl2О3 и Р2О5, %;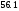 ; ; 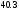 ; ; 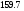 ; ; 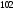 ; ; 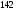 – масса 1 моль соответствующих компонентов; – масса 1 моль соответствующих компонентов;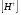 – концентрация ионов водорода в фосфорной кислоте. – концентрация ионов водорода в фосфорной кислоте.При разложении апатитового концентрата норму фосфорной кислоты подсчитывают по формуле: 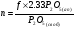 где 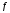 – принимаемая доля от стехиометрической нормы; – принимаемая доля от стехиометрической нормы;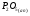 – содержание Р2О5 в апатитовом концентрате, %; – содержание Р2О5 в апатитовом концентрате, %;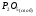 – содержание в фосфорной кислоте свободной Р2О5, %; – содержание в фосфорной кислоте свободной Р2О5, %;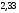 – потребность Р2О5 кислоты, масс. ч. на 1 масс. ч. Р5О5 в апатите. – потребность Р2О5 кислоты, масс. ч. на 1 масс. ч. Р5О5 в апатите.Добавление к фосфорной кислоте таких сильных кислот, как азотная, соляная, кремнефтористоводородная и серная, либо их смесей ускоряет фосфорнокислотное разложение фосфатов. При разложении фосфата смесью кислот следует определить суммарную норму кислот в пересчете на 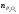 или или 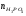 . Разница между суммарной нормой, не превышающей стехиометрическую (в пересчете на фосфорную кислоту), и нормой фосфорной кислоты составляет долю серной кислоты, выраженную в . Разница между суммарной нормой, не превышающей стехиометрическую (в пересчете на фосфорную кислоту), и нормой фосфорной кислоты составляет долю серной кислоты, выраженную в 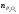 или или 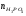 . Для пересчета на норму серной кислоты необходимо учитывать, что на разложение 1 моль апатита расходуется 7 моль фосфорной кислоты, а серной кислоты в два раза меньше: . Для пересчета на норму серной кислоты необходимо учитывать, что на разложение 1 моль апатита расходуется 7 моль фосфорной кислоты, а серной кислоты в два раза меньше:2Са5(РО4)3F +7Н2SО4+6,5Н2О=3Ca(H2PO4)2*H2O+7CaSO4*0,5H2O+HF При очень большом избытке фосфорной кислоты (400-500%) можно практически нацело разложить фторапатит. Обычно берут 105-110% кислоты от стехиометрического ее количества. Увеличение нормы фосфорной кислоты сверх оптимальной незначительно повышает степень разложения фосфата, но значительно ухудшает физические свойства двойного суперфосфата и увеличивает содержание в нем свободной кислотности. Условия равновесия и кристаллизация твердых фаз Знание этих условий весьма важно для правильного выбора технологического режима. Процесс разложения фосфатов фосфорной кислотой состоит из двух стадий – растворения фосфата в растворах фосфорной кислоты, вначале ненасыщенных, а затем насыщенных фосфатами кальция. Эти стадии различаются по своим равновесным, а также кинетическим условиям. Наибольшее разложение апатита в равновесных условиях достигается при более низких температурах и концентрациях фосфорной кислоты. Степень разложения фосфата в момент насыщения жидкой фазы составляет 5-7%. Дальнейшее разложение фосфата во II стадии происходит при взаимодействии его с насыщенным раствором и сопровождается выделением твердой фазы. Данные о равновесии в системе могут быть использованы для выбора условий кристаллизации твердой фазы того или иного состава. При образовании в I стадии насыщенных эвтонических растворов, дальнейшее разложение сопряжено с выделением в твердую фазу вначале смеси моно- и дикальцийфосфата, а к концу процесса – одного дикальцийфосфата. Кинетика разложения фосфатов В производстве двойного суперфосфата растворение природного фосфата в Н3РО4 (5-10 мин) сопровождается образованием частично нейтрализованного раствора фосфорной кислоты (I стадия), а затем, после его насыщения, в течение длительного времени – образованием также твердой фазы (II стадия). Оптимальный режим разложения фосфата может быть установлен с учетом равновесных и кинетических условий на каждой стадии процесса. Разложение фосфата фосфорной кислотой Скорость разложения фосфата фосфорной кислотой (без кристаллизации твердой фазы) с образованием гомогенного раствора определяется законами диффузионных процессов. По мере нейтрализации свободной кислоты и ионов кальция вплоть до образования насыщенного раствора скорость процесса уменьшается. При значительном избытке кислоты по отношению к реагирующему фосфату и абсолютно малой степени нейтрализации кислоты скорость разложения фосфата достаточно велика даже при использовании кислоты относительно небольшой концентрации. Наибольшая скорость растворения апатита достигается при следующих концентрациях растворов, равновесных с Са(Н2РО4)2*Н2О:
По мере приближения состава жидкой фазы к составу насыщенного раствора существенное значение приобретает концентрация водородных ионов среды. Скорость разложения фосфорита в насыщенных СаНРО4 растворах очень мала вследствие низкой активности водородных ионов в этих условиях. В растворах, насыщенных Са(Н2РО4)2, активность ионов Н+ резко возрастает, повышается и скорость разложения. С повышением температуры увеличивается скорость взаимодействия водородных ионов с апатитом. Одновременно снижается концентрация ионов водорода в растворе. Суммарное действие двух противоположных эффектов, вызываемых повышением температуры, приводит к практической независимости скорости разложения апатита в тройной системе СаО – Р2О5 – Н2О от температуры. Разложение фосфатов с кристаллизацией продукта реакции представляет собой II стадию процесса, протекающую после насыщения жидкой фазы системы растворимыми фосфатами кальция. С увеличением концентрации и понижением температуры раствора степень разложения апатита к моменту завершения I стадии уменьшается. Соответственно увеличивается минимальное количество фосфорной кислоты, необходимое для полного его разложения без кристаллизации продукта реакции. Разложение фосфатов с образованием загустевающей пульпы При уменьшении нормы кислоты до стехиометрической и увеличении концентрации до 50% разложение фосфата в I стадии завершается в течение 5-10 мин. Далее происходит кристаллизация новой твердой фазы. По мере израсходования кислоты количество жидкой фазы уменьшается, а количество твердой увеличивается. При этом пульпа постепенно густеет, и наконец полностью схватывается. Кристаллизация твердой фазы и схватывание пульпы происходят тем быстрее, чем выше концентрация исходной фосфорной кислоты. Суммарное влияние условий протекания процесса в I стадии и в период образования корки на зернах непрореагировавшего фосфата определяет скорость разложения в загустевающей пульпе. Изменение степени разложения фосфата во времени в загустевающей пульпе определяется совместным влиянием активности ионов водорода раствора и свойств кристаллизующейся твердой фазы. С увеличением концентрации кислоты от 13,6 до 53,6% разложение апатитового концентрата стехиометрической нормой фосфорной кислоты при 20°С ускоряется. Дальнейшее повышение концентрации кислоты приводит к замедлению этого процесса. Причем в течение первых 10-20 мин степень разложения мало зависит от нормы кислоты. Увеличение нормы кислоты позволяет несколько увеличить скорость процесса в течение более длительного промежутка времени, однако рост степени разложения фосфата непропорционален повышению нормы кислоты вследствие неполного ее использования. С увеличением нормы кислоты возрастает содержание свободной кислотности в суперфосфате, что потребует в дальнейшем ее нейтрализации для улучшения качества готового продукта. При низкой норме расхода кислоты качество двойного суперфосфата ухудшается из-за низкой степени разложения фосфата. Увеличение нормы кислоты сверх 110% стехиометрической не дает заметного улучшения качества продукта, но может привести к тому, что суперфосфат в камере не будет схватываться и вытечет из нее. Степень разложения фосфата значительно возрастает с повышением температуры от 20 до 40°С. Дальнейшее повышение температуры до 70-80°С приводит к незначительному увеличению степени разложения. Это объясняется тем, что при температурах выше 40°С уже через очень короткий промежуток времени от начала реакции выделяется значительное количество кристаллов монокальцийфосфата, создающих сопротивление диффузии кислоты, в результате чего скорость процесса при температурах выше 40°С определяется диффузионным сопротивлением твердой корки продукта реакции, которое мало или совсем не зависит от температуры. При температуре ниже 40°С степень разложения апатита заметно снижается, поэтому работа на холодной кислоте приводит к нарушениям технологического режима. Выделение фтористых соединений в производстве двойного суперфосфата При кислотной переработке природных фосфатов в газовую фазу выделяются НF и SiF4. В зависимости от способа производства, вида применяемых фосфатов и качества фосфорной кислоты доля фтористых соединений, выделяющихся в газовую фазу, колеблется от 10 до 55% массы фтора, поступающего с сырьем. Это значит, что на каждую тонну двойного суперфосфата можно получить от 5 до 20 кг кремнефтористоводородной кислоты с различным содержанием примесей. Фтористый водород, образующийся при разложении фторапатита, реагирует с кремниевым ангидридом и силикатами: 6НF + Н2SiОЗ = Н2SiF6 + 3H2O Аналогично взаимодействуют с НF цеолиты, содержащиеся в фосфоритах, а также аморфные кремниевые кислоты. По мере протекания основных реакций увеличивается температура пульпы, а следовательно, и парциальное давление паров SiF4, образующегося по реакции: 2Н2SiF6 + Н2SiО3 ↔ 3SiF4 + 3Н2О Ионы F- и [SiF6]2- взаимодействуют с ионом алюминия, образуя прочные комплексные фториды: [SiF6]2- + Аl3+ +3Н2О = [AlF6]3- + Н2SiО3 + 4Н+ Возможно образование и других катионных комплексов: [AlF2]+ и [AlF]2+, а также трехфтористого алюминия АlFз. Ионы железа также образуют комплексные соединения с нонами фтора: [FeF4]- и [FeF6]3-. При определенных условиях протекают следующие обратимые реакции: Н2SiF6 + Ca(Н2PО4)2 ↔ CaSiF6 + 2Н3PО4 Н2SiF6 + 2NaН2PО4 ↔ Na2SiF6 + 2Н3PО4 Н2SiF6 + 2KН2PО4 ↔ K2SiF6 + 2Н3PО4 Н2SiF6 + 3Ca(Н2PО4)2 + 3H2O ↔ 3CaF2 + H2SiO3 + 6Н3PО4 При высоких концентрациях свободной Н3РО4 и при температурах 100-110°C равновесия этих реакций смещены влево. При низких концентрациях свободной Н3РО4 и низких температурах равновесия реакции смещаются вправо за счет кристаллизации солей. Количество фтористых соединений, выделяющихся в газовую фазу, можно оценить по равновесному давлению паров НF и SiF4 над системой Н3РО4 – Н2SiF6 – Н2О. Условия, способствующие повышению парциального давления SiF4 и НF над растворами при равновесии, должны благоприятствовать увеличению выхода фтора в газовую фазу в условиях производства. Наличие примесей в значительной степени искажает процесс выделения фтористых соединений в газовую фазу. Связывание фтора в прочные комплексы с ионами алюминия и железа, образование соединений типа фторидов алюминия, магния, кальция, а также солей кремнефтористоводородной кислоты (СаSiF6, Na2SiF6, K2SiF6, MgSiF6 и др.) способствует уменьшению выделения фтористых соединений в газовую фазу. Поэтому степень выделения фтора в газовую фазу в производственных условиях не превышает 50-55% (в пересчете на фтор, введенный с фосфатным сырьем и фосфорной кислотой). 1.4. Проектирование и подробное описание технологической схемы процесса Производство двойного суперфосфата осуществляется двумя способами:
Полунепрерывный способ сводится к камерному вызреванию, складской дообработке и последующему гранулированию порошковидного продукта. Непрерывные способы отличаются отсутствием стадии складской дообработки. К ним относятся камерно-поточный, бескамерные (с применением барабанных и распылительных сушилок) и малоретурный (с применением аппарата БГС) способы. В настоящее время используются полунепрерывный и непрерывный малоретурный способы. В производстве двойного суперфосфата используются три метода, различающиеся аппаратурным оформлением, концентрацией использованной фосфорной кислоты и температурным режимом процесса. Камерный метод с использованием суперфосфатных камер непрерывного действия и выдерживанием продукта для созревания на складе. Для разложения фосфатов используют термическую или экстракционную кислоту концентрацией 50 – 58% P2O5 при избытке 110% от стехиометрического количества. Степень разложения фосфата 0,75 – 0,80 д.ед. Камерно-поточный метод с использованием аналогичных камер, но без операции складского созревания. Для разложения фосфатов используется экстракционная кислота концентрацией 47 – 49%, взятая в стехиометрическом отношении. Степень разложения не выше 0,7 дол.ед. Поточный (бескамерный) метод с использованием неупаренной кислоты концентрацией 30% P2O5 при степени разложения фосфата до 0,55 дол.ед. В отличие от предыдущих методов здесь разложение сырья осуществляют в две ступени. Первую стадию процесса проводят в реакторах до степени разложения 0,5 дол. ед. Дальнейшее разложение протекает при высокой температуре в сушилках различного типа: распылительных (РС), барабанных грануляторах-сушилках (БГС), распылительных сушилках-грануляторах кипящего слоя (РКСГ). Наиболее распространены схемы с использованием аппаратов БГС, конструкция которых непрерывно совершенствуется. Технологическая схема производства двойного суперфосфата поточным методом с аппаратом БГС производительностью 180 тыс. тонн в год. Измельченный фосфат из бункера 1 и фосфорная кислота из сборника 2 подают в реактор I ступени 3. Из него реакционная пульпа перетекает в реактор II ступени 4. В оба реактора подают острый пар, обеспечивающий температуру реакционной массы 90 – 100ºС. Из реактора II ступени пульпа поступает в аппарат БГС 5, где происходят завершающая стадия разложения фосфорита, сушка и грануляция пульпы. В аппарат БГС подается также ретур – тонко измельченный двойной суперфосфат после отделения товарного продукта. Отношение масс ретура и готового суперфосфата равно 3:1. Пульпа, поступающая в аппарат БГС, разбрызгивается форсунками и наслаивается на частицы ретура, образуя гранулы, которые высушиваются при 700ºС топочными газами, поступающими в аппарат из топки 1. Сухой продукт направляется на грохоты 7 и 8, где его разделяют на три фракции. Крупную фракцию после измельчения в дробилке 9 смешивают с мелкой фракцией, прошедшей через грохот 8, и пылью из циклонов 12 и 13 и в виде ретура возвращают в аппарат БГС. Товарную фракцию суперфосфата, прошедшую через грохот 7, с размерами гранул 1 – 4 мм направляют в барабан-аммонизатор 10, где остаточная фосфорная кислота нейтрализуется аммиаком. Из аммонизатора она попадает в холодильник кипящего слоя 11 и затем на склад. Выделяющиеся из аппарата БГС фторсодержащие газы очищаются от пыли в циклоне 12 и направляются на абсорбцию водой, после чего выбрасываются в атмосферу. Основным аппаратом в поточной схеме является барабанная гранулятор-сушилка, представляющая барабан диаметром 4,5 м и длинной до 35 м, установленный под углом 3º и вращающийся с частотой 4 об/м. Барабан содержит внутри лопастную насадку переменной конфигурации, с помощью которой при вращении барабана создается завеса частиц суперфосфата, ссыпающегося с полок. Теплоноситель (топочные газы) и поток суспензии суперфосфата подаются по оси аппарата, что уменьшает нагрев его стенок и позволяет применять топочные газы, нагретые до 950ºС. Производительность аппарата БГС составляет 40 т/час. Расходные коэффициенты на 1 т усвояемого Р2O5 составляют: фосфорит 0,28 – 0,29 т; экстракционная фосфорная кислота 0,80 – 0,83 т. Себестоимость продукта в поточном и камерном методах практически одинакова. При этом себестоимость Р2O5 в них на 20% выше, чем в производстве простого суперфосфата. Однако, это компенсируется экономией при транспортировке, хранении и внесении в почву более концентрированного удобрения, каким является двойной суперфосфат. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
