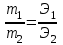химия первый курс. Коллоквиум по химии – первый модуль. Суть теории растворов растворитель химическая индифферентная среда( не вступающая ни в какие реакции), в которой равномерно распределены частицы растворенного вещества.
 Скачать 0.62 Mb. Скачать 0.62 Mb.
|
|
Коллоквиум по химии – первый модуль Сторонники физической модели процесса растворения: С.А. Аррениус, Я.Х. Вант-Гофф, В.Ф. Оствальд. Суть физической теории и ее применение. Была открыта Якобом Г. Вант-Гоффом и Свате А.Аррениусом. Суть теории растворов: растворитель – химическая индифферентная среда( не вступающая ни в какие реакции), в которой равномерно распределены частицы растворенного вещества. Теория не предполагает наличие межмолекулярных связей между растворителем и растворенным веществом. Под эту теорию подходят только идеальные растворы, где компоненты растворителя никак не воздействуют на растворимое соединение. Примером являются газовые растворы, где нереагирующие между собой газы смешиваются друг с другом в неограниченных количествах. Все физические данные (температура кипения и плавления, давление, теплоемкость) вычисляется исходя из свойств всех соединений, входящих в состав. По закону Дальтона: общее давление газовой смеси равно сумме парциальных давлений ее компонентов: Pобщ = Р1 + Р2 + Р3 +… Сторонники химической модели процесса растворения: Д.И. Менделеев, Каблуков И.А., Н.С. Курнаков и др. Суть химической теории. Образование сольватов (гидратов). Химическую (сольватную) теорию растворов описал Д.И. Менделеев. Суть заключается в следующем: частицы растворителя и растворенного вещества реагируют друг с другом, в результате чего получаются нестойкие соединения переменного состава – гидраты (сольваты). Основные связи тут – водородные. Вещество может распадаться на слои (растворяться) в случае полярного растворителя (воды). Ярким примером является растворение поваренной соли. Также может протекать реакция между компонентами смеси: H2O +Cl2 = HCl + HOCl, В ходе процесса растворения происходит изменение состава и объема реакционной смеси, т.к. протекают 2 процесса: разрушение структуры растворяемого вещества и химическая реакция между частицами. Оба процесса идут с изменением энергии. Тепловые эффекты могут быть экзотермическими и эндотермическими (с выделением и поглощением энергии). Соединения с частицами растворителя называются гидратами. Кристаллические вещества, в состав которых входят гидраты, называются кристаллогидратами и имеют различную окраску. Например, кристаллогидрат сульфата меди: CuSO4 ·5H2О. Раствор кристаллогидрата синий. Если рассмотреть кристаллогидрат кобальта CoCl2· 6H2O, то он обладает розовым цветом, CoCl2· 4H2O – красный, CoCl2 ·2H2O - сине-фиолетовый, CoCl2 ·H2О – темно-синий, а безводный раствор хлорида кобальта – бледно-синего цвета Понятия: раствор, растворитель, растворенное вещество. Раствор- это гомогенная термодинамическая устойчивая система , состоящая из двух или более компонентов , состав , которого может изменятся в пределах , допустимых растворимостью Растворитель – это вещество агрегатное состояние которого не изменяется при образовании раствора . При одинаковом агрегатном состоянии компонентов растворитель – вещество , которое в большем количестве. Растворённое вещество - компонент, взятый в недостатке и равномерно распределенный в виде молекул, ионов в растворителе Классификация растворов: по природе растворителя, по размерам частиц и степени однородности растворенного вещества, по агрегатному состоянию, по возможности к электролитической диссоциации (по поведению вещества в растворе), по концентрации (относительному количеству компонентов), по растворимости (насыщенные, ненасыщенные и пересыщенные). по природе растворителя- -водные; -неводные: растворы в органических растворителях (спирты, эфиры, ацетон, бензол). по размерам частиц и степени однородности растворенного вещества – коллоидные растворы и истинные ;частицы растворенного вещества не видимы ни визуально, ни под микроскопом, свободно передвигаются в среде растворителя. Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени.; гомогенные системы – нет границы раздела фаз; в коллоидных растворах частицы по размеру крупные( глюкоза р-р, NaCl р-р) , гетерогенные системы – есть нраница раздела фаз ( мел+ вода; песок+ вода ; дым; туман) по агрегатному состоянию- по агрегатному состоянию ·газообразные (воздух) ·жидкие (физраствор) ·твердые (сплавы) по возможности к электролитической диссоциации (по поведению вещества в растворе) - ·растворы электролитов (растворы низкомолекулярных электролитов и растворы высокомолекулярных электролитов - полиэлектролитов) ·растворы неэлектролитов (не проводят электрический ток)(сахар) ·растворы амфолитов( это такие электролиты, которые могут проявлять одновременно и кислотные, и основные свойства.) ( раствор Zn(OH)2) по концентрации (относительному количеству компонентов)- концентрированный ( легкорастворимый ; 0,1 М KBr ) , разбавленный ( малорастворимый; CaSO4 , нерастворимый ; AgCl) по растворимости (насыщенные, ненасыщенные и пересыщенные)- Насыщенный раствор, раствор, находящийся при данных условиях (температура, давление) в устойчивом равновесии с растворённым веществом. ; Ненасыщенным называют такой раствор, в котором при данной температуре находится меньше растворяемого вещества, чем в его насыщенном растворе.; Пересыщенным называют такой раствор, в котором при данной температуре находится в растворённом состоянии больше вещества, чем в его насыщенном растворе при тех же условиях. Растворимость - понятие, факторы, влияющие на растворимость: природа растворенного вещества и растворителя, температура, давление. Растворимость – это содержание максимальной массы растворённого вещества в 100 г растворителя при данной температуре. Природа растворяемого вещества и растворителя.Существует классическое правило «подобное растворяется в подобном». Полярные вещества (ионные соединения и соединения с полярной ковалентной связью) лучше растворяются в полярном растворителе. Для растворения неполярных веществ необходимо применять неполярные соединения. Температура. Давление.О влиянии температуры на растворимость можно говорить только в общих чертах, так как этот процесс неоднозначный. Как правило, повышение температуры увеличивает растворимость тех веществ, процесс растворимости которых эндотермичный, т. е. идет с поглощением теплоты (ДНраств > 0). С изменением температуры растворимость тв. веществ , жидких – увеличивается ( искл- NaCl – const ) Для газов – растворение экзотермическая реакция При понижении температуры растворимость газов увеличивается На растворимость газов сильно влияет давление. Зависимость растворимости газов от давления выражается законами Дж. Генри и Дж. Дальтона:«Масса газа, растворяющегося в данном объеме жидкости, пропорциональна давлению, которое газ производит на жидкость». Зависимость растворимости твердых веществ и газов в жидкостях от температуры. С изменением температуры растворимость тв. веществ , жидких – увеличивается ( искл- NaCl – const ) Для газов – растворение экзотермическая реакция При понижении температуры растворимость газов увеличивается Для твёрдых и жидких веществ влияние давления на растворимость менее значимо, чем для газов. Растворимость жидких веществ в жидкостях. Привести примеры неограниченной и ограниченной растворимости. Рассмотреть примеры полной нерастворимости. При смешивании двух жидкостей можно наблюдать самую различную их взаимную растворимость: от практически полной нерастворимости друг в друге (ртуть - вода) до неограниченной смешиваемости (ацетон - вода). Неограниченно растворяются в воде все жидкие неорганические кислоты (HNO3, HClO4, HCN, HNCS, и др.), простейшие органические кислоты (НСООН, СН3СООН и др.), простейшие спирты и кетоны (СН3ОН, С2Н5OН, СН3СОСН3 и др.). Если жидкости растворяются друг в друге ограниченно, то происходит их расслаивание с образованием двух жидких фаз, причем фаза с большей плотностью будет находиться внизу Соприкасающиеся слои жидкостей находятся в фазовом равновесии, и каждый слой представляет собой насыщенный раствор одной жидкости в другой при данной температуре. Ну во-первых, AgCl растворим в воде. Во-вторых, степень ковалентности связи Ag-Cl куда больше, чем у связи K-Cl. В частности, это проявляется в образовании комплексного аниона [AgCl2]-, из-за чего хлорид серебра довольно-таки растворим в солянке. Из-за большей ковалентности связи прочность решётки возрастает, отсюда и разница с KCl в растворимости в воде. Почему именно ковалентность выше -- сходу не скажешь, потому что и у серебра 5sp уровень лежит близко к 4d и они сильно перекрываются, отчего там есть вакантные состояния в валентной полосе, и у хлора 3d уровень вакантен (в основном состоянии) и вполне может перекрываться с какими-то заполненными состояниями серебра. Надо считать... Зависимость растворимости газов в жидкостях от давления. Законы Генри-Дальтона-Сеченова, формулировки и математические формулы. Медико-биологическое значение этих законов. Газы не растворяются в жидкости беспредельно. При некоторой концентрации газа Х устанавливается равновесие: X(г)=Х(ж) При растворении газа в жидкости происходит значительное уменьшение объема системы. Поэтому изменение давления приводит к смещению равновесия и изменяет растворимость газа. Зависимость растворимости газа от давления выражается законом Генри (для индивидуального газа) или законом Дальтона (для смеси газов). Закон Генри: количество газа, растворенного при данной температуре в определенном объеме жидкости, при равновесии прямо пропорционально давлению газа. Где -концентрация газа в насышенном растворе, моль/л; P(x)-давление газа над раствором - постоянная Генри для газа , моль/л∙Па. Закон Дальтона: растворимость каждого из компонентов газовой смеси при постоянной температуре пропорциональна парциальному давлению компонента над жидкостью и не зависит от общего давления смеси и индивидуальности других компонентов Где - парциальное давление компонента р-общее давление газовой смеси - мольная доля компонента Закон Генри является частным случаем закона Дальтона. Законы Генри и Дальтона имеют большое практическое значение для медицины. Изменение растворимости газов в крови при изменении давления могут вызывать тяжелые заболевания. Примером может служить «кессонная болезнь» водолазов. Чем больше глубина погружения, тем больше давление и, соответственно, больше растворимость азота в плазме крови. Если поднимать водолаза на поверхность слишком быстро, то давление в легких резко понижается и, следовательно, значительно понижается растворимость газов в плазме крови. Вследствие этого часть газов выделяется из крови в виде пузырьков, которые закупоривают мелкие сосуды в различных органах и тканях. Этот процесс (эмболия) может привести к тяжелому поражению тканей и даже к гибели человека. На законах Генри и Дальтона основано лечение ряда заболеваний, при которых в омертвевших тканях накапливаются микробы. В этом случае больных помещают в барокамеры с повышенным давлением кислорода в воздухе. При этом улучшается снабжение тканей кислородом, что во многих случаях дает хорошие результаты при лечении. Закон Сеченова: растворимость газов в жидкости в присутствии электролитов понижается вследствие высаливания газов. Понижение растворимости газов в растворе электролита связано с процессом сольватации (гидратации) ионов молекулами растворителя. В результате этого процесса уменьшается число свободных молекул растворителя, а, следовательно, понижается его растворяющая способность. Для биологических систем важным является то, чтоуменьшению растворимости газов в воде способствуют белки, липиды и другие вещества, содержащиеся в крови. Изменение содержания указанных веществ оказывают существенное влияние на растворимость кислорода и диоксида углерода в крови. Способы выражения состава растворов: массовая доля, молярная концентрация, молярная концентрация эквивалента (нормальная концентрация), моляльная концентрация, титр, мольная доля. Привести математические формулы, дать определение и рассмотреть физический смысл каждого наименования. Способы выражения состава растворов
Закон эквивалентов. Следствие из закона эквивалентов. Расчетные формулы, определение, физический смысл. Эквивалентом вещества называют реальную или условную частицу вещества, которая в данной кислотно-основной реакции эквивалентна одному иону водорода, или в данной окислительно-восстановительной реакции – одному электрону. Фактором эквивалентности (f) называют число, показывающее, какая часть реальной частицы вещества эквивалентна одному иону водорода в кислотно-основной реакции, или одному электрону в окислительно-восстановительной реакции. Фактор эквивалентности выражается величиной Молярной массой эквивалента (эквивалентной массой) вещества (Э) называют величину, равную произведению фактора эквивалентности на молярную массу вещества 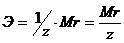 . .Закон эквивалентов: Все вещества реагируют и образуются в эквивалентных соотношениях. Закон и следсвие из него смотри в таблице ( 9-10 пункты) 9 вопрос !!!! Приготовление разбавленных растворов кислот из более концентрированных и их количественное определение (титриметрия) алкалиметрическим методом. Рассмотреть приготовление растворов на примере НСl, а титрование - с применением в качестве титранта NaOH. Приготовление разбавленных растворов кислот из более концентрированных и их количественное определение (титриметрия) алкалиметрическим методом. Рассмотреть приготовление растворов на примере НСl, а титрование с применением в качестве титранта NaOH/ растворы готовятся в мерных колбах в соответствии с задачей. при приготовлении растворов берется определенное количество кислоты hcl, и мерная колба нужного обьема. для приготовления раствора необходимо добавить необходимый оьем кислоты в мерную колбу, эти обьемы указаны в задаче, после этого в три этапа нужно добавить воду, первый этап- добавление 1/3 от обьема колбы и перемешивание , второй- добавление воды почти до мерной линии, третий этап- наполнение с помощью глазной пипетки до линии мерной, стоит держать мерную колбу на уровне глаз, для точного и правильного создания расствора. после создания раствора, который и будет использоваться в титриметрии,после чего приготовить бюретку, наполнить ее до отметки 0. начать титриметрию. для этого в коническую колбу необходимо добавить определенный обьем раствора кислоты, к этому расствору добавить индикатор- фенолфталеин. покапельно добавлять щелочь в коническую колбу. прекратить титрирование после добавления капли которая запустила процесс окрашивания расствора, исходя из следствия закона эквивалентов, мы можем получить нормальность расствора кислоты, а из нормальности раствора уже точно также, по следствию закона эквивалентов получить и нормальность изначального расствора. Коллигативные свойства растворов. Дать понятие и привести примеры. Коллигативные свойства растворов. Дать понятие и привести примеры. Коллигативные свойства растворов -это такие свойства, на которые не оказывает влияние природа растворенного вещества, а зависят они исключительно от количества частиц этого растворенного вещества. Примеры: • 1) понижение давления насыщенного пара над раствором по сравнению с растворителем; • 2) повышение температуры кипения и понижение температуры замерзания (кристаллизации) растворов по сравнению с растворителем; • 3) осмотические явления Первый закон Рауля, две трактовки закона. Рассмотреть давление насыщенного пара над раствором в зависимости от мольной доли растворителя и мольной доли растворенного вещества. Привести математические формулы. Первый закон Рауля, две трактовки закона. Рассмотреть давление насыщенного пара над раствором в зависимости от мольной доли растворителя и мольной доли растворенного вещества. Привести математические формулы. Первый закон Рауля Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе: • p = p0 · χр-ль= p0 · n2 / n2 + n1 • p — давление пара над раствором, Па; • p0 — давление пара над чистым растворителем, Па; • χр-ль — мольная доля растворителя • n1 – количество растворенного вещества (моль); n2 – количество растворителя (моль). Закон Рауля (иная трактовка) • Относительное понижение давления пара растворителя над раствором нелетучего неэлектролита равно мольной доле растворенного вещества: • где Р – давление насыщенного пара растворителя над раствором • (атм; Па; мм. рт. ст.); • Р0 – давление насыщенного пара над чистым растворителем • (атм; Па; мм. рт. ст.); • n1 – количество растворенного вещества (моль); • n2 – количество растворителя (моль). Понятие - насыщенный пар. Зависимость давления насыщенного пара от температуры. Насыщенный пар- пар, находящийся в динамическом равновесии со своей жидкостью, т.е кол-во молекул, покидающих жидкость за некоторый промежуток времени, равно кол-ву молекул пара, возвращающихся обратно в жидкость. Приувеличении температуры, молекулы жидкости будут иметь большую кинетическую энергию и все большее кол-во молекул сможет вырваться из жидкости, следовательно, будет расти концентрация пара и его давление. Второй закон Рауля. Рассмотреть зависимость температуры кипения и замерзания растворов от моляльной концентрации раствора. Физический смысл эбулиоскопической (Е, Кэб) и криоскопической констант (К, Ккр). Зависимость их значений от природы растворителя. - Тот факт, что давление паров над раствором отличается от давления паров над чистым растворителем, существенно влияет на процессы кристаллизации и кипения. Из первого закона Рауля выводятся два следствия, касающиеся понижения температуры замерзания и повышения температуры кипения растворов, которые в объединённом виде известны как второй закон Рауля. Понижение температуры кристаллизации растворов Условием кристаллизации является равенство давления насыщенного пара растворителя над раствором давлению пара над твёрдым растворителем. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, это равенство всегда будет достигаться при температуре более низкой, чем температура замерзания растворителя. Так, океанская вода начинает замерзать при температуре около −2 °C. Разность между температурой кристаллизации растворителя T°fr и температурой начала кристаллизации раствора Tfr есть понижение температуры кристаллизации. Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора. Поскольку по мере кристаллизации растворителя из раствора концентрация последнего возрастает, растворы не имеют определённой температуры замерзания и кристаллизуются в некотором интервале температур. Повышение температуры кипения растворов Жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если растворённое вещество нелетуче (то есть давлением его насыщенных паров над раствором можно пренебречь), то общее давление насыщенного пара над раствором равно парциальному давлению паров растворителя. В этом случае давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре. Таким образом, температура кипения раствора нелетучего вещества Tb всегда выше, чем температура кипения чистого растворителя при том же давлении T°b. Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора Криоскопическая и эбулиоскопическая константы Коэффициенты пропорциональности К и Е в приведённых выше уравнениях — соответственно, криоскопическая и эбулиоскопическая постоянные растворителя, имеющие физический смысл понижения температуры кристаллизации и повышения температуры кипения раствора с концентрацией 1 моль/кг. Для воды они равны 1,86 и 0,52 K·моль−1·кг, соответственно. Поскольку одномоляльный раствор не является бесконечно разбавленным, второй закон Рауля для него в общем случае не выполняется, и величины этих констант получают экстраполяцией зависимости из области малых концентраций до m = 1 моль/кг. Для водных растворов в уравнениях второго закона Рауля моляльную концентрацию иногда заменяют молярной. Вобщем случае такая замена неправомерна, и для растворов, плотность которых отличается от 1 г/см³, может привести к существенным ошибкам. Второй закон Рауля даёт возможность экспериментально определять молекулярные массы соединений, неспособных к диссоциации в данном растворителе; его можно использовать также для определения степени диссоциации электролитов. Растворы электролитов Законы Рауля не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток — растворов электролитов. Для учёта этих отклонений Вант-Гофф внёс в приведённые выше уравнения поправку — изотонический коэффициент i, неявно учитывающий диссоциацию молекул растворённого вещества: Неподчинение растворов электролитов законам Рауля и принципу Вант-Гоффа послужили отправной точкой для создания С. А. Аррениусом теории электролитической диссоциации. Закон Вант - Гоффа: определение и его математическое выражение для не электролитов и электролитов. Изотонический коэффициент, понятие, определение и его зависимость от концентрации раствора.  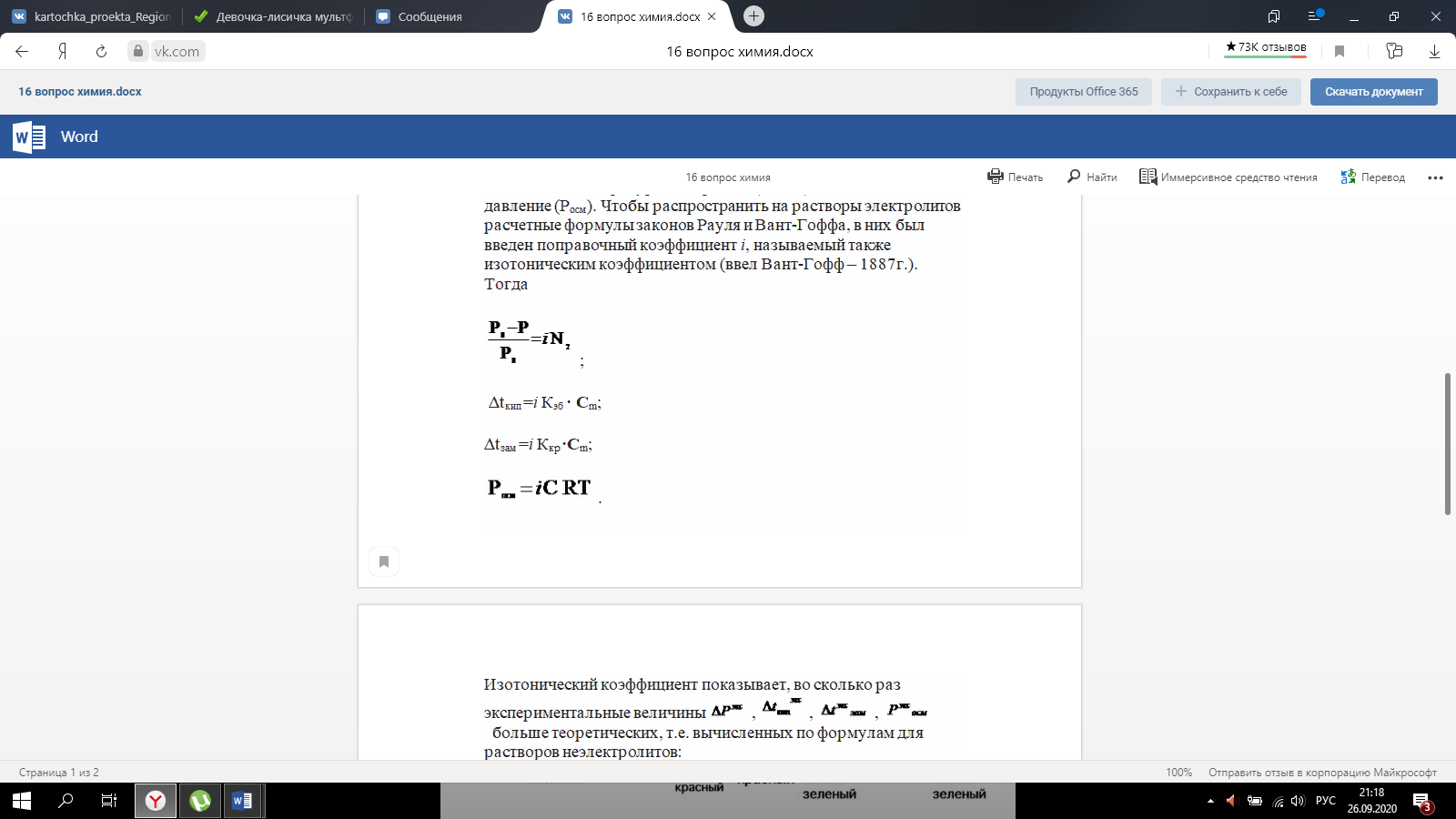 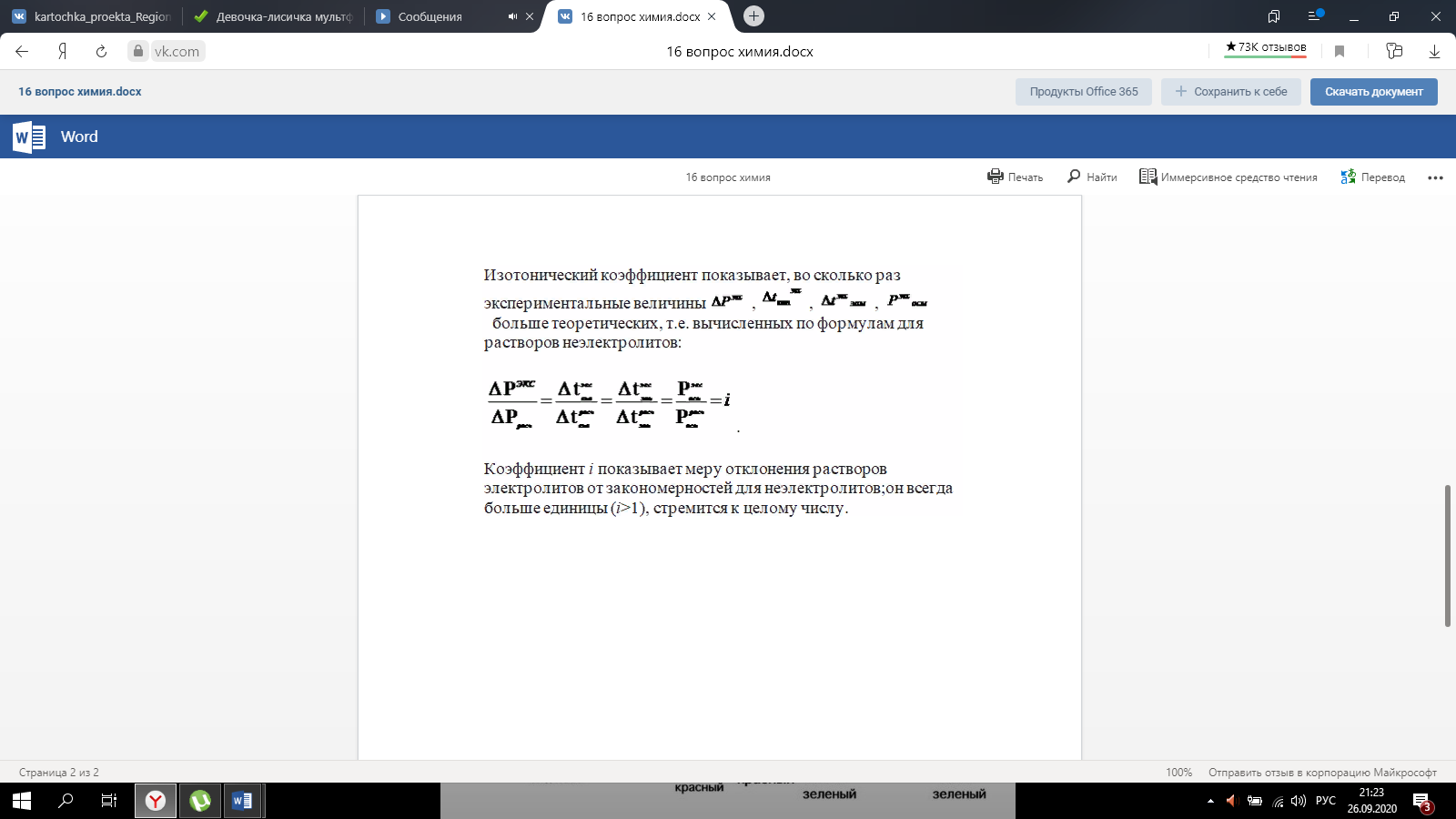 17. Определение осмоса и осмотического давления; факторы, влияющие на осмотическое давление; формула для расчёта осмотического давления. Роль осмоса в биологии и медицине. 18.Понятия: эндоосмос, экзоосмос, изоосмия. В каких растворах наблюдаются эти процессы? Что при этом происходит? Гемолиз, плазмолиз, тургор. Их значение в медицине и биологии. Эндосмос и экзосмос, частные случаи явления осмоса. Осмос состоит в следующем: если два раствора различных концентраций или раствор и чистый растворитель отделены друг от друга полупроницаемой перепонкой (пергамент, животный пузырь и т. п.), то растворитель переходит от более слабого раствора в более крепкий, растворённое же вещество через перепонку не проходит; процесс перехода растворителя продолжается до тех пор, пока или не выравняются концентрации или не возникнет достаточное давление в более крепком растворе, прекращающее ток растворителя через перепонку (см. растворы, XXXV, 681/82). В прежнее время явления перехода растворителя в раствор (или переход его из слабого раствора в более крепкий) называли эндосмосом; если к раствору приложить извне давление, превышающее его осмотическое давление, то растворитель станет уходить из раствора через перепонку в сосуд с чистым растворителем (или в более слабый раствор); такое явление получило название экзосмоса. Эти термины в настоящее время почти вышли из употребления. Изоосмия - относительное постоянство осмотического давления в жидких средах и тканях организма, обусловленное поддержанием на данном уровне концентраций содержащихся в них веществ: электролитов, белков и т. д. Явление осмоса наблюдается в тех средах, где подвижность растворителя больше подвижности растворённых веществ. При эндо и экзосмосе наблюдается перенос растворителя в среду с большей концентрацией растворенного вещества Гемо́лиз — разрушение эритроцитов крови с выделением в окружающую среду гемоглобина. В норме физиологический гемолиз завершает жизненный цикл эритроцитов (120 суток) и происходит в организме человека и животных непрерывно. Плазмолиз - это процесс, при котором клетки теряют воду в гипертоническом растворе. Обратный процесс, деплазмолиз или цитолиз , может происходить, если клетка находится в гипотоническом растворе, что приводит к более низкому внешнему осмотическому давлению и чистому потоку воды в клетку. Значение данных процессов состоит в том, что при длительной засухе растение может при помощи плазмолиза выделять из своих клеток запасы воды на поверхность листьев, дабы защитить от чрезмерного влияния солнечных лучей. А когда идут дожди - происходит деплазмолиз и клетки вновь наполняются водой. Ту́ргор тка́ней — напряжённое состояние оболочек живых клеток. Тургорное давление — внутреннее давление, которое развивается в растительной клетке, когда в неё в результате осмоса входит вода и цитоплазма прижимается к клеточной стенке; это давление препятствует дальнейшему проникновению воды в клетку. 19. Изотонические, гипо- и гипертонические растворы. Какие процессы происходят с клеткой в этих растворах? Где эти растворы используются в медицинской практике? ----- . Гипертонические растворы- растворы, Осмотическое давление которых выше осмотического давления в растительных или животных клетках и тканях. В зависимости от функциональной, видовой и экологической специфики клеток осмотическое давление в них различно, и раствор, гипертоничный для одних клеток, может оказаться изотоничным или даже гипотоничным для др. При погружении растительных клеток в Г. р. он отсасывает воду из клеток, которые уменьшаются в объёме, а затем дальнейшее сжатие прекращается и протоплазма отстаёт от клеточных стенок Эритроциты крови человека и животных в Г. р. также теряют воду и уменьшаются в объёме. Г. р. в сочетании с гипотоническими растворами и изотоническими растворами применяют для измерения осмотического давления в живых клетках и тканях. Медицина - Перечень патологий, от которых удаётся успешно избавиться, применяя гипертонический раствор, достаточно велик, поэтому такое средство многие по-настоящему считают уникальным. Солевой раствор воды способен вылечить:1. головные боли и мигрень; 2.воспалительные заболевания носоглотки;3. ОРЗ; 4.бронхиальную астму;5. ангину; 6.гипертонию; 7.приступы гипертензии; 8.отёчность; 9.остеохондроз; 10.гематомы;11. поражения суставов; 12.патологические изменения в тканях; 13.гинекологические заболевания. 2.Гипотонические растворы - в биологии, различные растворы, Осмотическое давление которых ниже, чем в клетках растительных или животных тканей. В Г. р. клетки насасывают воду, увеличиваясь в объёме, и теряют часть осмотически активных веществ (органических и минеральных). Эритроциты крови животных и человека в Г. р. разбухают до такой степени, что их оболочки лопаются и они разрушаются. Это явление называют Гемолизом. Медицина-1.Для полоскания (ангины, тонзиллиты, воспалительные заболевания носоглотки). 2.Для обработки гнойных ран (повязки, компрессы). 3.При отеках. 4.В гинекологии.5. 10% раствор вводится внутривенно при желудочных, кишечных и легочных кровотечениях.6. 5% раствор применяют в виде клизмы. 7.Оказывает терапевтический эффект при приеме ванн. 8.В косметологии для укрепления ногтей, волос, при грибковых заболеваниях. 3.Изотонические растворы(от Изо... и греч. tónos — напряжение)- растворы с одинаковым осмотическим давлением в биологии и медицине — природные или искусственно приготовленные растворы с таким же осмотическим давлением, как и в содержимом животных и растительных клеток, в крови и тканевых жидкостях. В нормально функционирующих животных клетках внутриклеточное содержимое обычно изотонично внеклеточной жидкости. При сильном нарушении изотоничности растворов в растительной клетке и окружающей среде вода и растворимые вещества свободно перемещаются в клетку или обратно, что может привести к расстройству нормальных функций клетки . Как правило, по своему составу и концентрации И. р. близки к морской воде. Для теплокровных животных изотоничны 0,9%-ный раствор NaCl и 4,5%-ный раствор глюкозы. И. р., близкие по составу, pH, буферности и другим свойствам к сыворотке крови, называются физиологическими растворами (раствор Рингера для холоднокровных животных и растворы Рингера — Локка и Рингера — Тироде для теплокровных животных). В кровезамещающие И. р. для создания коллоидно-осмотического давления вводят высокомолекулярные соединения (декстран, поливинол и др.). Медицина - 1.Для восполнения жидкости в организме ( понос, рвота, при кровопотере, ожогах, высокой температуре тела).2 В качестве дезинтоксикационной терапии (различные инфекционные заболевания, отравления). 3.Для ингаляций ( в чистом виде и в сочетании с другими лекарственными средствами).4. Для промывания носа, глаз, контактных линз. Как растворитель для целого ряда лекарственных средств. 20. Диффузия и скорость диффузии. Сравнение диффузии с осмосом. 20. Диффузия и скорость диффузии. Сравнение диффузии с осмосом.
20. Диффузия и скорость диффузии. Сравнение диффузии с осмосом. Диффузия – это самопроизвольный процесс переноса частиц растворенного вещества и растворителя, который осуществляется при наличии градиента концентрации растворенного вещества и приводит к выравниваниюконцентрации этого вещества по всему объему раствора. Скоростью диффузии называют количество вещества, переносимого за счет диффузии через единичную площадь поверхности в единицу времени Ключевые моменты Что нужно помнить о диффузии и осмосе: И диффузия, и осмос являются пассивными транспортными процессами, которые выравнивают концентрацию раствора. При диффузии частицы перемещаются из области с более высокой концентрацией в область с более низкой концентрацией, пока не будет достигнуто равновесие. При осмосе присутствует полупроницаемая мембрана, поэтому только молекулы растворителя могут свободно перемещаться для выравнивания концентрации. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

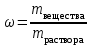 ;
; 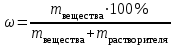
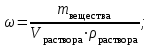
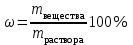
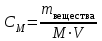 ;
;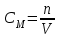
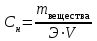
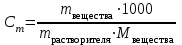
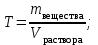
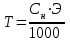
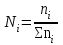 ;
;