колок по химии . первй. Коллоквиум по химии – первый модуль. Суть теории растворов растворитель химическая индифферентная среда( не вступающая ни в какие реакции), в которой равномерно распределены частицы растворенного вещества.
 Скачать 183.85 Kb. Скачать 183.85 Kb.
|
|
Коллоквиум по химии – первый модуль Сторонники физической модели процесса растворения: С.А. Аррениус, Я.Х. Вант-Гофф, В.Ф. Оствальд. Суть физической теории и ее применение. Была открыта Якобом Г. Вант-Гоффом и Свате А.Аррениусом. Суть теории растворов: растворитель – химическая индифферентная среда( не вступающая ни в какие реакции), в которой равномерно распределены частицы растворенного вещества. Теория не предполагает наличие межмолекулярных связей между растворителем и растворенным веществом. Под эту теорию подходят только идеальные растворы, где компоненты растворителя никак не воздействуют на растворимое соединение. Примером являются газовые растворы, где нереагирующие между собой газы смешиваются друг с другом в неограниченных количествах. Все физические данные (температура кипения и плавления, давление, теплоемкость) вычисляется исходя из свойств всех соединений, входящих в состав. По закону Дальтона: общее давление газовой смеси равно сумме парциальных давлений ее компонентов: Pобщ = Р1 + Р2 + Р3 +… Сторонники химической модели процесса растворения: Д.И. Менделеев, Каблуков И.А., Н.С. Курнаков и др. Суть химической теории. Образование сольватов (гидратов). Химическую (сольватную) теорию растворов описал Д.И. Менделеев. Суть заключается в следующем: частицы растворителя и растворенного вещества реагируют друг с другом, в результате чего получаются нестойкие соединения переменного состава – гидраты (сольваты). Основные связи тут – водородные. Вещество может распадаться на слои (растворяться) в случае полярного растворителя (воды). Ярким примером является растворение поваренной соли. Также может протекать реакция между компонентами смеси: H2O +Cl2 = HCl + HOCl, В ходе процесса растворения происходит изменение состава и объема реакционной смеси, т.к. протекают 2 процесса: разрушение структуры растворяемого вещества и химическая реакция между частицами. Оба процесса идут с изменением энергии. Тепловые эффекты могут быть экзотермическими и эндотермическими (с выделением и поглощением энергии). Соединения с частицами растворителя называются гидратами. Кристаллические вещества, в состав которых входят гидраты, называются кристаллогидратами и имеют различную окраску. Например, кристаллогидрат сульфата меди: CuSO4 ·5H2О. Раствор кристаллогидрата синий. Если рассмотреть кристаллогидрат кобальта CoCl2· 6H2O, то он обладает розовым цветом, CoCl2· 4H2O – красный, CoCl2 ·2H2O - сине-фиолетовый, CoCl2 ·H2О – темно-синий, а безводный раствор хлорида кобальта – бледно-синего цвета Понятия: раствор, растворитель, растворенное вещество. Раствор- это гомогенная термодинамическая устойчивая система , состоящая из двух или более компонентов , состав , которого может изменятся в пределах , допустимых растворимостью Растворитель – это вещество агрегатное состояние которого не изменяется при образовании раствора . При одинаковом агрегатном состоянии компонентов растворитель – вещество , которое в большем количестве. Растворённое вещество - компонент, взятый в недостатке и равномерно распределенный в виде молекул, ионов в растворителе Классификация растворов: по природе растворителя, по размерам частиц и степени однородности растворенного вещества, по агрегатному состоянию, по возможности к электролитической диссоциации (по поведению вещества в растворе), по концентрации (относительному количеству компонентов), по растворимости (насыщенные, ненасыщенные и пересыщенные). по природе растворителя- -водные; -неводные: растворы в органических растворителях (спирты, эфиры, ацетон, бензол). по размерам частиц и степени однородности растворенного вещества – коллоидные растворы и истинные ;частицы растворенного вещества не видимы ни визуально, ни под микроскопом, свободно передвигаются в среде растворителя. Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени.; гомогенные системы – нет границы раздела фаз; в коллоидных растворах частицы по размеру крупные( глюкоза р-р, NaCl р-р) , гетерогенные системы – есть нраница раздела фаз ( мел+ вода; песок+ вода ; дым; туман) по агрегатному состоянию- по агрегатному состоянию ·газообразные (воздух) ·жидкие (физраствор) ·твердые (сплавы) по возможности к электролитической диссоциации (по поведению вещества в растворе) - ·растворы электролитов (растворы низкомолекулярных электролитов и растворы высокомолекулярных электролитов - полиэлектролитов) ·растворы неэлектролитов (не проводят электрический ток)(сахар) ·растворы амфолитов( это такие электролиты, которые могут проявлять одновременно и кислотные, и основные свойства.) ( раствор Zn(OH)2) по концентрации (относительному количеству компонентов)- концентрированный ( легкорастворимый ; 0,1 М KBr ) , разбавленный ( малорастворимый; CaSO4 , нерастворимый ; AgCl) по растворимости (насыщенные, ненасыщенные и пересыщенные)- Насыщенный раствор, раствор, находящийся при данных условиях (температура, давление) в устойчивом равновесии с растворённым веществом. ; Ненасыщенным называют такой раствор, в котором при данной температуре находится меньше растворяемого вещества, чем в его насыщенном растворе.; Пересыщенным называют такой раствор, в котором при данной температуре находится в растворённом состоянии больше вещества, чем в его насыщенном растворе при тех же условиях. Растворимость - понятие, факторы, влияющие на растворимость: природа растворенного вещества и растворителя, температура, давление. Растворимость – это содержание максимальной массы растворённого вещества в 100 г растворителя при данной температуре. Природа растворяемого вещества и растворителя.Существует классическое правило «подобное растворяется в подобном». Полярные вещества (ионные соединения и соединения с полярной ковалентной связью) лучше растворяются в полярном растворителе. Для растворения неполярных веществ необходимо применять неполярные соединения. Температура. Давление.О влиянии температуры на растворимость можно говорить только в общих чертах, так как этот процесс неоднозначный. Как правило, повышение температуры увеличивает растворимость тех веществ, процесс растворимости которых эндотермичный, т. е. идет с поглощением теплоты (ДНраств > 0). С изменением температуры растворимость тв. веществ , жидких – увеличивается ( искл- NaCl – const ) Для газов – растворение экзотермическая реакция При понижении температуры растворимость газов увеличивается На растворимость газов сильно влияет давление. Зависимость растворимости газов от давления выражается законами Дж. Генри и Дж. Дальтона:«Масса газа, растворяющегося в данном объеме жидкости, пропорциональна давлению, которое газ производит на жидкость». Зависимость растворимости твердых веществ и газов в жидкостях от температуры. С изменением температуры растворимость тв. веществ , жидких – увеличивается ( искл- NaCl – const ) Для газов – растворение экзотермическая реакция При понижении температуры растворимость газов увеличивается Для твёрдых и жидких веществ влияние давления на растворимость менее значимо, чем для газов. Растворимость жидких веществ в жидкостях. Привести примеры неограниченной и ограниченной растворимости. Рассмотреть примеры полной нерастворимости. При смешивании двух жидкостей можно наблюдать самую различную их взаимную растворимость: от практически полной нерастворимости друг в друге (ртуть - вода) до неограниченной смешиваемости (ацетон - вода). Неограниченно растворяются в воде все жидкие неорганические кислоты (HNO3, HClO4, HCN, HNCS, и др.), простейшие органические кислоты (НСООН, СН3СООН и др.), простейшие спирты и кетоны (СН3ОН, С2Н5OН, СН3СОСН3 и др.). Если жидкости растворяются друг в друге ограниченно, то происходит их расслаивание с образованием двух жидких фаз, причем фаза с большей плотностью будет находиться внизу Соприкасающиеся слои жидкостей находятся в фазовом равновесии, и каждый слой представляет собой насыщенный раствор одной жидкости в другой при данной температуре. Ну во-первых, AgCl растворим в воде. Во-вторых, степень ковалентности связи Ag-Cl куда больше, чем у связи K-Cl. В частности, это проявляется в образовании комплексного аниона [AgCl2]-, из-за чего хлорид серебра довольно-таки растворим в солянке. Из-за большей ковалентности связи прочность решётки возрастает, отсюда и разница с KCl в растворимости в воде. Почему именно ковалентность выше -- сходу не скажешь, потому что и у серебра 5sp уровень лежит близко к 4d и они сильно перекрываются, отчего там есть вакантные состояния в валентной полосе, и у хлора 3d уровень вакантен (в основном состоянии) и вполне может перекрываться с какими-то заполненными состояниями серебра. Надо считать... Зависимость растворимости газов в жидкостях от давления. Законы Генри-Дальтона-Сеченова, формулировки и математические формулы. Медико-биологическое значение этих законов. Газы не растворяются в жидкости беспредельно. При некоторой концентрации газа Х устанавливается равновесие: X(г)=Х(ж) При растворении газа в жидкости происходит значительное уменьшение объема системы. Поэтому изменение давления приводит к смещению равновесия и изменяет растворимость газа. Зависимость растворимости газа от давления выражается законом Генри (для индивидуального газа) или законом Дальтона (для смеси газов). Закон Генри: количество газа, растворенного при данной температуре в определенном объеме жидкости, при равновесии прямо пропорционально давлению газа. Где -концентрация газа в насышенном растворе, моль/л; P(x)-давление газа над раствором - постоянная Генри для газа , моль/л∙Па. Закон Дальтона: растворимость каждого из компонентов газовой смеси при постоянной температуре пропорциональна парциальному давлению компонента над жидкостью и не зависит от общего давления смеси и индивидуальности других компонентов Где - парциальное давление компонента р-общее давление газовой смеси - мольная доля компонента Закон Генри является частным случаем закона Дальтона. Законы Генри и Дальтона имеют большое практическое значение для медицины. Изменение растворимости газов в крови при изменении давления могут вызывать тяжелые заболевания. Примером может служить «кессонная болезнь» водолазов. Чем больше глубина погружения, тем больше давление и, соответственно, больше растворимость азота в плазме крови. Если поднимать водолаза на поверхность слишком быстро, то давление в легких резко понижается и, следовательно, значительно понижается растворимость газов в плазме крови. Вследствие этого часть газов выделяется из крови в виде пузырьков, которые закупоривают мелкие сосуды в различных органах и тканях. Этот процесс (эмболия) может привести к тяжелому поражению тканей и даже к гибели человека. На законах Генри и Дальтона основано лечение ряда заболеваний, при которых в омертвевших тканях накапливаются микробы. В этом случае больных помещают в барокамеры с повышенным давлением кислорода в воздухе. При этом улучшается снабжение тканей кислородом, что во многих случаях дает хорошие результаты при лечении. Закон Сеченова: растворимость газов в жидкости в присутствии электролитов понижается вследствие высаливания газов. Понижение растворимости газов в растворе электролита связано с процессом сольватации (гидратации) ионов молекулами растворителя. В результате этого процесса уменьшается число свободных молекул растворителя, а, следовательно, понижается его растворяющая способность. Для биологических систем важным является то, чтоуменьшению растворимости газов в воде способствуют белки, липиды и другие вещества, содержащиеся в крови. Изменение содержания указанных веществ оказывают существенное влияние на растворимость кислорода и диоксида углерода в крови. Способы выражения состава растворов: массовая доля, молярная концентрация, молярная концентрация эквивалента (нормальная концентрация), моляльная концентрация, титр, мольная доля. Привести математические формулы, дать определение и рассмотреть физический смысл каждого наименования. Способы выражения состава растворов
Закон эквивалентов. Следствие из закона эквивалентов. Расчетные формулы, определение, физический смысл. Эквивалентом вещества называют реальную или условную частицу вещества, которая в данной кислотно-основной реакции эквивалентна одному иону водорода, или в данной окислительно-восстановительной реакции – одному электрону. Фактором эквивалентности (f) называют число, показывающее, какая часть реальной частицы вещества эквивалентна одному иону водорода в кислотно-основной реакции, или одному электрону в окислительно-восстановительной реакции. Фактор эквивалентности выражается величиной Молярной массой эквивалента (эквивалентной массой) вещества (Э) называют величину, равную произведению фактора эквивалентности на молярную массу вещества 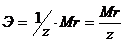 . .Закон эквивалентов: Все вещества реагируют и образуются в эквивалентных соотношениях. Закон и следсвие из него смотри в таблице ( 9-10 пункты) 9 вопрос !!!! Приготовление разбавленных растворов кислот из более концентрированных и их количественное определение (титриметрия) алкалиметрическим методом. Рассмотреть приготовление растворов на примере НСl, а титрование - с применением в качестве титранта NaOH. Коллигативные свойства растворов. Дать понятие и привести примеры. Первый закон Рауля, две трактовки закона. Рассмотреть давление насыщенного пара над раствором в зависимости от мольной доли растворителя и мольной доли растворенного вещества. Привести математические формулы. Понятие - насыщенный пар. Зависимость давления насыщенного пара от температуры. Второй закон Рауля. Рассмотреть зависимость температуры кипения и замерзания растворов от моляльной концентрации раствора. Физический смысл эбулиоскопической (Е, Кэб) и криоскопической констант (К, Ккр). Зависимость их значений от природы растворителя. Закон Вант-Гоффа: определение и его математическое выражение для не электролитов и электролитов. Изотонический коэффициент, понятие, определение и его зависимость от концентрации раствора. Определение осмоса и осмотического давления; факторы, влияющие на осмотическое давление; формула для расчёта осмотического давления. Роль осмоса в биологии и медицине. Понятия: эндоосмос, экзоосмос, изоосмия. В каких растворах наблюдаются эти процессы? Гемолиз, плазмолиз, тургор. Их значение в медицине и биологии. Изотонические, гипо- и гипертонические растворы. Какие процессы происходят с клеткой в этих растворах? Применение данных растворов в медицинской практике. Диффузия и скорость диффузии. Сравнение диффузии с осмосом. |

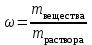 ;
; 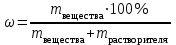
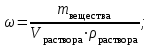
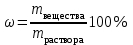
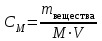 ;
;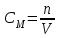
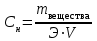
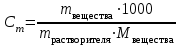
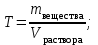
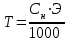
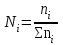 ;
;