отчет по модули химии. изотонический коэффициент
 Скачать 364.75 Kb. Скачать 364.75 Kb.
|
|
1. Изотонический коэффициент. Физический смысл изотонического коэффициента. ί - изотонический коэффициент или коэффициент Вант-Гоффа., который показывает, во сколько раз увеличивается число частиц электролита в растворе по сравнению с введенной молекулярной формой. 2. Степень диссоциации. Сильные и слабые электролиты. Отношение числа молекул, распавшихся на ионы к общему числу молекул растворенного вещества называется степенью диссоциации. Степень диссоциации может иметь значения от 0 до 1 (от 0 до 100%). В зависимости от величины α все электролиты делятся на сильные и слабые. 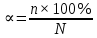 Сильные электролиты диссоциируют практически полностью. К ним относятся все соли (кроме некоторых солей ртути), гидроксиды щелочных, щелочноземельных и некоторых других (Tl, La) металлов, сильные кислоты (например, НС1, НNO3, Н2SO4, HClO4). Слабыми являются электролиты, у которых α < 3%. К слабым электролитам относятся Н2О, Н2СО3, H2SО3, H2S, HCN, СН3СООН и многие другие органические кислоты, NH4ОН, а также гидроксиды большинства металлов, кроме перечисленных выше. 3. Факторы, влияющие на степень диссоциации (температура, концентрация раствора, одноименные ионы). Т. Процесс диссоциации эндотермический  Концентрация  Добавление сильных электролитов или одноимённых ионов  4. Константа диссоциации слабого электролита. Показатель константы диссоциации (pKa , pKb ). Факторы, влияющие на величину константы диссоциации.  5. Растворы слабых электролитов. Закон разбавления Оствальда.  Для слабых электролитов: 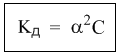 6. Ступенчатые константы диссоциации для многоосновных кислот и многокислотных оснований. Суммарные константы диссоциации.  7. Теория растворов сильных электролитов. Кажущаяся степень диссоциации.  8. Роль электролитов в процессах жизнедеятельности. Электролитам в организме человека принадлежит главенствующая роль в осмотическом гомеостазе (поддержании постоянства внутренней среды). 9. Диссоциация кислот и оснований. 10. Диссоциация воды. Ионное произведение воды. Водородный показатель. Характеристика реакции среды с помощью водородного показателя.  12. Обменные реакции в растворах электролитов. Особенности их протекания. Реакции, протекающие в растворах между электролитами, называются реакциями ионного обмена. (реакции ионного обмена – это реакции между ионами, образовавшимися в результате диссоциации электролитов). Реакции обмена в растворах электролитов протекают в направлении связывания ионов. Реакции ионного обмена протекают до конца, если: 1) образуется осадок; 2) выделяется газ; 3) образуется малодиссоциирующее вещество – вода. Если в растворах нет таких ионов, которые могут связываться между собой с образованием осадка, газа или воды, то реакция является обратимой. 13. Гидролиз солей. Основные типы гидролиза солей. 14. Гидролиз соли по катиону. 15. Гидролиз соли по аниону. 16. Гидролиз соли по катиону и аниону. 1. Какие растворы называются буферными? Кислотно-основные_буферные'>Кислотно-основные буферные растворы называютсрастворы, рH которых практически не изменятеся при добавлении к ним сильных кислот или щелочей 2. Что такое кислотно-основный гомеостаз? Кислотно-основное равновесие Кисло́тно-осно́вное равнове́сие — относительное постоянство соотношения кислота-основание внутренней среды живого организма. 3. На какие типы классифицируют буферные растворы? Буферные растворы в зависимости от своего состава делятся на 2 основных типа: кислотные и основные. 4. Рассмотрите механизм буферного действия ацетатного буфера. Ацетатный буфер (CH3COOH+CH3COONa) . Механизм действия: - При добавлении сильной кислоты к буферной смеси, кислота реагирует с солью, в результате этой реакции образуются другая соль и слабая уксусная кислота. CH3COONa + HCl = CH3COOH+NaCl- При добавлении сильного основания к буферной смеси между молекулами сильного основания и слабой кислоты протекает реакция нейтрализации CH3COOH+NaOH = CH3COONa + H2O 5. Рассмотрите механизм буферного действия аммиачного буферного раствора. Аммиачный буфер ( NH3*H2O + NH4Cl ). Механизм действия:- При добавлении сильной кислоты к буферной смеси, кислота реагирует со слабым основанием по реакции нейтрализация NH4OH+HCl = NH4Cl + H2O - При добавлении сильного основания к буферной смеси, основание реагирует с солью, в результате реакции образуется другая соль и слабое основание NH4Cl + NaOH = NaCl + NH4OH 6. Рассмотрите механизм буферного действия фосфатной буферной системы. Для кислотной буферной системы, образованной двумя солями механизм действия будет аналогичным. Рассмотрим его на примере фосфатного буфера: NaH2PO4 + Na2HPO4. Добавленная к нему сильная кислота провзаимодействует с солевой компонентой системы и заместится на эквивалентное количество компоненты, играющей роль слабой кислоты. Na2HPO4 + HCl = NaH2PO4 + NaCl Внесенная щелочь, наоборот, заместится на эквивалентное количество нейтральной солевой компоненты буфера: NaH2PO4 + NaOH = Na2HPO4 + H2O 7. По какой формуле можно рассчитать рН кислотной буферной системы? Для подсчета рН кислотного буфера: pH=pKa+lg  8. Уравнение Гендерсона - Гассельбаха для основных буферных систем. Для основного: pH=14-pKb+lg 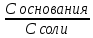 9. Что такое буферная емкость раствора? Формулы для расчета буферной емкости раствора. Буферная емкость (В)-колличественная меря устойчивости буферных р-ров В-кол-во сильной к-ты или щелочи, которое нужно добавить к 1л буферного р-ра,чтобы рН буферного р-ра изменилось на одну единицу  , моль/л, С концентрация сильной кислоты, , моль/л, С концентрация сильной кислоты,  =pH-p =pH-p 10. От каких факторов зависит величина буферной емкости растворов? Буферная емкость зависит от: 1) соотношения концентраций компонентов 2) от кол-ва компоненктов (с разбавлением уменьшается) 11. Что такое алкалоз? Чем он может быть вызван? 12. Что такое ацидоз? Чем он может быть вызван? Когда компенсаторные механизмы организма не способны предотвратить сдвиги концентрации водородных ионов, наступает нарушение кислотно-оснóвного равновесия. При этом наблюдаются два противоположных состояния – ацидоз и алкалоз. При ацидозе концентрация водородных ионов в крови становится выше границ нормы. При этом, естественно рН уменьшается. Снижение величины рН ниже 6,8 вызывает смерть. Состояние алкалоза наблюдается при уменьшении концентрации ионов Н+ (рН, соответственно, возрастает) по сравнению с нормой. Увеличение значений рН до 8,0 приводит к быстрому летальному исходу. В зависимости от механизмов развития нарушений кислотно-основного равновесия разделяют дыхательный и метаболический ацидоз или алкалоз. Дыхательный ацидоз возникает в результате уменьшения минутного объема дыхания (например, при бронхиальной астме, отеке, эмфиземе легких, асфиксии механического порядка и т.д.). Все эти заболевания ведут к гиповентиляции и к повышению парциального давления СО2 артериальной крови и содержания в плазме НСО3 – ионов. Дыхательный алкалоз, наоборот, возникает при вдыхании чистого кислорода, компенсаторной одышке, сопровождающей ряд заболеваний, пребывании в разряженной атмосфере. При дыхательном алкалозе в крови уменьшается концентрация растворенного СО2 и гидрокарбонат-ионов (щелочной резерв крови). Метаболический ацидоз – самая частая и тяжелая форма нарушений кислотно- основного равновесия. Он обусловлен накоплением в тканях и крови органических кислот. Этот вид ацидоза связан с нарушением обмена веществ и возможен при диабете, голодании, лихорадке, заболеваниях желудочно-кишечного тракта и т.д. Метаболический алкалоз развивается при потере в результате неукротимой рвоты большого количества кислотных эквивалентов) и всасывании в кровь большого числа основных эквивалентов кишечного сока, а также при накоплении в тканях основных продуктов обмена веществ. 13. Сравните буферную емкость по кислоте и по щелочи гидрокарбонатной буферной системы в плазме крови? 14. Сравните буферную емкость по кислоте и по щелочи фосфатной буферной системы в плазме крови? 15. Рассмотрите, как повлияет поступление в кровь продуктов кислого характера на количество растворенного углекислого газа в плазме. 16. Запишите реакцию, которая протекает при добавлении небольшого количества сильной кислоты к фосфатному буферному раствору, как при этом изменяется рН? |
