Буферные растворы. 1 Буферные растворы
 Скачать 29.16 Kb. Скачать 29.16 Kb.
|
|
1)Буферные растворы. Буферные растворы - это растворы, способные сохранять постоянство pH при разбавлении или добавлении к ним небольших количеств сильной кислоты или сильного основания. Именно благодаря буферным растворам в организме человека при ежесуточно образовании кислоты, эквивалентной 2,5 л концентрированной соляной кислоты, поддерживается постоянное значение pH. 2) Классификация буферных систем: 1. Состоящий из слабой кислоты и ее соли - кислотный буфер: например ацетатный буферный раствор, действует в интервале pH (pKa ± 1); 2. Состоящий из слабого основания и его соли - основный буфер: например аммиачный буферный раствор - смесь аммиака и его соли, действует в интервале pH от 9 и выше. 3. Состоящий из анионов кислой и средней соли или двух кислых солей слабых кислот - солевой буфер: например фосфатные буферные системы, представляют из себя смесь двух кислых солей гидрофосфата и дигидрофосфата, действующих в интервале pH от 6,8 до 8. 4. Ионы и молекулы амфолитов: например аминокислоты или белки. 3)Расчет рН буферных растворов. Расчет pH во всех случаях проводится по уравнению Гендерсона-Гассельбаха, в котором удобно вместо концентрации использовать количество вещества, так как в этом случае уже учитывается разбавление раствора при смешивании. В случае кислотного буфера: pH = pKa + lg 𝒏 соли обр. /𝒏 кислоты ост. где pKа = - lg Kа – константа диссоциации слабой кислоты В случае основного буфера: pH = 14 – pKв - lg 𝒏 соли /𝒏 осн. где pKв = - lg Kв – константа диссоциации слабого основания В случае смесей солей многоосновных кислот в уравнении Гендерсона-Гассельбаха используют рК соответствующей ступени диссоциации многоосновной кислоты. pH = pKa2 + lg 𝒏 соли /𝒏 сопр.кислоты где pKa2 = - lg Kа2 – константа второй стадии диссоциации слабой фосфорной кислоты pH буферного раствора зависит от: отношения концентрации компонентов буферных систем, от свойств буферной пары и растворителя; 4. Механизм действия буферных систем. МЕХАНИЗМ ДЕЙСТВИЯ КИСЛОТНОГО БУФЕРА CH3COOH - CH3COONa ацетатный буфер: смесь слабой уксусной кислоты и ее соли - ацетата натрия CH3COOH ← CH3COO- + H + диссоциация слабого электролита, равновесие сильно сдвинуто влево CH3COONa → CH3COO- + Na+ диссоциация сильного электролита протекает полностью, равновесие сильно сдвинуто вправо Образующиеся ацетат-ионы подавляют диссоциацию уксусной кислоты pH = pKa + lg 𝒏 соли /𝒏 кислоты где pKa = - lg Ka – константа диссоциации слабой кислоты 1) Добавим сильное основание (щелочь) к данной буферной системе: CH3COOH + NaOH = CH3COONa + H2O pH = pKa + lg 𝒏 соли исх.+ 𝒏 соли образ./𝒏 кисл.ост. В результате сильное основание замещается на эквивалентное количество нейтральной соли буферной системы, поэтому концентрация ионов Н+ (активная кислотность) в ней изменится незначительно. 2) Добавим кислоту к данной буферной системе: CH3COONa + HCl = CH3COOH + NaCl pH = pKa + lg 𝒏 соли исх.− 𝒏 соли прореаг. /𝒏 кисл.исх.+ 𝒏 кисл.образ. В результате этого воздействия сильная кислота замещается на эквивалентное количество плохо диссоциированной слабой кислоты буферной системы, поэтому концентрация ионов Н+ (активная кислотность) в растворе существенно не изменяется. МЕХАНИЗМ ДЕЙСТВИЯ ОСНОВНОГО БУФЕРА NH4OH - NH4Cl аммиачный буфер: смесь аммиака и его соли NH4OH ← NH3 + + H2O диссоциация слабого электролита, равновесие сильно сдвинуто влево NH4Cl → NH4 + + Cl – диссоциация сильного электролита протекает полностью, равновесие сильно сдвинуто вправо pH = 14 – pKв - lg 𝒏 соли /𝒏 осн. где pKв = - lg Kв – константа диссоциации слабого основания 1) Добавим щелочь к данной буферной системе: При добавлении щелочи ее нейтрализует NH4Cl NH4Cl + NaOH = NH4OH + NaCl pH = 14 - pKв - lg 𝒏 соли исх.− 𝒏 соли прореаг./ 𝒏 основ.исх.+𝒏 соли образ. Щелочь вступит в реакцию с солью буферной системы и вместо нее образуется эквивалентное количество слабого основания. 2) Добавим кислоту к данной буферной системе: При добавлении кислоты ее нейтрализует NH4OH NH4OH + HCl = NH4Cl + H2O pH = 14 - pKв - lg 𝒏 соли исх.+ 𝒏 соли образ./ 𝒏 основ.ост. Добавленная к буферу сильная кислота провзаимодействует со слабым основанием и заместится на эквивалентное количество солевой компоненты буфера. МЕХАНИЗМ ДЕЙСТВИЯ СОЛЕВОГО БУФЕРА KH2PO4 – K2HPO4 фосфатный буфер: смесь двух кислых солей дигидрофосфата и гидрофосфата KH2PO4 ← K + + H2PO4 2- диссоциация слабого электролита, равновесие сильно сдвинуто влево K2HPO4 → 2K + + HPO4 - диссоциация сильного электролита протекает полностью, равновесие сильно сдвинуто вправо pH = Pka2 + lg 𝒏 соли /𝒏 сопр.кислоты где Pka2 = - lg Kа2 – константа второй стадии диссоциации слабой фосфорной кислоты 1)Добавим щелочь (сильное основание) к данной буферной системе: KH2PO4 + KOH = K2HPO4 + H2O pH = Pka2 + lg 𝒏 соли исх.+𝒏 соли образ. /𝒏 кисл.исх−𝒏 сопр.кислоты прореаг. Внесенная щелочь заместится на эквивалентное количество нейтральной солевой компоненты буфера. 2) Добавим сильную кислоту к данной буферной системе: K2HPO4 + HCl = KH2PO4 + KCl pH = Pka2 + lg 𝒏 соли исх.−𝒏 соли прореаг./ 𝒏 сопр.кисл.исх+𝒏 сопр.кислоты образ. Добавленная к данному буферу сильная кислота провзаимодействует с солевой компонентой системы и заместится на эквивалентное количество компоненты, играющей роль слабой кислоты. Буферная ёмкость (β) характеризует способность буферного раствора сохранять постоянство pH при разбавлении, добавлении сильной кислоты и щёлочи. Действует в интервалах ±1 от показателя кислотности и основности: pKa ±1 pKв ±1 pKа2 ±1 Она определяется числом моль эквивалентности сильной кислоты или щёлочи, которую необходимо добавить к 1 литру буферного раствора, чтобы сместить его pH на единицу. Рассчитывать его можно по следующей формуле: βкисл. = 𝒏 экв.кислоты /𝜟𝒑𝑯∗𝑽б.р βосн. = 𝒏 экв.основ /𝜟𝒑𝑯∗𝑽б.р где Vб.р – объем буферного раствора, βкисл, βосн – буферная ёмкость. Величина буферной ёмкости зависит от концентрации компонентов буферной смеси и от отношения между этими компонентами. С повышением концентрации компонентов смеси она увеличивается, а при разбавлении - уменьшается. Буферная ёмкость имеет максимальное значение при одинаковых концентрациях компонентов смеси. 5.Биологические буферные системы, общие представления о механизме действия. Понятие о кислотно-основном состоянии организма. Буферные системы крови - физиологические системы и механизмы, обеспечивающие кислотно-основное равновесие в крови. Они являются «первой линией защиты», препятствующей резким перепадам pH внутренней среды живых организмов. В организме постоянство рН осуществляется гидрокарбонатной, фосфатной, оксигемоглобин-гемоглобин и белковой буферными системами. Гидрокарбонатная буферная система HCO3 - /H2CO3 состоит из угольной кислоты H2CO3 и сопряженного основания HCO3 - и представляет собой наиболее важную буферную систему плазмы крови. Ее особенность в том, что один из компонентов – угольная кислота H2CO3 образуется при взаимодействии растворенного в плазме CO2 с водой: CO2 (р) + H2O = H2CO3 Константа равновесия этой реакции K = 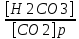 Между CO2 в альвеолах и гидрокарбонатным буфером в плазме крови, протекающей через капилляры легких, устанавливается цепочка равновесий: Атмосфера ↔ CO2 (г) ↔ CO2 (р) ↔ H2CO3 ↔ H+ + HCO3 – 1. В случае накопления кислот в крови уменьшается количество НСО3 - и происходит реакция: НСО3 - + Н+ ↔ Н2СО3 ↔ Н2О + СО2↑. Избыток удаляется лёгкими. Однако значение рН крови остаётся постоянным, так как увеличивается объём лёгочной вентиляции, что приводит к уменьшению объёма СО2. 2. При увеличении щелочности крови концентрация НСО3 - увеличивается: Н2СО3 + ОН- ↔ НСО3 - + Н2О. Это приводит к замедлению вентиляции лёгких, поэтому СО2 накапливается в организме и буферное соотношение остаётся неизменным. Гидрофосфатный буфер содержится как в крови, так и в клеточной жидкости других тканей, особенно почек. В клетках он представлен солями К2НРО4 и КН2РО4, а в плазме крови и в межклеточной жидкости Na2HPO4 и NaH2PO4. Функционирует в основном в плазме и включает: дигидрофосфат-ион Н2РО4 - и гидрофосфат-ион НРО4 2- . Например, при увеличении концентрации катионов Н+ во внутриклеточной жидкости, например, в результате переработки мясной пищи, происходит их нейтрализация ионами НРО4 2- : Н + + НРО4 2- ↔ Н2РО4 – Образующийся избыточный дигидрофосфат выводится почками, что приводит к незначительному снижению величины рН мочи. При увеличении концентрации оснований в организме, например при употреблении растительной пищи, они нейтрализуются ионами Н2РО4 - : ОН ‾ + Н2РО4 - ↔ НРО4 2- + Н2О Образующийся избыточный гидрофосфат выводится почками, при этом рН мочи незначительно повышается. Выведение тех или иных компонентов фосфатной буферной системы с мочой, в зависимости от перерабатываемой пищи, объясняет широкий интервал значений рН мочи - от 4,8 до 7,5. Фосфатная буферная система крови характеризуется меньшей буферной ёмкостью, чем гидрокарбонатная, из-за малой концентрации компонентов крови. Однако эта система играет решающую роль не только в моче, но и в других биологических средах - в клетке, в соках пищеварительных желез, в моче. Гемоглобиновый буфер - главная буферная система эритроцитов, на долю которой приходится около 75% всей буферной ёмкости крови. Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и СО2. Гемоглобиновая буферная система крови главная буферная система эритроцитов, на долю которой приходится около 75% всей буферной ёмкости крови. Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и СО2. Гемоглобиновая буферная система крови играет значительную роль сразу в нескольких физиологических процессах: дыхании, транспорте кислорода в ткани и в поддержании постоянства рН внутри эритроцитов, а в конечном итоге - в крови. Она представлена двумя слабыми кислотами - гемоглобином и оксигемоглобином и сопряженными им основаниями - соответственно гемоглобинат- и оксигемоглобинатионами: HHb ↔ H+ + Hb HHbO2 ↔ H+ + HbO2- Оксигемоглобин – более сильная кислота (рКа = 6,95), чем гемоглобин (рКа = 8,2). При рН = 7,25 (внутри эритроцитов) оксигемоглобин ионизирован на 65%, а гемоглобин – на 10%, поэтому присоединение кислорода к гемоглобину уменьшает значение рН крови, так как при этом образуется более сильная кислота. С другой стороны, по мере отдачи кислорода оксигемоглобином в тканях значение рН крови вновь увеличивается. Буферные свойства ННb прежде всего обусловлены возможностью взаимодействия кислореагирующих соединений с калиевой солью гемоглобина с образованием эквивалентного количества соответствующей калийной соли кислоты и свободного гемоглобина: КНb + Н2СО3 ↔ КНСО3 + ННb. Образующийся гидрокарбонат (КНСО3) уравновешивает количество поступающей Н2СО3, рН сохраняется, так как происходит диссоциация потенциальных молекул Н2СО3 и образовавшихся гемоглобиновых кислот. Именно таким образом поддерживается рН крови в пределах нормы, несмотря на поступление в венозную кровь огромного количества СО2 и других кислореагирующих продуктов обмена. В капиллярах лёгких гемоглобин (ННb) поглощает кислород и превращается в HHbO2, что приводит к некоторому подкислению крови, вытеснению некоторого количества Н2СО3 из бикарбонатов и понижению щелочного резерва крови, а в тканях отдает его и поглощает СО2. В лёгких: ННb + O2 ↔ HHbO2; HHbO2 + HCO3 - ↔ HbO2 + H2O + CO2 ↑ В тканях: HbO2 ↔ Hb- + O2; Hb- + Н2СО3 ↔ ННb + HCO3 – Белковый буфер - состоит из белка-кислоты и его соли, образованной сильным основанием. R – COOH - белок-кислота R – COONa - белок-соль 1. При образовании в организме сильных кислот они взаимодействуют с солью белка. При этом получается эквивалентное количество белок-кислоты: НС1 + R-COONa ↔ RCOOH + NaCl. По закону разбавления Оствальда увеличение концентрации слабого электролита уменьшает его диссоциацию, рН практически не меняется. 2. При увеличении щелочных продуктов они взаимодействуют с R-СООН: NaOH + R-COOH ↔ R-COONa + H2O Количество кислоты уменьшается. Однако концентрация ионов Н+ увеличивается за счет потенциальной кислотности белок-кислоты. поэтому практически рН не меняется. Белок – это амфотерный электролит и поэтому проявляет собственное буферное действие. Под кислотно-основным состоянием (КОС) подразумевается соотношение концентраций водородных (Н+) и гидроксильных (ОН) ионов в биологических средах. Необходимым условием существования живого организма является поддержание постоянства этого параметра внутренней среды. От величины рН зависят стабильность мембран, функции ферментов, диссоциация электролитов, нервно-мышечная возбудимость и проводимость, комплексообразование и другие процессы. Белковый, липидный, углеводный обмен является источником образования летучих (угольная) и нелетучих кислот (фосфорная, серная, пировиноградная, молочная и др.), часть из которых претерпевает дальнейшее окисление; небольшое количество кислых эквивалентов удаляется из организма в свободном состоянии или в виде солей. Основные соединения (ионы ОН , креатинин и др.) образуются в организме в значительно меньших количествах. Тенденция к увеличению концентрации ионов Н+ (и, соответственно, снижению рН) традиционно называется ацидозом; тенденция к снижению концентрации ионов Н+ (повышению рН) получила название «алкалоз». Значения рН крови ниже 6,8 и выше 8,0 считаются несовместимыми с жизнью и в клинике практически не встречаются. |
