Химические водоросли. Исследовательский Проект химические водоросли. свободинский аграрнотехнический техникум имени к. К. Рокоссовского исследовательский проект коллоидный сад или химические водоросли
 Скачать 188 Kb. Скачать 188 Kb.
|
|
ОБЛАСТНОЕ БЮДЖЕТНОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «СВОБОДИНСКИЙ АГРАРНО-ТЕХНИЧЕСКИЙ ТЕХНИКУМ ИМЕНИ К.К. РОКОССОВСКОГО» ИССЛЕДОВАТЕЛЬСКИЙ ПРОЕКТ «КОЛЛОИДНЫЙ САД ИЛИ ХИМИЧЕСКИЕ ВОДОРОСЛИ» Работу выполнил: обучающийся группы №2 23.01.03. Автомеханик Сокольников Н.С. Руководитель: преподаватель химии Плешакова Е.В. М. СВОБОДА 2020-2021гг Содержание. Введение …………………………..3 Теоретическая часть ………….….5 1.Кристаллы …………………..….…....5 2.Силикаты ………………………........6 3.Полупроницаемые пленки …………8 4.Явление осмоса. …………………….10 Экспериментальная часть …….….12 Заключение ………………………….16 Используемая литература ……….17 Приложение ………………………..18 Введение. Кристаллы . Многие думают, что это красивые, редко встречающиеся камни. Кристаллы. Сколько магического и волшебного они таят в себе. Как было не заинтересоваться такими красивыми, загадочными и самыми распространенными созданиями. Кристаллы окружают нас повсюду , но мы обычно этого не замечаем. Так я узнал, что можно вырастить причудливые „химические водоросли,“ которые по своей природе являются кристаллами Мне захотелось получить такие кристаллы, имея под рукой различные соли и немного канцелярского клея и конечно же необходимые теоретические знания. Актуальность темы: Заинтересовавшись вопросом многообразия кристаллов в природе, работая над проектом, мы попытались познакомиться с существующими методиками выращивания кристаллов в лабораторных условиях и внести в них свои коррективы, выяснив условия, влияющие на рост кристаллов. Цель работы: Вырастить кристаллы, в результате взаимодействия раствора силикатного клея и гексацианоферрата калия с солями различных металлов. Задачи исследовательской работы: Получить кристаллы в результате взаимодействия солей с силикатным клеем и гексацианоферратом калия. Выявить зависимость роста кристаллов от состава взятой соли Выяснить, как условия выращивания влияют на рост кристаллов. Гипотеза : можно вырастить кристаллы различной окраски и формы в результате взаимодействия растворов различных солей Объект исследования: физико-химические закономерности процесса кристаллизации Предмет исследования: кристаллы. Для решения поставленных задач в процессе исследования использовались следующие методы: Теоретический (изучение и анализ литературы, постановка целей и задач). Экспериментальный (постановка химических опытов). Эмпирический (наблюдения, описания и объяснения результатов эксперимента). Практическая значимость заключается в систематизации сведений о способах выращивания кристаллов. Оборудование и реактивы: весы, химическая посуда (стаканчики, воронки, колбы), штативы, дистиллированная вода, соли (хлориды различных металлов), стеклянные палочки, силикатный клей и желтая кровяная соль. Теоретическая часть 1 Кристаллы. Кристаллом (от греч. krystallos – «прозрачный лед») вначале называли прозрачный кварц (горный хрусталь) встречавшийся в Альпах. Горный хрусталь принимали за лед, затвердевший от холода до такой степени, что он уже не плавится. Первоначально главную особенность кристалла видели в его прозрачности, и это слово употребляли в применении ко всем прозрачным природным твердым телам[1] . Позднее стали изготавливать стекло, не уступавшее в блеске и прозрачности природным веществам. Предметы из такого стекла тоже называли «кристальными». Еще и сегодня стекло особой прозрачности называется хрустальным, «магический» шар гадалок – хрустальным шаром. Удивительной особенностью горного хрусталя и многих других прозрачных минералов являются их гладкие плоские грани. В конце 17 в. было подмечено, что имеется определенная симметрия в их расположении. Было установлено также, что некоторые непрозрачные минералы также имеют естественную правильную огранку и что форма огранки характерна для того или иного минерала. Возникла догадка, что форма может быть связана с внутренним строением. В конце концов, кристаллами стали называть все твердые вещества, имеющие природную плоскую огранку. Заметной вехой в истории кристаллографии явилась книга, написанная в 1784 французским аббатом Р.Гаюи. Он выдвинул предположение, что кристаллы возникают в результате правильной укладки крохотных одинаковых частиц, которые он назвал «молекулярными блоками». Гаюи показал, каким образом можно получить гладкие плоские грани кальцита, укладывая такие «кирпичики». Различия в форме разных веществ он объяснил разницей, как в форме «кирпичиков», так и в способе их укладки. Со времен Гаюи было принято как гипотеза, что в правильной форме кристалла находит отражение, упорядоченное внутреннее расположение частиц, но это было подтверждено лишь в 1912 после открытия рентгеновских лучей[2]. Сегодня кристаллы окружают нас повсюду. Мы ходим по кристаллам, строим из кристаллов, обрабатываем кристаллы на заводах, выращиваем их в лабораториях, широко применяем в технике и науке, едим кристаллы, лечимся ими. Почти все твердые тела относятся к кристаллам. Обычно мы этого не замечаем. Мы редко находим тела в природе в виде отдельных одиночных кристаллов (или, как говорят монокристаллов). Чаще всего вещество встречается в виде прочно сцепившихся мельчайших кристаллических зернышек. Каждое из этих зернышек менее тысячной доли миллиметра. Такую структуру можно увидеть только в микроскоп. Тела, состоящие из кристаллических зернышек, называются поликристаллическими (поли - много). Их, конечно тоже надо отнести к числу кристаллов. Тогда оказывается, что почти все окружающие нас тела – кристаллы. Песок, гранит, медь, железо и сухие краски – все это кристаллы. Есть, однако, и исключения: стекло, и пластмассы не состоят из кристаллов. Такие твердые тала называют аморфными[3]. 2. Силикаты. Силикатами являются все соли кремневой кислоты. Большинство силикатов не растворимые в воде, лишь силикаты щелочных металлов образуют с водой вязкие растворы под названием жидкое стекло[8]. Природные силикаты образуются в основном из расплавленной магмы. Предполагается, что при затвердевании магмы из нее сначала выкристаллизовывались силикаты, более бедные кремнеземом -ортосиликаты, затем после израсходования катионов выделялись силикаты с высоким содержанием кремнезема - полевые шпаты, слюды и, наконец, чистый кремнезем [7]. Силикаты - сложные кремнекислородные соединения в виде минералов и горных пород, занимают определяющее место в составе земной коры (80% по В.И.Вернадскому). А если добавить природный оксид кремния - кварц, то кремнекислородные соединения образуют более 90% массы земной коры и практически полностью слагают объем Земли. Силикатные минералы являются породообразующими: такие горные породы, как гранит, базальт, кварцит, песчаник, полевой шрат, глина, слюда и другие, сложены силикатными и алюмосиликатными минералами. Абсолютное большинство силикатных минералов является твердыми кристаллическими телами, и только незначительное количество минералов находится в аморфном состоянии (халцедон, опал, агат и др.) или в коллоидно-дисперсном состоянии: глины, цеолиты, палыгорскит и др. Состав и строение главных породообразующих минералов определяют их свойства. Многочисленные силикатные минералы и породы широко используются как сырьевые материалы в различных технологических производствах, например, в высокотемпературных процессах (обжиг, спекание, плавление). При производстве: цемента, стекол огнеупоров, керамических изделий фарфора каменных материалов Некоторые силикаты используется без обжига в качестве: 1) адсорбентов для очистки газов и вод (бентонитовые глины, цеолиты); 2) компонента буровых растворов (бентонитовые высокодисперсные глины); 3) наполнителя при производстве бумаги, резины (каолины, тальк); 4) драгоценных камней (изумруд, топаз, цветные турмалины, хризотил голубые аквамарины и др.). Силикаты в сочетании с другими добавками находят широкое применение при производстве керамических полупроницаемых перегородок. Силикатные руды и минералы используют для добычи металлов, их оксидов и солей. Большое значение имеют искусственно изготовленные силикаты, применяющиеся с глубокой древности и играющие в современной технике важную роль. Из них, прежде всего, нужно указать стекло. 3. Полупроницаемые пленки. Полупроницаемой мембраной называется плёнка, пропускающая молекулы растворителя и не пропускающая молекулы растворённого вещества. Такую мембрану можно вырастить самому. Для этого в раствор медного купороса нужно бросить кристаллик жёлтой кровяной соли. Кристаллик должен быть чистым - лучше всего его отколоть от большого кристалла перед самым опытом. В результате поверхность кристаллика покрывается полупроницаемой мембраной. Вода проникает через неё и вызывает рост "клетки". Оболочка "клетки" расширяется, а в тех местах, где плёнка лопается под действием внутреннего давления, сразу же снова образуется полупроницаемая оболочка. Так происходит снова и снова. Таким образом "клетка" постепенно принимает ветвистую форму. Этот классический опыт требует терпения и аккуратности, красивые "растения" с первой попытки могут и не получиться. Процессы разделения жидких систем играют важную роль во многих отраслях народного хозяйства. Для осуществления этих процессов уже давно применяют разнообразные способы: перегонку и ректификацию, абсорбцию и адсорбцию, экстракцию и др. Однако природа за миллионы лет эволюции живых организмов выработала наиболее универсальный и совершенный метод разделения с использованием полупроницаемых мембран. Действительно, биологические мембраны обеспечивают направленный перенос необходимых организму веществ из внешней среды в клетку, и наоборот. Без мембран невозможны были бы дыхание, кроветворение, синтез белка, усвоение пищи, удаление отходов и другие процессы [13]. К основным мембранным методам разделения жидких систем относятся: обратный осмос, ультрафильтрация, диализ, электродиализ. В любом из этих процессов разделяемый раствор вводится в соприкосновение с полупроницаемой мембраной с одной её стороны. Вследствие особых свойств полупроницаемых мембран прошедшая через них смесь обогащается одним из компонентов. В ряде случаев процесс проходит настолько полно, что продукт практически не содержит примесей, задерживаемых мембраной. И наоборот, применяя тот или иной мембранный метод разделения, можно получить в растворе перед мембраной компонент или компоненты практически без примесей вещества, проходящего через мембрану. Существует большое число разнообразных мембран. Полупроницаемые мембраны изготовляют из различных полимерных материалов, пористого стекла, графитов, металлической фольги и др. от материала мембраны зависят ее свойства (химическая стойкость, прочность), а также в значительной степени ее структура. Полимерные мембраны. Полимерные мембраны могут быть пористыми и непористыми (понятие “непористые мембраны” условно, поскольку они могут иметь поры размером 0,5 – 1 мм). Керамические мембраны. В последние годы успешно развивается направление с использованием керамических мембран. Полученные мембраны (одно-, семи- и девятнадцатиканальные) состоят из подложки на основе оксидов алюминия (с размерами пор 10 – 15 мкм и общей пористостью приблизительно 45%) и селективного слоя. Преимущества керамических мембран: высокая рабочая температура – 10000С и выше, высокая механическая прочность и долговечность, стойкость к химически агрессивным средам. Жидкие мембраны. Под жидкими мембранами понимают мембраны с жидкостью, иммобилизованной внутри пор микропористой подложки. Если мембрана смачивается жидкостью, то последняя может удерживаться в порах за счет капиллярных сил. Давление, необходимое для вытеснения жидкости из пор, называется капиллярным давлением и изменяется обратно пропорционально диаметру пор, поэтому при достаточно малых порах жидкость удерживается на подложке при разнице давлений под и над мембраной в несколько атмосфер. Используются жидкие мембраны двух типов. К первому типу относятся пассивные жидкие мембраны, в которых обычные жидкости, имеющие большую проницаемость по целевому компоненту, наносятся на мембранную подложку. Второй тип жидких мембран – мембраны с активным транспортом целевого компонента. В этом случае в качестве жидкости используются специфические переносчики целевого компонента, растворенные в соответствующем растворителе [12]. 4. Явление осмоса. Осмос - (от греч. "толчок", "давление"), односторонняя диффузия растворителя через полупроницаемую перегородку (мембрану), обусловленная стремлением системы к термодинамическому равновесию и выравниванию концентрации растворов по обе стороны мембраны. Характеризуется осмотическим давлением. В 1748 году французский физик-экспериментатор Ж. А. Нолле, занимаясь изучением кипения жидкостей, столкнулся с неизвестным до тех пор явлением. В одном из своих опытов он герметично закрыл стакан со спиртом плёнкой бычьего пузыря и погрузил его на дно большого сосуда с водой. Через несколько часов пузырь сильно раздулся - вода проникла в стакан и увеличила давление в нём. Нолле не прошёл мимо этого удивительного факта и объяснил его следующим образом: "Животный пузырь может быть более проницаем для воды, чем для спирта; в таком случае скорость прохождения воды окажется больше скорости прохождения спирта". 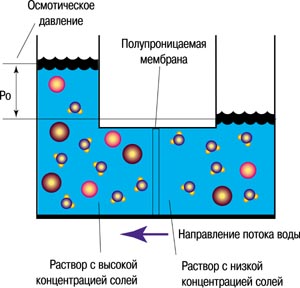 Если разделить раствор и чистый полупроницаемой перегородкой –то она будет пропускать молекулы растворителя, но не будет пропускать молекулы растворённого вещества. Выравнивание концентраций будет происходить только за счёт односторонней диффузии растворителя. Молекулы растворителя будут перемещаться через мембрану из менее концентрированного раствора в более концентрированный, вызывая в последнем повышение уровня жидкости. Другими словами можно сказать, что растворитель проникает в раствор под действием сил так называемого осмотического давления. Как только гидростатическое давление столба уравновесит осмотическое давление, процесс прекратится[13]. Экспериментальная часть Методика выполнения эксперимента. Целью нашей работы явилось изучение процесса роста «химических водорослей» Задачи работы: Освоение методики проведения эксперимента. Изучение влияния анионов исходных солей на скорость роста «химических водорослей» Изучение механизма роста «химических водорослей» Выращивание химических водорослей мы производили по следующей схеме. Приготовление рабочего раствора. Согласно изученным методикам для выращивания “химических водорослей„ необходим 50% раствор силиката натрия, но в случае его отсутствия предлагается использовать обычный канцелярский клей, разведенный водой 1:1 [10,11,]. Для выбора оптимального раствора для выращивания водорослей мы провели ряд экспериментов разбавляя клей водой в соотношении клей вода : 1:1, 2:1 ,. лучше всего водоросли росли в соотношении клея и воды 2:1, поэтому мы выбрали это разбавление. Физико-химический состав используемого канцелярского клея представлен в приложении. Выбор исследуемого объекта. Химических солей существует огромное множество. Для получения “химических водорослей„ необходимо, чтобы продукт взаимодействия (силикат) не растворялся в воде, а исходная соль в воде растворялась. На основании таблицы растворимости мы выбрали следующие объекты (таблица№1 приложение). Для исследования использовались те объекты, которые мы смогли найти в лаборатории (они обозначены +). Наилучшие из “химических водорослей„ представлены в приложении. Опыт №1. Коллоидный сад или «силикатные водоросли В пробирки налили по 5 мл силикатного клея, разбавив его водой в соотношение 1:1. В каждую пробирку добавили по 0,1 г солей меди, железа, никеля и алюминия. Наблюдали рост «химических водорослей», которые состоят из нерастворимых силикатов металлов и напоминают настоящие нитчатые водоросли. Цвет водорослей зависит от металла. Через 15-20 минут в стакане появятся «заросли», напоминающие деревья или водоросли. Из кристалла опущенной соли вытягивается тоненькая полая трубочка, стенки которой состоят из образующегося осадка. Трубочка представляет собой полупроницаемую мембрану, через которую вода поникает во внутрь. Наблюдается осмос- одностороннее перемещение вещества через полупроницаемую мембрану. В результате этого в некоторых местах трубочка рвется. Вновь образуется осадок.  Брошенные в раствор канцелярского клея кристаллики соли реагируют с силикатом натрия. Образовавшиеся соединения покрывают кристаллы тонкой полупроницаемой пленкой. Толщина таких пленок обычно от1мкм до 1мм [12] В силу диффузии вода проникает сквозь нее, давление в кристалле повышается, что приводит к разрыву пленки. В тех местах, где произошел разрыв, соляной раствор выливается в окружающую жидкость. Снова образуется полупроницаемая пленка. Так происходит снова и снова. И на наших глазах вырастают «химические водоросли» Из имеющихся в лаборатории солей были выращены «химические водоросли» Таблица №2 Используемые соли были разделены на группы по катиону. Из анализа наблюдений за ростом “химических водорослей„ были получены следующие результаты. Соли содержащие в качестве аниона Cl- росли быстрее, чем соли содержащие SO42- и NO3- (исключение соли никеля). Это объясняется тем, что растворимость хлоридов в воде выше, чем растворимость сульфатов и нитратов [9].( таб.№3.приложения) Соли в порядке возрастания их скорости роста можно записать в ряд: Cl-, NO3- , SO42 . Таблица №2 Характеристика «Химических водорослей»
Таким образом, можно сделать следующие выводы. Выводы. Рост “химических водорослей„ обусловлен взаимодействием исходной соли с силикатом натрия. Движущей силой при росте “химических водорослей„ является явление осмоса. Анионы исходных солей оказывают влияние на скорость роста “химических водорослей„ По скорости роста соли можно записать в ряд: Cl-, NO3- , SO42. ЗАКЛЮЧЕНИЕ В химии есть много занимательных опытов. Выращивание кристаллов—очень интересное занятие. Смотришь, вроде нет ничего, и вот спустя несколько минут появляются иглы, затем начинают ветвиться, а через 10- 15 минут в сосуде вырастают целые деревца. Хочется создавать все новое и новое. Созданные формы привлекательны с эстетической точки зрения. Производя наблюдения за процессом роста кристаллов, мы пришли к следующим выводам: Кристаллы разного цвета можно выращивать из раствора силикатного клея и желтой кровяной соли с солями разных металлов. Кристаллы разной формы можно получить, меняя температуру и концентрацию раствора силикатного клея, создавая тем самым оптимальные для роста условия Для получения ярких кристаллов, необходимо использовать соли тяжелых металлов . Возможно, наше исследование поможет в приобретении необходимых навыков для получения замечательных кристаллических тел. Мы желаем всем поближе познакомиться с удивительным и прекрасным миром кристаллов. Исследовав свойства кристаллов, мы пришли к выводу: кристаллы – это не только чудо природы. Это чудо можно сотворить своими руками и управлять этим процессом. Изучив влияние различных условий на рост кристаллов, человек может управлять процессом кристаллизации, получая при этом кристаллы с необходимыми свойствами, возможно, будущее новейших технологий принадлежит кристаллам и кристаллическим агрегатам. Чешский писатель К. Чапек, восхищаясь природными формами кристаллов, писал: «…Число и фантазия, закон и изобилие – вот живые творческие силы природы; не сидеть под земным деревом, а создавать кристаллы и идеи, вот, что значит быть воедино с природой!» Используемая литература. 1.Аликберова Л.Ю. Занимательная химия. М.: АСТ-Пресс,1999-с147. 2. Энциклопедия Кругосвет. 2004. 3. Вещество и энергия /Детская энциклопедия. т.3. М.: Академия педагогических наук РСФСР, с365 4. Словарь юного физика. М.: Педагогика Пресс,1997,-с.126. 5. Петров Т.Г. и др. Выращивание кристаллов из растворов. Л.: Недра,1983. 6. Дорфман В.Ф. Мысль, заключенная в кристалле. М.: Знание,1988. 7. Лучинский Г.П. Синилина В.И. Курс химии. М.: Высшая школа, 1972- с 198. 8. Сатбалдина С.Т. Химия 8-9 класс. М.: Просещение,2000. 9. Лурье Ю.Ю. Справочник по аналитической химии. М.:Химия, 1988 10. Шкурка Д. Забавная химия. Л.: Детская литература,1976. 11. Макарова Л.Л. Санникова Т.Г. Демонстрационный эксперимент по химии. Иж.: Уд ГУ,1996-С 33. 12. Физический энциклопедический словарь. М.: Советская энциклопедия, 1983,-с.405. 13. Шамшин Д.Л. Физическая и коллоидная химия. М.: Выс Приложение. Силикатный клей "жидкое натриевое стекло" ГОСТ 13078-81 Краткие физико-химические показатели:
Таблица №1. Исходные соли.
Таблица №3. Растворимость солей в воде при 20оС
|
