катализ. Катализ. T минимальная температура, при которой процесс начинает протекать с достаточной для технологических целей скоростью. Активность
 Скачать 359.14 Kb. Скачать 359.14 Kb.
|
|
Катализ - химическое явление, суть которого заключается в изменении скоростей химических реакций при действии некоторых веществ (их называют катализаторами). Температура зажигания катализатора T₃ - минимальная температура, при которой процесс начинает протекать с достаточной для технологических целей скоростью. Активность катализатора, или каталитическая активность, — характеристика катализатора, выражающая его свойство ускорять химическую реакцию. Чем выше активность катализатора, тем большей скорости химической реакции можно с помощью данного катализатора добиться. Важным свойством катализаторов является их отравляемость, т.е. потеря активности под действием посторонних примесей в реакционной смеси, называемых каталитическими ядами. К наиболее типичным ядам относятся соединения серы: H2S, СS2, меркаптаны и другие, окись, углерода, соединения мышьяка, свинца и др. Селективность является одной из основных характеристик катализатора, она определяется как способность катализатора избирательно увеличивать скорость одной из реакций (целевой реакции) при наличии нескольких побочных. Ингиби́тор — общее название веществ, подавляющих или задерживающих течение физиологических и физико-химических (главным образом ферментативных) процессов гемолитический катализ, когда химическое взаимодействие протекает по гомолитическому механизму; гетеролитический катализ — в случае гетеролитической природы промежуточного взаимодействия; По гомолитическому, преимущественно так называемому электронному катализу протекают реакции окислительно-восстановительного типа (такой катализ поэтому часто называют окислительно-восстановительным): гидрирования, дегидрирования, гидрогенолиза гетероорганических соединений нефти, окисления и восстановления в производстве элементной серы, паровой конверсии углеводородов в производстве водорода, гидрирования окиси углерода до метана и др. Гетеролитический, или так называемый ионный, катализ, имеет место в каталитических реакциях крекинга, изомеризации, циклизации, алкилирования, деалкилирования, полимеризации углеводородов, дегидратации спиртов, гидратации олефинов, гидролиза и многих других химических и нефтехимических процессах. это ускорение химических реакций в биологических системах специальными белками - ферментами. Микрогетерогенный катализ – катализ на макромолекулах или коллоидных частицах (10-5 – 10-7 см), которые имеют огромную удельную поверхность с большим числом активных центров, чем обеспечивается исключительно высокая активность таких катализаторов. Например, коллоидные растворы Pt и Pd проявляют очень высокую активность при пониженных температурах (способствуют энергичному разложению перекиси водорода при концентрации катализатора 10-8 г/л) отрицательный катализ называют ингибированием. Отрицательный катализ встречается, например, в цепных реакциях, когда катализатор вступает в промежуточное взаимодействие с активными частицами, что приводит к обрыву цепей. Замедление реакций Б присутствии некоторых веществ часто не связано с катализом. Например, при замедлении химического растворения металлов в присутствии поверхностно-активных веществ проявляется защитное действие адсорбционной пленки этого вещества. катализ химической реакции одним из её продуктов или исходных веществ. Одним из наиболее широко известных примеров автокатализа является окисление щавелевой кислоты перманганатом: 2MnO4− + 5C2O42− + 16H+ = 2Mn2+ + 10CO2 + 8H2O Катализатором этой реакции являются ионы Mn2+. При комнатной температуре эта реакция вначале протекает медленно, но по мере накопления в растворе продукта-катализатора, она ускоряется. ИНИЦИАТОРЫ РАДИКАЛЬНЫЕ (от позднелат. initiator -зачинатель), в-ва, способные зарождать (инициировать) цепные радикальные процессы в результате распада или др. хим. р-ций образования радикалов свободных. К таким процессам относятся, напр., радикальная полимеризация, окисление орг. соединений, радикально-цепное хлорирование и сульфохлорирование, теломеризация, структурирование полимеров. 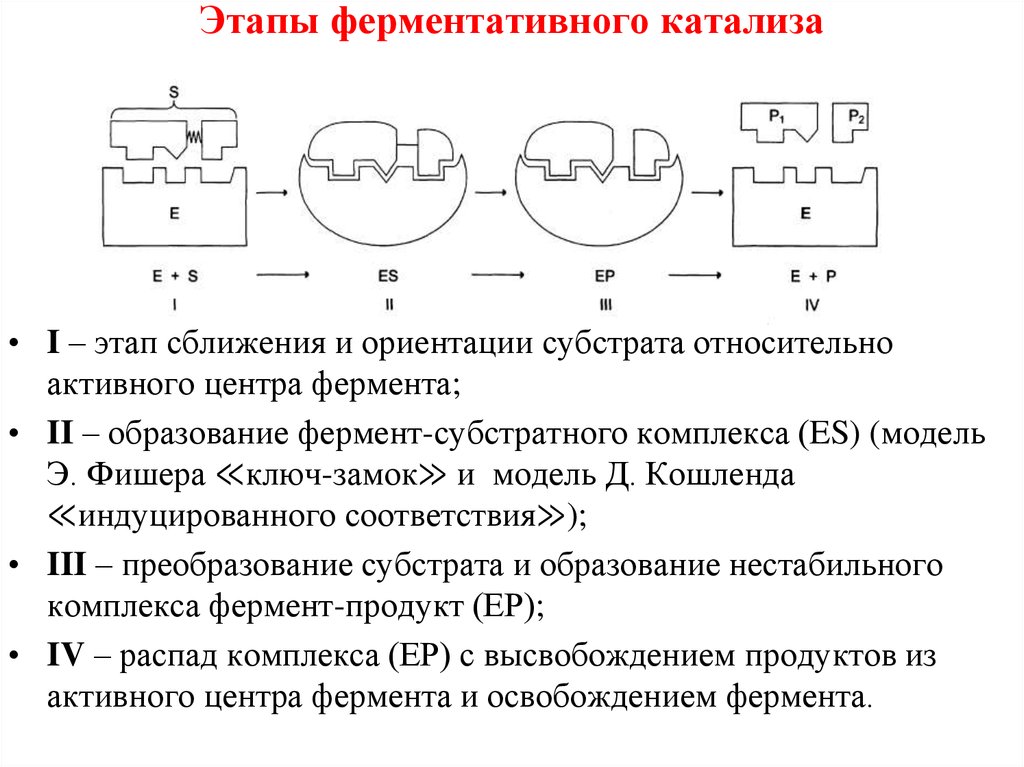    Производительность катализатора – масса (объем) целевого. продукта, снимаемого с единицы объема (массы) катализатора в единицу времени Дезактивация катализатора - это снижение его активности и селективности в ходе каталитической реакции. Активаторы или промоторы – вещества, повышающие активность основного катализатора. Активация может происходить вследствие химического взаимодействия добавок с каталитическим веществом с образованием продуктов, обладающих повышенной каталитической активностью. Добавки могут образовывать с катализатором твердые растворы с электронной структурой, соответствующей большей каталитической активности. Иногда активатор увеличивает поверхность каталитически активного вещества или повышает термостойкость катализатора, а иногда служит защитой основного катализатора от действия контактных ядов. Промышленные твердые катализаторы обычно не являются индивидуальными веществами. Они представляют собой сложную смесь, называемую контактной массой. В контактной массе одни вещества являются собственно катализаторами, другие – носителями, а третьи служат активаторами. Носители – термостойкие, прочные, инертные, пористые вещества, на которые осаждением или другими способами наносят катализатор. Нанесение каталитических веществ на пористый носитель обеспечивает их тонкое диспергирование, создание большую удельную поверхность при оптимальных размерах пор и повышает термостойкость катализатора, так как затруднено спекание его кристаллов, разобщенных на поверхности носителя. Кроме того, достигается экономия дорогих каталитических веществ, таких, как платина, палладий, серебро и др. Носитель обычно влияет и на активность катализатора, действуя как активатор. В качестве носителя чаще всего применяют оксид алюминия, силикагель, синтетические алюмосиликаты, асбест, различные соли, активный уголь. Каталитические яды, или контактные яды — вещества, вызывающие «отравление» катализатора, то есть снижающие его каталитическую активность или полностью прекращающие каталитическое действие. Причина отравления заключается в адсорбции каталитического яда на поверхности катализатора. Различают следующие виды каталитического отравления: — Каталитический яд может адсорбироваться на активном центре катализатора, препятствуя взаимодействию реагентов с этим активным центром. В данном случае наблюдается линейная зависимость снижения каталитической активности от количества введенного в систему яда. Пример: действие хинолина на алюмосиликатные катализаторы при крекинге. — Экранирование — яд может сильно отравить поверхность катализатора, что приведет к резкому снижению каталитической активности. В этом случае введение дополнительных доз яда будет снижать активность медленно. Пример: разложение пероксида водорода на платиновом катализаторе при адсорбции яда — дихлорида ртути. https://vuzlit.ru/729713/apparaturnoe_oformlenie_kataliticheskih_protsessov https://vuzlit.ru/729713/apparaturnoe_oformlenie_kataliticheskih_protsessov |
