Билеты теплофизика. билеты по теплофизике. Техническая термодинамика цели и задачи. Основные понятия и определения рабочее тело, термодинамическая система (тдс), виды тдс
 Скачать 1.23 Mb. Скачать 1.23 Mb.
|
|
Техническая термодинамика: цели и задачи. Основные понятия и определения: рабочее тело, термодинамическая система (ТДС), виды ТДС. Термодинамика изучает законы превращения энергии в различных процессах, происходящих в макроскопических системах и сопровождающихся тепловыми эффектами. Макроскопическая система – любой материальный объект, состоящий из большого числа частиц. Техническая термодинамика – изучает закономерности взаимного превращения тепловой и механической энергии и свойства тел, участвующих в этих превращениях. ТДС – представляет собой совокупность материальных тел находящихся в мех-ом и тепловом взаимодействии друг с другом и с внешней средой. В самом общем случае ТДС может обмениваться со средой и веществом, такая ТДС называется открытой. ТДС которая не может обмениваться с окружающей средой, называют теплоизолированной или адиабатной. ТДС не обменивающаяся с внешней средой ни теплом, ни веществом, называется изолированной. Простейшей ТДС является рабочее тело, осуществляющее взаимное превращение теплоты и работы. Основные параметры состояния: температура Температурой называется физическая величина, характеризующая степень нагретости тела. Понятие о температуре вытекает из следующего утверждения: если две системы находятся в тепловом контакте, то в случае неравенства их температур они будут обмениваться теплотой друг с другом, если же их температуры равны, то теплообмена не будет. С точки зрения молекулярно-кинетических представлений температура есть мера интенсивности теплового движения молекул. Ее численное значение связано с величиной средней кинетической энергии молекул вещества: где k— постоянная Больцмана, равная 1,380662•10ˉ23 Дж/К. Температура T, определенная таким образом, называется абсолютной. В системе СИ единицей температуры является кельвин (К); на практике широко применяется градус Цельсия (°С). Соотношение между абсолютной Т и стоградусной Iтемпературами имеет вид В промышленных и лабораторных условиях температуру измеряют с помощью жидкостных термометров, пирометров, термопар и других приборов. 3. Основные параметры состояния: давление. Давление обусловлено взаимодействием молекул рабочего тела с поверхностью и численно равно силе, действующей на единицу площади поверхности тела по нормали к последней. В соответствии с молекулярно-кинетической теорией давление газа определяется соотношением где n — число молекул в единице объема; т — масса молекулы; с2— средняя квадратическая скорость поступательного движения молекул. В Международной системе единиц (СИ) давление выражается в паскалях (1 Па=1 Н/м2). Поскольку эта единица мала, удобнее использовать 1 кПа = 1000 Па и 1 МПа=106 Па. Давление измеряется при помощи манометров, барометров и вакуумметров. Жидкостные и пружинные манометры измеряют избыточное давление, представляющее собой разность между полным или абсолютным давлением р измеряемой среды и атмосферным давлением pатм, т.е. Приборы для измерения давлений ниже атмосферного называются вакуумметрами; их показания дают значение разрежения (или вакуума): Следует отметить, что параметром состояния является абсолютное давление. Именно оно входит в термодинамические уравнения. 4.Основные параметры состояния: объем. Удельныйобъемv— это объем единицы массы вещества. Если однородное тело массой М занимает объем v, то по определению v= V/М. В системе СИ единица удельного объема 1 м3/кг. Между удельным объемом вещества и его плотность существует очевидное соотношение: Для сравнения величин, характеризующих системы в одинаковых состояниях, вводится понятие «нормальные физические условия»: p=760 мм рт.ст.= 101,325 кПа; T=273,15 K. В разных отраслях техники и разных странах вводят свои, несколько отличные от приведенных «нормальные условия», например, «технические» ( p= 735,6 мм рт.ст.= 98 кПа , t=15˚C) или нормальные условия для оценки производительности компрессоров (p=101,325 кПа, t=20˚С ) и т. д. Если все термодинамические параметры постоянны во времени и одинаковы во всех точках системы, то такое состояние системы называется равновесным. Если между различными точками в системе существуют разности температур, давлений и других параметров, то она является неравновесной. В такой системе под действием градиентов параметров возникают потоки теплоты, вещества и другие, стремящиеся вернуть ее в состояние равновесия. Опыт показывает, что изолированная система с течением времени всегда приходит в состояние равновесия и никогда самопроизвольно выйти из него не может. В классической термодинамике рассматриваются только равновесные системы. 5.Термодинамические процессы: равновесные, неравновесные, обратные, прямые, обратимые, необратимые, замкнутые. Изменение состояния термодинамической системы во времени называется термодинамическим процессом. Так, при перемещении поршня в цилиндре объём, а с ним давление и температура находящегося внутри газа будут изменяться, будет совершаться процесс расширения или сжатия газа. Термодинамический процесс называется равновесным, если все параметры системы при его протекании меняются достаточно медленно по сравнению с соответствующим процессом релаксации. В этом случае система фактически все время находится в состоянии равновесия с окружающей средой, чем и определяется название процесса. Чтобы процесс был равновесным, скорость изменения параметров системы где А — параметр, наиболее быстро изменяющийся в рассматриваемом процессе; срел — скорость изменения этого параметра в релаксационном процессе; τрел — время релаксации. Рассмотрим, например, процесс сжатия газа в цилиндре. Если время смещения поршня от одного положения до другого существенно превышает время релаксации, то в процессе перемещения поршня давление и температура успеют выровняться по всему объему цилиндра. Это выравнивание обеспечивается непрерывным столкновением молекул, в результате чего подводимая от поршня к газу энергия достаточно быстро и равномерно распределяется между ними. Если последующие смещения поршня будут происходить аналогичным образом, то состояние системы в каждый момент времени будет практически равновесным. Таким образом, равновесный процесс состоит из непрерывного ряда последовательных состояний равновесия, поэтому в каждой его точке состояние термодинамической системы можно описать уравнением состояния данного рабочего тела. Именно поэтому классическая термодинамика в своих исследованиях оперирует только равновесными процессами. Они являются удобной идеализацией реальных процессов, позволяющей во многих случаях существенно упростить решение задачи. Такая идеализация вполне обоснована, так как условие (1.8) выполняется на практике достаточно часто. Поскольку механические возмущения распространяются в газах со скоростью звука, процесс сжатия газа и цилиндре будет равновесным, если скорость перемещения поршня много меньше скорости звука. Процессы, не удовлетворяющие условию Последовательный ряд термодинамических процессов, в которых рабочее тело изменяет свое состояние и в результате возвращается в первоначальное состояние, называется круговым процессом, или циклом. Циклы могут быть обратимыми, состоящими из обратимых процессов, и необратимыми. Циклы подразделяются также на прямые и обратные. Прямыми называются циклы, в которых теплота преобразуется в работу, обратными — те, в которых теплота передается от более холодного тела к более нагретому. Прямые циклы в диаграммах изображаются по часовой стрелке (по таким циклам работают все тепловые двигатели), обратные — против часовой стрелки (по таким циклам работают холодильные машины). 6. Понятие идеального газа. Идеальным называется газ, у которого объемы молекул бесконечно малы и отсутствуют силы молекулярного взаимодействия. Молекулы идеального газа представляют собой материальные точки, взаимодействие между которыми ограничено молекулярными соударениями. Любой реальный газ тем ближе к идеальному, чем ниже его давление и выше температура. Например, окружающий нас воздух можно считать идеальным газом. Понятие идеального газа и законы идеальных газов полезны в качестве предела законов реального газа. На практике часто приходится иметь дело с газами при невысоких давлениях, поэтому расчеты различных термодинамических процессов с достаточной степенью точности можно проводить по уравнениям идеального газа. 7. Уравнение состояния идеального газа. Из уравнений Рассмотрим 1 кг газа. Учитывая, что в нем содержится N молекул и, следовательно, Постоянную величину Nk, отнесенную к 1 кг газа, обозначают буквой Rи называют газовойпостоянной. Поэтому Полученное соотношение представляет собой уравнение Клапейрона. Умножив (1.3) на М, получим уравнение состояния для произвольной массы газа М: Уравнению Клапейрона можно придать универсальную форму, если отнести газовую постоянную к 1 кмолю газа, т. е. к количеству газа, масса которого в килограммах численно равна молекулярной массе μ. Положив в (1.4) М=μ и V=V μ, получим для одного моля уравнение Клапейрона — Менделеева: Здесь В соответствии с законом Авогадро (1811г.) объем 1 кмоля, одинаковый в одних и тех же условиях для всех идеальных газов, при нормальных физических условиях равен 22,4136 м3, поэтому Газовая постоянная 1 кг газа составляет 8. Газовые смеси. Закон Дальтона. В инженерной практике часто приходится иметь дело с газообразными веществами, близкими по свойствам к идеальным газам и представляющими собой механическую смесь отдельных компонентов различных газов, химически не реагирующих между собой. Это так называемые газовые смеси. В качестве примера можно назвать продукты сгорания топлива в двигателях внутреннего сгорания, топках печей и паровых котлов, влажный воздух в сушильных установках и т. п. Основным законом, определяющим поведение газовой смеси, является закон Дальтона: полное давление смеси идеальных газов равно сумме парциальных давлений всех входящих в нее компонентов: 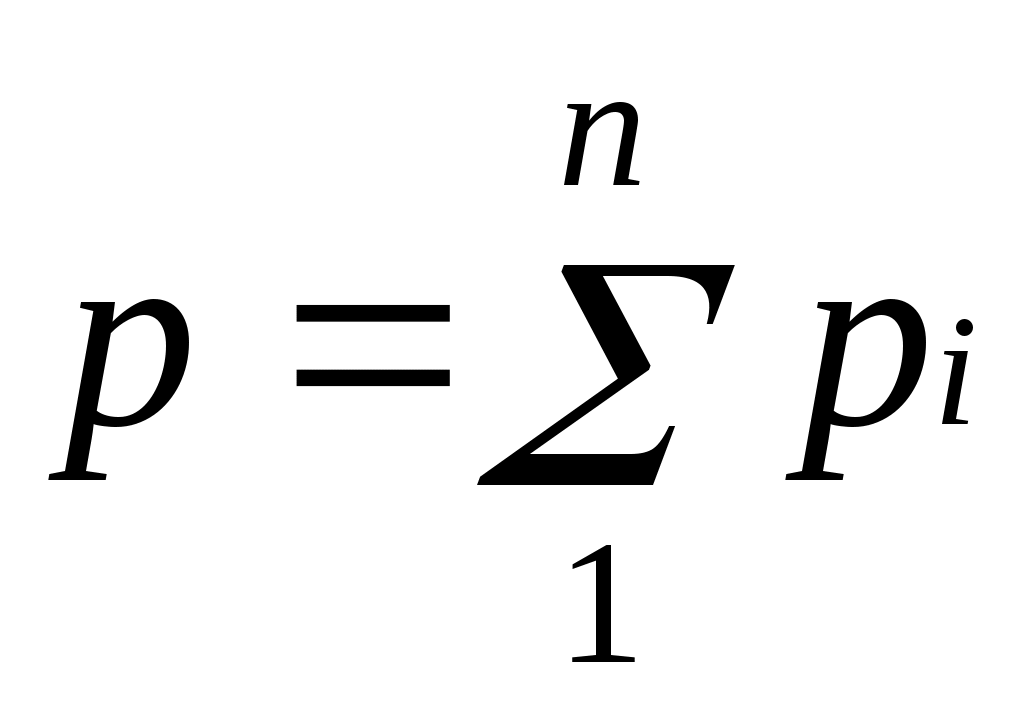 Парциальноедавление pi — давление, которое имел бы газ, если бы он один при той же температуре занимал весь объем смеси. 9. Способы задания состава газовых смесей. Состав газовой смеси может быть задан массовыми, объемными или мольными долями. Массовой долей называется отношение массы отдельного компонента Мi, к массе смеси М: Очевидно, что 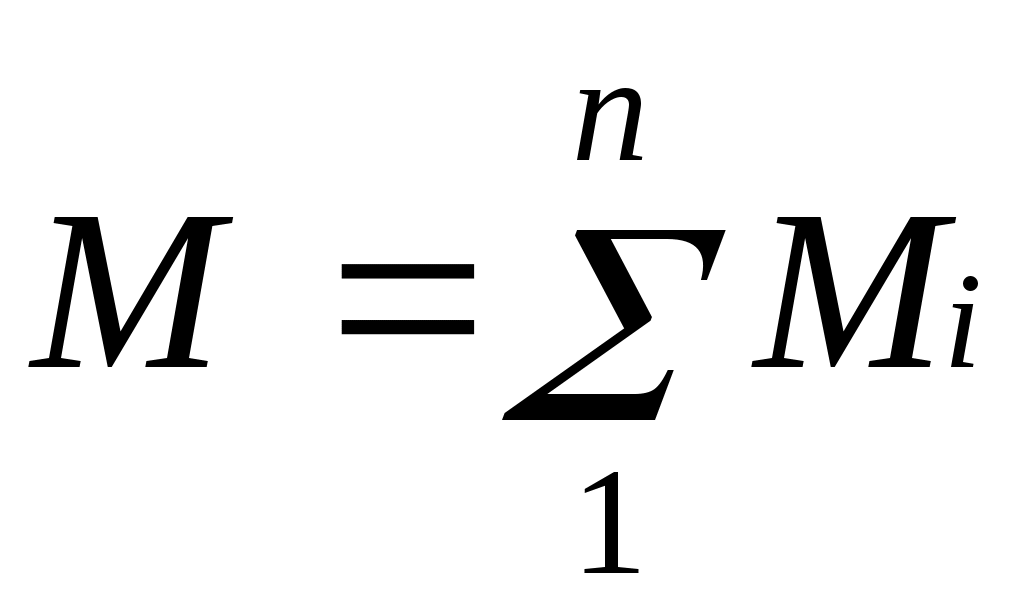 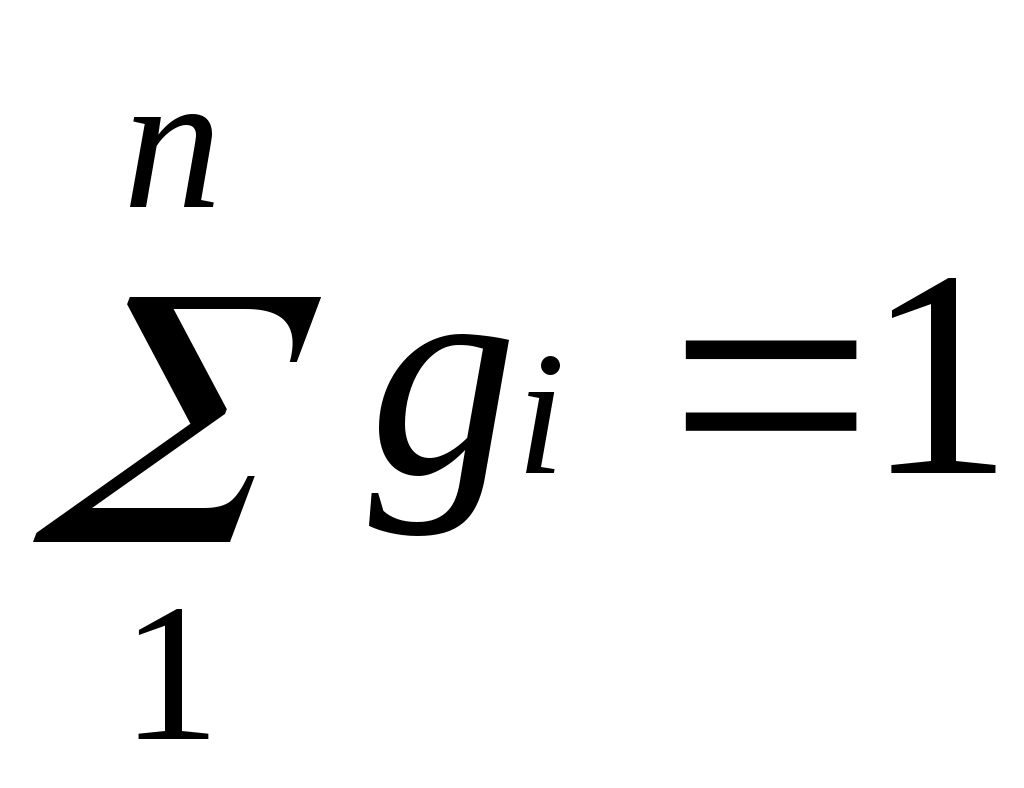 . .Массовые доли часто задаются в процентах. Например, для сухого воздуха Объемная доля представляет собой отношение приведенного объема газа V, к полному объему смеси V: Приведенным называется объем, который занимал бы компонент газа, если бы его давление и температура равнялись давлению и температуре смеси. Для вычисления приведенного объема запишем два уравнения состояния i-го компонента: Первое уравнение относится к состоянию компонента газа в Смеси, когда он имеет парциальное давление pi и занимает полный объем смеси, а второе уравнение — к приведенному состоянию, когда давление и температура компонента равны, как и для смеси, р и Т. Из уравнений следует, что Просуммировав соотношение (2.2) для всех компонентов смеси, получим с учетом закона Дальтона 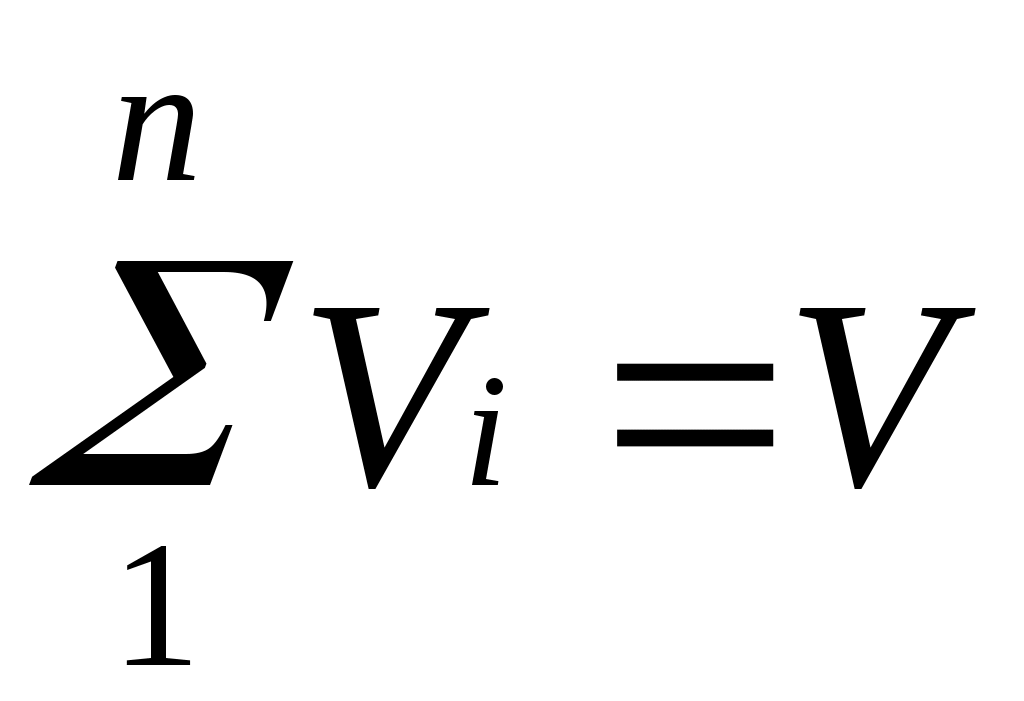 ,откуда ,откуда  . Объемные доли также часто задаются в процентах. Для воздуха . Объемные доли также часто задаются в процентах. Для воздуха Иногда бывает удобнее задать состав смеси мольными долями. Мольной долей называется отношение количества молей Ni рассматриваемого компонента к общему количеству молей смеси N. Пусть газовая смесь состоит из N1 молей первого компонента, N2 молей второго компонента и т. д. Число молей смеси  , а мольная доля компонента будет равна , а мольная доля компонента будет равна В соответствии с законом Авогадро объемы моля любого газа при одинаковых р и Т, в частности при температуре и давлении смеси, в идеально газовом состоянии одинаковы. Поэтому приведенный объем любого компонента может быть вычислен как произведение объема моля 10. Теплоемкость, определение, виды, уравнения связи. Отношение количества теплоты Обычно теплоемкость относят к единице количества вещества и в зависимости от выбранной единицы различают: удельную массовую теплоемкость c , отнесенную к 1 кг газа, Дж/(кг·К); удельнуюобъемную теплоемкость c´, отнесенную к количеству газа, содержащегося в 1 м3 объема при нормальных физических условиях, Дж/(м3·К); удельнуюмольнуютеплоемкость Зависимость между удельными теплоемкостями устанавливается очевидными соотношениями: Здесь Изменение температуры тела при одном и том же количестве сообщаемой теплоты зависит от характера происходящего при этом процесса, поэтому теплоемкость является функцией процесса. Это означает, что одно и то же рабочее тело в зависимости от процесса требует для своего нагревания на 1 К различного количества теплоты. Численно величина с изменяется в пределах от +∞ до -∞. В термодинамических расчетах большое значение имеют: теплоемкость при постоянном давлении равная отношению количества теплоты теплоемкость при постоянном объеме равная отношению количества теплоты , подведенной к телу в процессе при постоянном объеме, к изменению температуры тела . В соответствии с первым законом термодинамики для закрытых систем, в которых протекают равновесные процессы Для изохорного процесса (v=const) это уравнение принимает вид т. е. теплоемкость тела при постоянном объеме равна частной производной от его внутренней энергии по температуре и характеризует темп роста внутренней энергии в изохорном процессе с увеличением температуры. Для идеального газа Для изобарного процесса () из уравнения (2.16) и (2.14) получаем или Это уравнение показывает связь между теплоемкостями сри сv. Для идеального газа оно значительно упрощается. Действительно, внутренняя энергия идеального газа определяется только его температурой и не зависит от объема, поэтому Это соотношение называется уравнением Майера и является одним из основных в технической термодинамике идеальных газов. В процессе v=const теплота, сообщаемая газу, идет лишь на изменение его внутренней энергии, тогда как в процессе р = const теплота расходуется и на увеличение внутренней энергии и на совершение работы против внешних сил. Поэтому србольше сvна величину этой работы. Для реальных газов Числовое значение теплоемкости идеального газа позволяет найти классическая теория теплоемкости, основанная на теореме о равномерном распределении энергии по степеням свободы молекул. Согласно этой теореме внутренняя энергия идеального газа прямо пропорциональна числу степеней свободы молекул и энергии kТ/2, приходящейся на одну степень свободы. Для 1 моля газа где Nо — число Авогадро; i— число степеней свободы (число независимых координат, которые нужно задать для того, чтобы полностью определить положение молекулы в пространстве) . Поскольку для идеального газа . Теплоемкость реального газа зависит от давления, правда, очень слабо. Поскольку теплоемкость реального газа зависит от температуры, в термодинамике различают истинную и среднюю теплоемкости. Среднейтеплоемкостью сср данного процесса в интервале температур от t1 доt2 называется отношение количества теплоты, сообщаемой газу, к разности конечной и начальной температур: Выражение определяет теплоемкость при данной температуре или так называемую истиннуютеплоемкость. Из * следует, что  поэтому Для практических расчетов теплоемкости всех веществ сводят в таблицы, причем с целью сокращения объема таблиц средние теплоемкости приводят в них для интервала температур от 0 до t. 11. Внутренняя энергия. Внутренняя энергия системы включает в себя: кинетическую энергию поступательного, вращательного и колебательного движения частиц; потенциальную энергию взаимодействия частиц; энергию электронных оболочек атомов; внутриядерную энергию. В большинстве теплоэнергетических процессов две последние составляющие остаются неизменными. Поэтому в дальнейшем под внутренней энергией будем понимать энергию хаотического движения молекул и атомов, включающую энергию поступательного, вращательного и колебательного движений как молекулярного, так и внутримолекулярного, а также потенциальную энергию сил взаимодействия между молекулами. Кинетическая энергия молекул является функцией температуры, значение потенциальной энергии зависит от среднего расстояния между молекулами и, следовательно, от занимаемого газом объема V, т. е. является функцией V. Поэтому внутренняя энергия U есть функция состояния тела. Для сложной системы она определяется суммой энергий отдельных частей, т. е. обладает свойством аддитивности. Величина и=U/М, называемая удельнойвнутренней энергией (Дж/кг), представляет собой внутреннюю энергию единицы массы вещества. В дальнейшем для краткости будем называть величину и просто внутренней энергией. Поскольку внутренняя энергия есть функция состояния тела, то она может быть представлена в виде функции двух любых независимых параметров, определяющих это состояние: Ее изменение в термодинамическом процессе Внутренняя энергия идеального газа, в котором отсутствуют силы взаимодействия между молекулами, не зависит от объема газа или давления Для задач технической термодинамики важно не абсолютное значение внутренней энергии, а ее изменение в различных термодинамических процессах. Поэтому начало отсчета внутренней энергии может быть выбрано произвольно. Например, в соответствии с международным соглашением для воды за нуль принимается значение внутренней энергии при температуре 0,01 °С и давление 610,8 Па, а для идеальных газов — при 0 °С вне зависимости от давления. 12. Энтальпия. В термодинамике важную роль играет сумма внутренней энергии системы Uи произведения давления системы р на ее объем V, называемая энтальпией и обозначаемая Н: |
