Обогащение ПИ. Лекция №2. Технология обогащения медных и меднопиритных руд
 Скачать 46.15 Kb. Скачать 46.15 Kb.
|
|
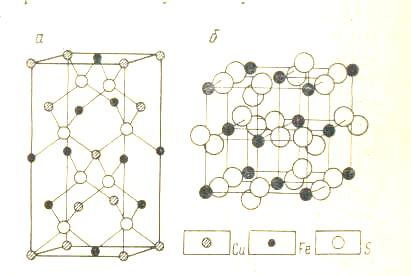
Лекция №2 Тема: Технология обогащения медных и медно-пиритных руд План учебного занятия: Основные свойства и области применения меди. Минералы и руды меди. Технические требования к концентратам. Ключевые слова: медь, минералы меди, кристаллическая решетка, химическая активность меди, плотность, области применение, 1. Медь — химический элемент первой группы Периодической системы Д. И. Менделеева с атомным номером 29, относительной атомной массой 63,546. Кристаллическая решетка — гранецентрированный куб с ребром 3,597-10-10 м. Имеет электронную структуру Is22s22p6 3s2 Зр6 3d104s1 и относится к s-элементам с числом свободных орбиталей 7 и числом валентных электронов 1. Присутствие на предпоследнем слое десяти (/-электронов и на внешней оболочке атома одного s-электрона обеспечивает наличие трех степеней окисления меди. Соединения трехвалентной меди, например Си2Оз, являются сильными окислителями. Медь образует ряд одновалентных соединений, однако для нее более характерно двухвалентное состояние. Атомный радиус меди 1,28 - 10-10 м, ионный радиус одновалентной меди 0,96-10-10 м, двухвалентной 0,8• 10-10 м. Плотность меди при 20 °С равна 8,96 г/см3. Температура плавления 1083°С, температура кипения 2600°С. Наиболее важными свойствами, обеспечившими меди широкое применение, являются ее высокая теплопроводность [394,279 Вт/(м-К) при 20 °С] и малое электрическое сопротивление (1,68-10-8 Ом.м при 20°С). Она является наилучшим проводником после серебра. Медь немагнитная, ее атомная магнитная восприимчивость равна 5,27 .10-6. Небольшие примеси фосфора, мышьяка, сурьмы и алюминия снижают ее теплопроводность, примеси висмута и свинца делают медь ломкой, а примесь серы — хрупкой на холоде. Многие элементы, образующие твердые смеси с медью, снижают ее электропроводность. Химическая активность меди слабая. При комнатной температуре в присутствии влаги и углекислого газа поверхность меди покрывается пленкой основного карбоната, который предохраняет ее от дальнейшего окисления. При нагревании до 375 °С медь на поверхности окисляется до СиО. При нагревании до 1100 °С в поверхностном слое образуется СиО, а во внутреннем — Си2О. Нормальный электродный потенциал меди для реакции Cu2++2e Cu равен +0,337 В, а для реакции Cu+e-Cu равен +0,52 В, поэтому она вытесняется из растворов более электроотрицательными элементами, например железом, что используется в процессе цементации меди из промышленных растворов. Медь входит в IV аналитическую группу (по классификации Н. А. Меншуткина) вместе с серебром, кадмием, ртутью, свинцом и висмутом и легкоосаждается сероводородом при рН 0,5 с образованием нерастворимых сульфидов. Так же как железо, кобальт, никель, медь -склонна к комплексообразованию, что имеет важное промышленное значение при получении аммиачных комплексов. Исключительные свойства меди — высокие электропроводность, теплопроводность и пластичность — обусловили ее широкое применение в технике. Около 50% добываемой меди используется в электротехнической промышленности для производства кабелей, проводов, шин и т. п. Из меди изготовляют детали холодильников, теплообменников, вакуумной аппаратуры. До 40% производимой меди используется в виде различных сплавов, основными из которых являются латунь и бронза. Значительная часть меди используется для получения сульфата меди, минеральных пигментов и удобрений, в качестве художественного материала. При общем производстве меди в США около 1800 тыс. т. вгод на производство латуни и бронзы расходуется около 700 тыс. т, чистой меди 350—400 тыс. т, алюминиевых и других сплавов 30 тыс. т, легированных чугунов и сталей около 3 тыс. т, различных химических соединений 5 тыс. т. Особенно бурное развитие получила медедобывающая промышленность с начала XX века. Если в 1900 г. было произведено около500 тыс. т меди, то в 1996 г. только рафинированной меди было произведено в капиталистических и развивающихся странах 6310 тыс. т. Основными поставщиками медного сырья и меди в капиталистических странах являются Замбия, Чили, Канада, Перу, а основными потребителями ее — США, Япония, ФРГ, Франция и Италия. Так, потребление меди составляет, тыс. т. в год: развивающимися странами 450—490; Японией более 800; Великобританией более 550; ФРГ 670; Францией 336. Как ожидается, потребление меди к 2017 г. будет возрастать ежегодно на 4—6%, при этом в США этот прирост составит 5,6%, Японии 9,8%, ФРГ 5,7% и Франции 5,2%. Предполагается, что количество добываемых медных руд при этом увеличится к 2000 г. в 4—5 раз по сравнению с 1970 г. 2. Из 170 известных в настоящее время медьсодержащих минералов в промышленных масштабах используется около 17, представленных, прежде всего сульфидными минералами меди – халькопиритом, борнитом, халькозином, ковеллином, тетраэдритом, теннантитом, энаргитом, а также, окисленными медными минералами – купритом, малахитом, азуритом, хризоколлой, брошантитом, и халькантитом. Таб.1.1. В качестве самостоятельного минерала в месторождениях нередко встречается самородная медь, которая содержит до 97 – 99% меди, а также примеси железа, серебра, свинца, золота, ртути, висмута. Самородная медь имеет плотность 8,4 – 8,9 г/см3 и твердость 2,5 – 3. Халькопирит, или медный колчедан, CuFeS2 является одним из важнейших медных минералов и встречается в месторождениях почти всех генетических типов, однако его главные промышленные скопления связаны с гидротермальными месторождениями. Содержание меди в халькопирит составляет 34,6%. железа 30,5% и серы 34,9%; имеются незначительные примеси серебра, цинка, золота, мышьяка, селена, теллура, олова. Кристаллизуется в тетрагональной системе. Кристаллическая структура (рис. 1.1) аналогична структуре сфалерита, но в позициях цинка упорядочение располагаются атомы меди и железа, а атомы серы находятся внутри тетраэдра, образованного двумя атомами меди и двумя атомами железа. Цвет халькопирита латунно-желтый. Спайность несовершенная, при измельчении на поверхности разлома находятся как ионы меди, так и железа и серы. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Минерал | Формула | Содержание меди, % | Плотность,г/см3 | Твердость |
| Халькопирит | CuFeS2 | 34,6 | 4,1-4,2 | 3-4 |
| Халькозин | Cu2S | 79,9 | 5,5-5,8 | 2,5-3 |
| Ковеллин | CuS | 64,5 | 4,6-4,7 | 1,5-2 |
| Борнит | Cu5FeS4 | 63,3 | 4,5-5,3 | 3 |
| Тетраэдрит | Cu12Sb4S12 | 45-51 | 4,4-5,1 | 3-4 |
| Теннантит | Cu12As4S12 | 45-51 | 4,4-5,1 | 3,5 |
| Куприт | Cu2O | 88,8 | 5,8-6,2 | 3,5-4 |
| Тенорит | CuO | 79,9 | 5,8-6,4 | 3,5-4 |
| Малахит | Cu2(CO3)(OH)2 | 57,4 | 3,9-4,1 | 3,5-4 |
| Азурит | Cu3(CO3)2(OH)2 | 55,3 | 3,7-3,9 | 3,5-4 |
| Хризоколла | CuSiO3nH2O | До 45 | 2-2,3 | 2-4 |
| Халькантит | CuSO45H2O | 25,4 | 2,2 | 2,5 |
| Брошантит | Cu4(SO4)(OH)6 | 34,8 | 3,8 | 3,5-4 |
Практически во всех медьсодержащих рудах, так же как и в полиметаллических, имеются сульфиды железа, краткая характеристика которых приведена в табл. 1.2.
Таблица 1.2. Сульфиды железа встречающиеся в медьсодержащих рудах
| Минерал | Формула | Содержание,% | Плотность,г/см3 | Твердость |
 железа серы железа серы | ||||
| Пирит | FeS2 | 46,5 53,5 | 4,9-5,2 | 6-6,5 |
| Марказит | FeS2 | 46,5 53,5 | 4,9 | 6-6,5 |
| Пирротин | Fe1-xSx2 | 58,8 41 | --- | 3,2-4,5 |
Пирит или серный колчедан, является самым распространенным сульфидным минералом во всех сульфидных рудах. Он присутствует повсеместно в месторождениях гидротермального происхождения и в колчеданных рудах, где сосредоточены основные его массы. Наиболее часто встречающимися примесями в пирите являются кобальт, никель и мышьяк, в виде включений могут присутствовать золото, медь, серебро, сурьма, цинк, марганец.
Пирит распространен в месторождениях чаще всего в виде сплошных зернистых масс, иногда в виде крупных кристаллов латунно-желтого цвета. Пирит является хорошим полупроводником.
Марказит является полиморфной разновидностью пирита. Образуется в гидротермальных месторождениях при температурах более низких, чем при образовании пирита. Постоянный спутник пирита и пирротина.
В зависимости от минерального состава, крупности минералов, характера вкрапленности ценных минералов и пустой породы, формы рудного тело и генезиса месторождения меди в настоящее время делятся на 6 генетических групп, характеристика которых приведена в табл.1.3.
Таблица 1.3. Формы рудного тело и генезис месторождения меди
| Генетическая группа | Промышленно-генетический тип месторождения | Содержание меди, % |
| Магматическая | Медно-никелевый, Ванадиево-железно-медный | 1-2 0,5-2 |
| Карбонатитовая | Карбонатитовый | --- |
| Скарновая | Скарновый | 2-3 |
| Гидротермальная | Медно-порфировый, Кварц-сульфидный, Самородная медь | 0,3-2 2-5 --- |
| Колчеданная | Медно-колчеданный | 1,5-8 |
| Стратиформная | Медистых песчаников и сланцев | 1,5-6 |
Медно-порфировые руды занимают первое место по запасом и добыче меди. Свыше 60% разведанных запасов меди и около 40% мировой добычи меди приходится на этот тип руды.
Во всем мире выделяются несколько крупных рудных зон месторождений этого типа. В СНГ к месторождениям этого типа относятся Коунрадское, Бощекульское, Алмалыкское и Закавказская группы. В США это Западно-Американский медно-порфировый пояс, в Южной Америке- Чилийская зона и т.д.
3. Кроме того, медные руды по минеральному и химическому составу, наличию в них сульфидов, окислов, карбонатов и сульфатов меди на сульфидные, в которых содержание меди в виде сульфидных минералов не менее 75%, смешанные, в которых содержание меди в виде сульфидных минералов 25-75%, и окисленные, в которых содержание меди в виде сульфидов не превышает 25%. Такая классификация медных руд является технологической, так как определяет принципиальную схему технологии переработки руд.
В зависимости от содержания меди в перерабатываемой руды медные руды условно подразделяются на богатые (содержание меди более 2%), средние (0,8-2%), бедные (0,5-0,8) и забалансовые (менее 0,3%). Богатые сульфидные руды, содержащие 2-3% меди, с высоким содержанием серы (35-42%) могут иногда направляться непосредственно на плавку в шахтных печах. Однако в мировой практике в настоящее время 80% меди извлекается из концентратов, получаемых при обогащении медных руд.
В зависимости от типа обогащаемой руды, состава медных минералов и минералов пустой породы, размера их вкрапленности возможно получение медных концентратов с содержанием меди 12-40% и более. Медные концентраты должны отвечать техническим требованиям, приведенным в табл. 1.4.
Таблица 1.4. Содержание (%) компонентов в медных концентратах
| Марка концентрата | Медь не менее | Примеси не более | |
| Цинк | Свинец | ||
| КМ - 0 | 40 | 2 | 2,5 |
| КМ - 1 | 35 | 2 | 3 |
| КМ - 2 | 30 | 3 | 4,5 |
| КМ - 3 | 25 | 5 | 4 |
| КМ - 4 | 23 | 10 | 7 |
| КМ - 5 | 20 | 10 | 8 |
| КМ - 6 | 18 | 11 | 9 |
| КМ - 7 | 15 | 11 | 9 |
| КМ - 8 | 12 | 11 | 9 |