мед химия. Тема. 10 Биосинтез и катаболизм пиримидиновых рибонуклеотидов. Оротацидурия
 Скачать 101.69 Kb. Скачать 101.69 Kb.
|
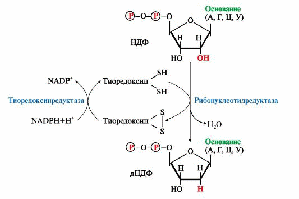 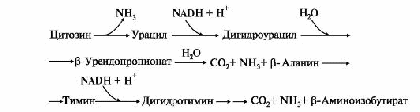 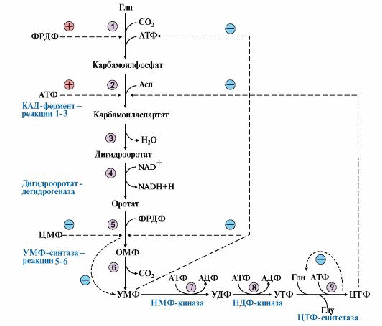 ТЕМА. 10.2. БИОСИНТЕЗ И КАТАБОЛИЗМ ПИРИМИДИНОВЫХ РИБОНУКЛЕОТИДОВ. ОРОТАЦИДУРИЯ ТЕМА. 10.2. БИОСИНТЕЗ И КАТАБОЛИЗМ ПИРИМИДИНОВЫХ РИБОНУКЛЕОТИДОВ. ОРОТАЦИДУРИЯ1. УМФ является общим предшественником всех остальных пиримидиновых нуклеотидов: ЦМФ и ТМФ. Синтез УМФ de novo включает шесть последовательных стадий (рис. 10.5) и протекает главным образом в цитозоле клеток при участии трех ферментов, два из которых полифункциональны: • первый полифункциональный фермент - КАД-фермент содержит домены, проявляющие активности карбамоилфосфатсинтетазы II (КФСН), аспартаттранскарбамоилазы (ATK), дигидрооротазы и катализирующие три первые реакции этого метаболического пути; • митохондриальная NAD-зависимая дигидрооротатдегидрогеназа которая окисляет дигидрооротат в оротат; • превращение азотистого основания - оротата в нуклеотид и его последующее декарбоксилирование до УМФ катализирует второй полифункциональный фермент - УМФ-синтаза, обладающая оротатфосфорибозилтрансферазной и ОМФ-декарбоксилазной активностями. Рис. 10.5. Синтез пиримидиновых нуклеотидов и его регуляция: 1-3 - КАД-фермент (1-карбамоилфосфатсинтетаза, КФС11); 2 - аспартаттранскарбамоилаза (АТК); 3 -дигидрооротаза; 4 - дигидрооротатдегидрогеназа; 5, 6 - УМФ-синтаза (5-оротатфосфорибозилтрансфераза; 6 - ОМФ-декарбоксилаза); 7 - НМФ-киназа; 8 - НДФ-киназа; 9 - ЦТФ-синтетаза. Аллостерически регулируются по механизму отрицательной обратной связи карбамоилфосфатсинтетазная и аспататтранскарбамоилазная активности КАД-фермента конечными продуктами метаболического пути - УМФ и ЦТФ, тогда как ФРДФ активизирует КФС11, а АТФ - АТК Пиримидиновое кольцо «собирается» из простых предшественников - глутамина, аспартата и СО2 - и после окисления превращается в азотистое основание - оротат. Превращение оротата в нуклеотид - оротидин-5'- монофосфат (ОМФ) - осуществляется с использованием ФРДФ. УМФ образуется при декарбоксилировании ОМФ. Превращение УМФ в полифосфорные производные за счет переноса γ-фосфатного остатка АТФ на УМФ с образованием УДФ и УТФ катализируют НМФ- и НДФ-киназы. Синтез ЦТФ из УТФ осуществляет ЦТФ-синтетаза, используя амидную группу Глн и энергию АТФ для аминирования пиримидинового кольца. 2. Регуляция процесса. Активность ферментов синтеза пиримидиновых нуклеотидов регулируется аллостерически по механизму отрицательной обратной связи конечными продуктами УМФ и ЦТФ: • в составе КАД-фермента: УМФ ингибирует, а ФРДФ активирует КФС II, тогда как активность аспартаттранскарбамоилазы ингибирует ЦТФ, но активирует АТФ; • УМФ и ЦМФ снижают активность второго полифункционального фермента - УМФ-синтазы; • накопление ЦТФ снижает активность ЦТФ-синтетазы. Синтез пуриновых и пиримидиновых нуклеотидов строго координируется: ФРДФ активирует оба синтеза, а накопление пуриновых и пиримидиновых нуклеотидов ингибирует образование ФРДФ по механизму отрицательной обратной связи. 4. Оротацидурия - редкое наследственное заболевание, при котором в результате мутации в гене второго полифункционального фермента нарушается превращение оротата в УМФ. С мочой выделяется до 1,5 г оротата (в 1000 раз больше, чем в норме). Клинически заболевание проявляется в виде мегалобластной анемии, нарушений работы ЖКТ, сердца, интеллектуального развития и двигательной способности. Высокие концентрации оротата в крови и тканях нетоксичны для организма, а указанные симптомы возникают в результате неспособности организма из-за «пиримидинового голода» обеспечить нормальную скорость синтеза нуклеиновых кислот и увеличения числа клеток. Наиболее характерным следствием оротацидурии является мегалобластная анемия, вызванная снижением скорости деления клеток эритроцитарного ряда. Для лечения этой болезни используют уридин или цитидин в дозах от 0,5 до 1 г/сут, которые с помощью уридинцитидинкиназы превращаются в УМФ или ЦМФ в обход нарушенной реакции. Полифосфорные производные полученных нуклеотидов - УТФ и ЦТФ - ингибируют регуляторные ферменты синтеза пиримидиновых нуклеотидов de novo и снижают синтез и выведение оротата с мочой. 5. Катаболизм пиримидиновых нуклеотидов. От пиримидиновых нуклеотидов отщепляются остатки фосфорной кислоты и рибозы в реакциях, аналогичных катаболизму пуриновых нуклеотидов. Образующиеся пиримидиновые основания способны разрушаться ферментными системами организма с образованием ряда продуктов (рис. 10.6). Рис. 10.6. Катаболизм пиримидиновых оснований В отличие от конечных продуктов пуринового обмена продукты катаболизма пиримидинов хорошо растворимы в воде. Причем β-аланин имеет физиологическое значение, содержится во многих тканях и в плазме крови в свободном виде или включается в состав мышечных пептидов: карнозина и ансерина. Бактериальные клетки используют β-аланин для синтеза пантотеновой кислоты, которая входит в состав HS-КоА. β-Аминоизобутират, образующийся при распаде тимина, частично экскретируется с мочой, а частично трансаминируется, превращаясь в метилмалонил полуальдегид, а затем в сукцинил-КоА. ТЕМА 10.3. БИОСИНТЕЗ ДЕЗОКСИРИБОНУКЛЕОТИДОВ. ИММУНОДЕФИЦИТЫ летки, как правило, содержат в 5-10 раз больше РНК, чем ДНК. Быстрорастущие клетки для репликации генома нуждаются в дезоксирибонуклеозидтрифосфатах (дНТФ), которые образуются путем прямого восстановления гидроксильной группы рибозы в дезоксирибозу в составе пуриновых и пиримидиновых НДФ и последующего фосфорилирования дНДФ с использованием АТФ. 1. Восстановление всех рибонуклеотидов катализирует рибонуклеотидредуктазный комплекс,который включает рибонуклеотидредуктазу (РНРазу), белковый кофактор тиоредоксин и систему его регенерации: фермент тиоредоксинредуктазу и NADPH (рис. 10.7). Непосредственным восстановителем НДФ является тиоредоксин, сульфгидрильные группы которого в ходе этой реакции окисляются. 2. РНРаза - аллостерический фермент и его активность зависят от количественного содержания отдельных дезоксирибонуклеотидов в клетке. дАТФ является ингибитором восстановления всех рибонуклеотидов, а дГТФ подавляет восстановление пиримидиновых НДФ. Рис. 10.7. Восстановление рибонуклеозиддифосфатов в дезоксипроизводные. Восстановителем НДФ является тиоредоксин, сульфгидрильные группы которого окисляются в ходе этой реакции. Окисленный тиоредоксин восстанавливается тиоредоксинредуктазой с участием NADPH 3. Синтез дТМФ из дУМФ катализирует тимидилатсинтаза с участием N5N10- метилен Н4-фолата, за счет которого: • включается одноуглеродный радикал в молекулу дУMФ и • восстанавливается метиленовая группа в метильную. Тимидилатсинтаза не только переносит метиленовую группу N5N10-метилен-Н4-фолата в 5-положение пиримидинового основания дУМФ, но в процессе восстановления ее в метильный радикал забирает два атома водорода от Н4-фолата, поэтому восполнение запасов N5N10-метилен- Н4-фолата нуждается в работе еще двух ферментов: дигидрофолатредуктазы и сериноксиметилтрансферазы (рис. 10.8). Интенсивность синтеза дТМФ зависит от скорости восстановления продукта реакции дигидрофолата в Н4-фолат с помощью дигирофолатредуктазы. Образование дУМФ осуществляется двумя путями: дефосфорилированием дУДФ или дефосфорилированием дЦДФ и последующим гидролитическим дезаминированием дЦМФ с помощью дЦMФ-дезаминазы. В организме человека преобладает последний путь. 4. Количество ферментов РНРазы и тимидилатсинтазы регулируется на генетическом уровне по механизму индукции и зависит от скорости синтеза ДНК. Их количество увеличивается и высокая скорость реакций, катализируемых РНРазой и тимидилатсинтазой, наблюдаются только тогда, когда клетки активно синтезируют ДНК и готовятся к делению. Рис. 10.8. Синтез дТМФ 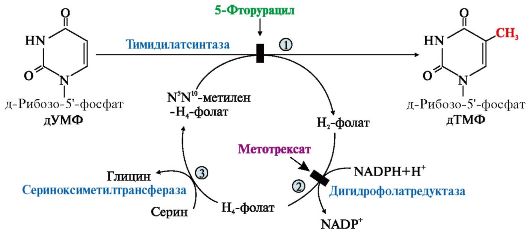 На схеме показаны препараты, часто использующиеся в лечении онкологических заболеваний и останавливающие синтез дТМФ на стадиях превращения дУМФ в дТМФ и восстановления Н2-фолата в Н4-фолат 5. Небольшое количество дезоксирибонуклеотидов может образовываться по «запасному» пути в реакциях, катализируемых тимидинкиназой и дезоксицитидинкиназой: Дезоксицитидинкиназа фосфорилирует также дезоксигуанозин и дезоксиаденозин. 6. Иммунодефициты - состояния, связанные с нарушением функций иммунной системы. Они возникают при ингибировании работы РНРазы, вызванном недостаточностью ферментов катаболизма аденозина и гуанозина. Недостаточность аденозиндезаминазы и пуриннуклеозидфосфорилазы снижает скорость превращения пуриновых нуклеозидов в азотистые основания и мочевую кислоту. В клетках накапливаются избыточные количества рибо- и дезоксирибонуклеотидов, вызывая в быстро делящихся клетках повышение концентрации дАТФ и дГТФ, которые тормозят восстановление всех остальных НДФ в дезоксипроизводные. Это останавливает синтез ДНК и деление клеток. • Низкая активность аденозиндезаминазы нарушает пролиферацию и созревание Т- и В-лимфоцитов и сопровождается возникновением тяжелых форм клеточного и гуморального иммунодефицита. Накопление дАТФ ингибирует РНРазу и лишает клетки субстратов для синтеза ДНК. Дети с этой патологией, как правило, погибают от частых инфекций. • Наследственная недостаточность пуриннуклеозидфосфорилазы останавливает созревание Т-лимфоцитов в связи с накоплением в клеткахпредшественниках дГТФ, блокирующего РНРазу и синтез пиримидиновых дНТФ, но не столь сильно, как дАТФ. У пациентов оказывается сниженным клеточный иммунитет. Больные страдают частыми и хроническими инфекционными заболеваниями. |
