потенциометрия тесты. Тема 10. Потенциометрия и потенциометрическое титрование
 Скачать 117.67 Kb. Скачать 117.67 Kb.
|
|
Тема: 10. Потенциометрия и потенциометрическое титрование Потенциометрия. Сущность метода. Механизм электродных процессов. Индикаторные электроды и электроды сравнения. Стеклянный электрод. Определение рН. Примеры практического применения потенциометрического титрования с использованием реакций осаждения, нейтрализации, комплексообразования и окисления-восстановления. Ионометрия. Классификация ионоселективных электродов. Электроды с жидкими и твердыми мембранами, ферментные электроды. На чем основаны потенциометрические методы анализа? Какая зависимость выражается уравнением Нернста? Пояснить смысл входящих в него величин. Что представляют собой электроды I и II рода? Привести примеры этих электродов. Какие функции выполняют индикаторные электроды и какие — электроды сравнения? Указать требования, которые к ним предъявляются. Привести схему установки для потенциометрических измерений. Зачем нужен стандартный гальванический элемент? Какой элемент обычно используется в потенциометрии в качестве стандартного? Что такое солевой мостик и каково его назначение? В чем сущность потенциометрического определения рН раствора? Какие индикаторные электроды могут быть использованы для определения рН? Как устроен стеклянный электрод? Как можно определить стандартный потенциал этого электрода? Указать достоинства и недостатки стеклянного электрода. Каковы основные типы ионоселективных электродов? Как они устроены? Какие имеют характеристики? Указать достоинства, недостатки и области применения метода прямой потенциометрии. В каких координатах строят кривые потенциометрического титрования? Чем обусловливается выбор координат? В чем сущность не компенсационного метода потенциометрического титрования и титрования под током? Назвать соответствующие пары электродов и привести примеры потенциометрического титрования с использованием: а) реакций кислотно-основного взаимодействия; б) реакций осаждения; в) реакций комплексообразования; г) реакций окисления — восстановления. Каковы особенности потенциометрического титрования в неводных средах? Какие требования предъявляются к неводному растворителю? Привести примеры потенциометрических определений в среде ледяной уксусной кислоты по методу: а) прямого титрования; б) обратного титрования; в) замещения. Назвать достоинства и области применения потенциометрического титрования в неводных средах. Тесты 4.1 ПОТЕНЦИОМЕТРИЯ И ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ Задание № 1 Как устанавливается точка эквивалентности при потенциометрическом титровании кислоты? Ответ: 1. по изменению потенциала; 2. по изменению концентрации; 3. по изменению окраски раствора. Задание № 2 Для какой кислоты в потенциометрическом титровании величина скачка потенциала будет наименьшей? Ответ: 1. разбавленной; 2. концентрированной; 3. слабой кислоты; Задание № 3 Какая зависимость положена в основу потенциометрического титрования? Ответ: 1. Е от С; 2. I от С; 3. dE от V; 4. Е от V. Задание № 4 Концентрацию каких ионов можно установить при потенциометрическом титровании смеси Cl-, NO3-, SO42- нитратом серебра? Ответ: 1. хлориды; 2. сульфаты; 3. нитраты. Задание № 5 На рисунке изображен стандартный _________________ электрод. 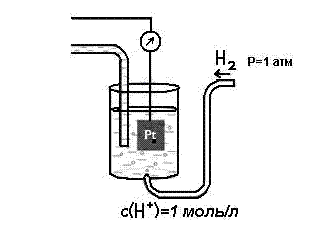 Ответ: водородный Задание № 6 В выражении для окислительно-восстановительного потенциала: 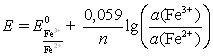 величина n равна ____. Ответ введите целым числом. Ответ: 1 Задание № 7 В каких координатах строится кривая потенциометрического титрования? Ответ: 1. рН - V; 2. pH -C; 3. lgC - V; 4. lgC - pH; Задание № 8 Какой электрод используется в потенциометрии в качестве индикаторного при определении рН? Ответ: 1. кислородный; 2. водородный; 3. платиновый; 4. каломельный. Задание № 9 Какой электрод используется в качестве индикаторного при потенциометрическом титровании NaCl раствором AgNO3? Ответ: 1. хлорсеребряный; 2. серебряный; 3. хлоридный; 4. натриевый. Задание № 10 Какая зависимость положена в основу потенциометрического титрования? Ответ: 1. изменение потенциала; 2. изменение окраски индикатора; 3. изменение концентрации; Задание № 11 Какие электроды называются индикаторными? Ответ: 1. обратимые электроды; 2. необратимые электроды; 3. инертные электроды; 4. электроды сравнения. Задание № 12 Потенциал какого электрода 1) Cu/0.1M CuSO4, 2) Cu/0.01M CuSO4 , 3) Fe/0,01M FeSO4 отрицательнее? Ответ: 1. 1; 2. 3; 3. 2. Задание № 13 Потенциометрический метод основан на Ответ: 1. измерении силы тока; 2. измерении эдс обратимых гальванических элементов; 3. измерении сопротивления; 4. измерении тока диффузии. Задание № 14 Что означает символ R в уравнении Нернста 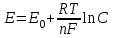 Ответ: 1. газовая непостоянная; 2. газовая постоянная; 3. сила тока; 4. число Фарадея. Задание № 15 Что влияет на величину скачка рН при потенциометрическом титровании кислоты? Ответ: 1. концентрация; 2. температура; 3. степень диссоциации; Задание № 16 Для какой кислоты в потенциометрическом титровании величина скачка потенциала будет наименьшей? Ответ: 1. слабой; 2. сильной; 3. разбавленной; 4. концентрированной; Задание № 17 Какая реакция используется при потенциометрическом титровании нитрата серебра? Ответ: 1. Обмена; 2. Нейтрализации; 3. комплексообразования ; 4. осаждения. Задание № 18 Как устанавливается точка эквивалентности при потенциометрическом титровании кислоты? Ответ: 1. по скачку потенциала; 2. по изменению рН среды; 3. по изменению окраски индикатора; Задание № 19 Концентрацию какого иона можно установить по первому скачку при потенциометрическом титровании смеси Cl-, J-, Br-, NO3- нитратом серебра? Ответ: 1. Cl-; 2. J-; 3. Br-; 4. J-, Br. Задание № 20 Потенциал какого электрода 1) Cu/0.1M CuSO4, 2) Cu/0.01M CuSO4 , 3) Fe/0,01M FeSO4 положительнее? Ответ: 1. 1; 2. 3; 3. 2. Задание № 21 С помощью ИСЭ …  измерять равновесную концентрацию (активность) отдельных ионов. измерять равновесную концентрацию (активность) отдельных ионов.  рН раствора рН раствора разность потенциалов разность потенциалов температуру раствора температуру раствораЗадание № 22 При погружении стеклянного электрода в исследуемый раствор происходит  обмен ионами между стеклянной мембраной и раствором; обмен ионами между стеклянной мембраной и раствором; адсорбция ионов Н+ на поверхности мембраны; адсорбция ионов Н+ на поверхности мембраны; перенос электронов перенос электронов адсорбция ионов Н+ на поверхности ЭС адсорбция ионов Н+ на поверхности ЭСЗадание № 23 Для измерения рН наиболее часто применяют _______ индикаторный электрод.  хингидронный; хингидронный;  сурьмяный; сурьмяный;  стеклянный; стеклянный;  водородный. водородный.Задание № 24 В основу ионометрии положена зависимость  потенциала индикаторного электрода от концентрации потенциалопределяющих ионов; потенциала индикаторного электрода от концентрации потенциалопределяющих ионов; тока от концентрации; тока от концентрации; тока от потенциала; тока от потенциала; потенциала индикаторного электрода от активности потенциал- потенциала индикаторного электрода от активности потенциал-определяющих ионов. Задание № 25 В прямой потенциометрии наиболее часто в качестве электрода сравнения используют донную ртуть;  + хлорсеребряный электрод; + хлорсеребряный электрод; каломельный электрод каломельный электрод стеклянный электрод стеклянный электродЗадание № 26 pF- электрод с мембраной из фторида лантана относится к  гомогенным твердофазным; гомогенным твердофазным; гетерогенным твердофазным: гетерогенным твердофазным: пленочным; пленочным; жидкостным мембранным. жидкостным мембранным.Задание № 27 Наклон градуировочного графика максимально зависит от  стандартного редокс-потенциала; стандартного редокс-потенциала; заряда определяемого иона; заряда определяемого иона; ионной силы раствора ионной силы раствора концентрации определяемого иона концентрации определяемого ионаЗадание № 28 Для двухзарядного аниона правильным выражением электродной функции ИСЭ является  E = Eo + 0,059 ; E = Eo + 0,059 ; E = Eo - 0,029 ; E = Eo - 0,029 ; E = Eo + 0,029 E = Eo + 0,029  E = Eo + 0,039 E = Eo + 0,039 Задание № 29 Интегральная кривая потенциометрического титрования представлена на рисунке (3) 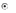 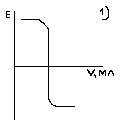  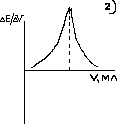  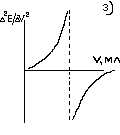 Задание № 30 В потенциометрии под индикаторным электродом понимают электрод, потенциал которого  не зависит от состава раствора; не зависит от состава раствора; зависит только от природы растворителя зависит только от природы растворителя зависит от рН зависит от рН зависит от природы и концентрации одного из компонентов раствора. зависит от природы и концентрации одного из компонентов раствора.Задание № 31 В потенциометрии роль электрода сравнения играет электрод, потенциал которого  зависит от природы одного из компонентов раствора; зависит от природы одного из компонентов раствора; зависит от концентрации одного из компонентов раствора; зависит от концентрации одного из компонентов раствора; не зависит от состава раствора (неполяризуемый электрод); не зависит от состава раствора (неполяризуемый электрод); зависит только от природы растворителя. зависит только от природы растворителя.Задание № 32 Дифференциальная кривая титрования представлена на рисунке(2)    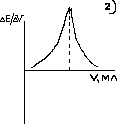  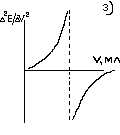 Задание № 33 В потенциометрическом титровании с неполяризованным электродом под индикаторной реакцией понимают  редокс-реакцию в растворе; редокс-реакцию в растворе; полуреакцию окисления на поверхности твердого электрода; полуреакцию окисления на поверхности твердого электрода; редокс-реакцию на поверхности электрода; редокс-реакцию на поверхности электрода; полуреакцию окисления на поверхности твердого электрода. полуреакцию окисления на поверхности твердого электрода.Задание № 34 Метод прямой потенциометрии наиболее часто применяется для определения  активности ионов водорода; активности ионов водорода; скачка потенциала; скачка потенциала; концентрации ионов водорода. концентрации ионов водорода. конечной точки титрования конечной точки титрованияЗадание № 35 _______ вызывает скачок титрования при потенциометрической индикации точки эквивалентности.  изменение природы индикаторной реакции в ходе титрования; изменение природы индикаторной реакции в ходе титрования; уменьшение количества исходных веществ; уменьшение количества исходных веществ; образование слабых электролитов в результате протекания химической реакции; образование слабых электролитов в результате протекания химической реакции; образование малорастворимых соединений в результате протекания химической реакции. образование малорастворимых соединений в результате протекания химической реакции.Тесты 4.2. КУЛОНОМЕТРИЯ И КУЛОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ Задание № 1 В основу кулонометрического титрования положено (а)  соответствие потенциала одного из электродов ячейки потенциалу окисления (восстановления) вещества, присутствующего в растворе; соответствие потенциала одного из электродов ячейки потенциалу окисления (восстановления) вещества, присутствующего в растворе; способность вещества к электрохимическому превращению на поверхности твердого электрода; способность вещества к электрохимическому превращению на поверхности твердого электрода; соответствие между количеством электричества, прошедшего через ячейку, и количеством электрогенерируемого реагента соответствие между количеством электричества, прошедшего через ячейку, и количеством электрогенерируемого реагента способность вещества к электрохимическому превращению на поверхности ионоселективного электрода. способность вещества к электрохимическому превращению на поверхности ионоселективного электрода.Задание № 2 При кулонометрическом титровании кислот в качестве вспомогательного реагента используется  вода; вода;  сульфат калия; сульфат калия;  нитрат калия; нитрат калия;  гидроксид натрия. гидроксид натрия.Задание № 3 Основное условие для использования в анализе метода кулонометрического титрования заключается в  электрогенерировании реагента со 100 % -ной эффективностью использования тока и количественном химическом взаимодействии реагента с определяемым веществом; электрогенерировании реагента со 100 % -ной эффективностью использования тока и количественном химическом взаимодействии реагента с определяемым веществом; непосредственном превращении определяемого вещества на одном из электродов ячейки; непосредственном превращении определяемого вещества на одном из электродов ячейки; применении кулонометра, включенного последовательно в цепь ячейки; применении кулонометра, включенного последовательно в цепь ячейки; поддержании при титровании постоянства силы тока. поддержании при титровании постоянства силы тока.Задание № 4 Отличие кулонометрического титрования от других типов титрования заключается в том, что  можно сразу прибавить весь объем титранта; можно сразу прибавить весь объем титранта; реагент образуется в результате электродной реакции; реагент образуется в результате электродной реакции; при титровании нет необходимости измерять объем титранта; при титровании нет необходимости измерять объем титранта; нельзя применять прямое титрование. нельзя применять прямое титрование.Задание № 5 Под кулонометром понимают устройство для  поддержания постоянной силы тока в цепи кулонометрической установки; поддержания постоянной силы тока в цепи кулонометрической установки; поддержания постоянной разности потенциалов генераторного и вспомогательного электродов; поддержания постоянной разности потенциалов генераторного и вспомогательного электродов; измерения количества электричества; измерения количества электричества; индикации конца титрования. индикации конца титрования.Задание № 6 В основу прямой кулонометрии положено  измерение электродного потенциала в ходе электролиза; измерение электродного потенциала в ходе электролиза; измерение массы вещества, подвергающегося электрохимическому превращению; измерение массы вещества, подвергающегося электрохимическому превращению; определение количества электричества, затрачиваемого на электрохимическое превращение вещества; определение количества электричества, затрачиваемого на электрохимическое превращение вещества; контроль всех трех факторов. контроль всех трех факторов.Задание № 7 При кулонометрическом титровании количество электричества определяют  как произведение силы тока и времени генерирования реагента до достижения конечной точки титрования; как произведение силы тока и времени генерирования реагента до достижения конечной точки титрования; измеряя продолжительность титрования к моменту скачка потенциала; измеряя продолжительность титрования к моменту скачка потенциала; измеряя вблизи точки эквивалентности изменение тока электролиза в единицу времени измеряя вблизи точки эквивалентности изменение тока электролиза в единицу времени измеряя продолжительность титрования к моменту снижения потенциала измеряя продолжительность титрования к моменту снижения потенциалаЗадание № 8 Отличительное преимущество кулонометрического титрования перед амперометрическим заключается в  простоте и доступности аппаратуры; простоте и доступности аппаратуры; высокой чувствительности и более широком круге реакций; высокой чувствительности и более широком круге реакций; экспрессности; экспрессности; отсутствие необходимости приготовления стандартных растворов, возможности использования неустойчивых реагентов и высокой точности. отсутствие необходимости приготовления стандартных растворов, возможности использования неустойчивых реагентов и высокой точности. |
