Лекция Арены ряда бензола-2015. Тема 20. Ароматические углеводороды ряда бензола
 Скачать 5.16 Mb. Скачать 5.16 Mb.
|
|
ТЕМА 20. Ароматические углеводороды ряда бензола. Гомологический ряд. Общая формула. Номенклатура. Изомерия. Природные источники и методы получения: из алифатических, алициклических и ароматических соединений. Реакции Вюрца-Фиттига и Фриделя-Крафтса. Физические свойства бензола и его гомологов. Химические свойства. Реакции электрофильного замещения: галогенирование, нитрование, сульфирование, алкилирование и ацилирование. Реакции присое-динения водорода, галогенов, озона. Окисление бензола. Реакции гомологов бензола с участием боковой цепи: галогенирование, нитрование, окисление, дегидрирование. Гомологический ряд. Общая формула. Первым и наиболее важным представителем моноциклических ароматических углеводородов (аренов) является бензол С6Н6. Отсюда общее название гомологического ряда ароматических углеводородов - ряд бензола. Общая формула гомологического ряда бензола: СпН2п-6. Номенклатура аренов. Для наименования аренов часто используются тривиальные названия: бензол, толуол, стирол, кумол и т.д. По международной заместительной номенклатуре арены рассматриваются как производные бензола, в которых положение заместителей указывается цифрами, при этом номера атомов углеродов, у которых расположены заместители должны быть наименьшими: 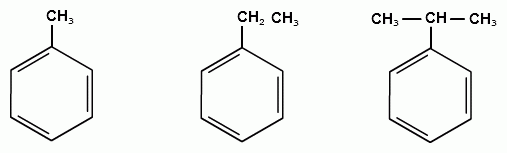 метилбензол этилбензол изопропилбензол (толуол) (кумол) 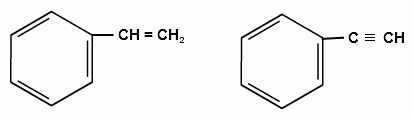 винилбензол этинилбензол (стирол) (фенилацетилен) В случае двух одинаковых заместителей вместо цифр можно пользоваться приставками: 1,2- (орто-), 1,3- (мета-), 1,4- (пара-): 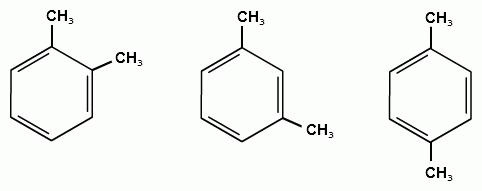 1,2-диметилбензол 1,3-диметилбензол 1,4-диметилбензол (орто-ксилол) (мета-ксилол) (пара-ксилол) В случае двух неодинаковых заместителей, нумерацию определяет младший заместитель: 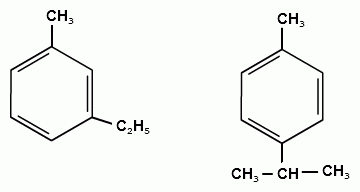 1-метил-3-этилбензол 1-метил-4-изопропилбензол (цимол) 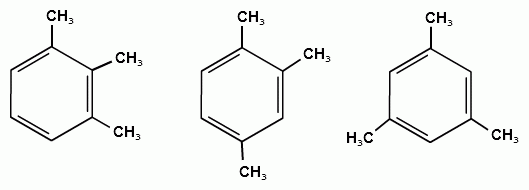 1,2,3-триметилбензол 1,2,4-триметилбензол 1,3,5-триметилбензол (псевдокумол) (мезитилен) 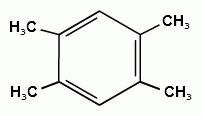 1,2,4,5-тетраметилбензол (дурол) Номенклатура радикалов Названия одновалентных остатков Одновалентные остатки, образованные отнятием одного атома водорода от бензольного ядра, называются арильными остатками или арилами ( Ar ): 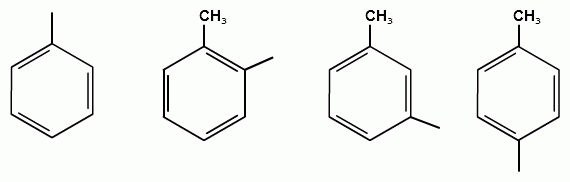 фенил орто-толил мета-толил пара-толил 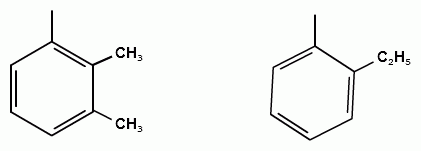 2,3-ксилил 2-этилфенил Названия двухвалентных остатков. Двухвалентные остатки образуются отнятием двух атомов водорода от бензольного ядра: 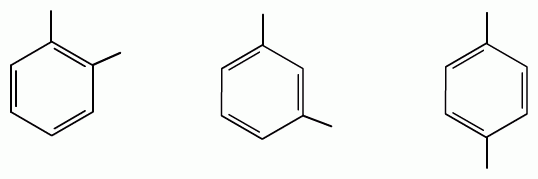 орто-фенилен мета-фенилен пара-фенилен Одновалентные, двухвалентные и трехвалентные остатки могут образоваться при отнятии соответственно одного, двух или трех атомов водорода от углеводородных радикалов, находящихся в боковой цепи: 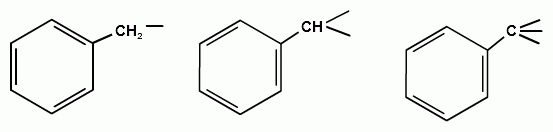 бензил бензилиден бензенил Изомерия аренов Для аренов характерны следующие виды изомерии, связанные со строением, составом и положением радикалов, находящихся в боковой цепи: 1) Изомерия, связанная со строением боковых цепей: 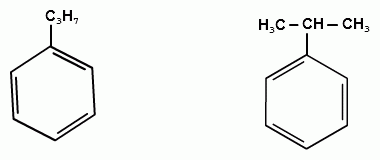 пропилбензол изопропилбензол (кумол) 2) Изомерия, связанная с числом углеродных атомов в заместителях: 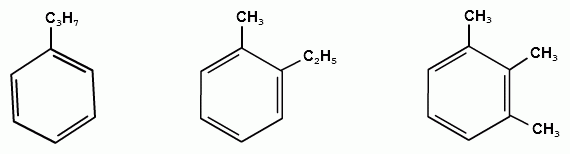 пропилбензол 1-метил-2-этилбензол 1,2,3-триметилбензол 3) Изомерия, зависящая от положения заместителей в цикле:  1,2-диметилбензол 1,3-диметилбензол 1,4-диметилбензол (орто-ксилол) (мета-ксилол) (пара-ксилол) Природные источники и способы получения аренов. Получение из природных источников. Основными природными источниками ароматических углеводородов являются каменный уголь и нефть. 1. Получение из каменного угля В настоящее время из каменного угля получают свыше 300 различных органических соединений. В процессе сухой перегонки каменного угля (пиролиз) без доступа воздуха при температурах 1000 - 12000 С получают следующие продукты:
При перегонке каменноугольной смолы выделяют следующие фракции:
Из легкого масла выделяют бензол, толуол, ксилолы, стирол, этилбензол и др.;
Из тяжелого масла выделяют крезолы, ксиленолы, нафталин, хинолин;
Пек состоит из различных фрагментов ароматических углеводородов и применяется для получения лаков, в строительстве дорог, для изготовления топливных брикетов и др. 2. Получение из нефти Другим источником получения ароматических углеводородов является нефть. Некоторые сорта нефти содержат до 60% ароматических углеводородов, которые выделяют простой перегонкой или пиролизом. Однако основное количество ароматических соединений образуется при ароматизации нефти - при каталитической дегидроциклизации алкенов и каталитическом дегидрировании циклоалканов. В промышленности процесс ароматизации нефтиназывают каталитическим риформингом. Синтетические способы получения. Все способы получения ароматических углеводородов можно разделить на три группы: 1. Получение из соединений алифатического ряда. 1.1. Каталитическая дегидроциклизация алканов (ароматизация алканов) Алканы в присутствии оксидных катализаторов (Cr2O3/Al2O3) и температуре 450-500ОС дегидрируются и циклизуются с образованием аренов:  толуол 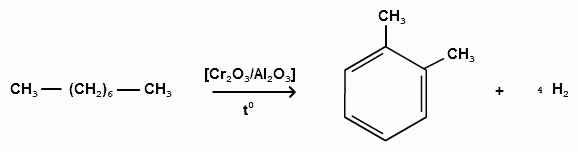 орто-ксилол 1.2. Циклотримеризация алкинов Циклотримеризация алкинов приводит к образованию бензола и его гомологов. Труднее всего реагирует ацетилен. Циклическая тримеризация ацетилена происходит над активированным углем при 600C (Н.Д.Зелинский): 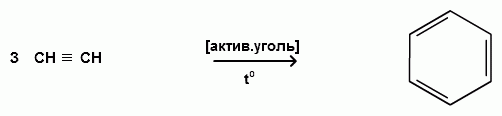 ацетилен бензол 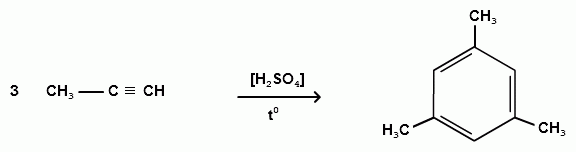 метилацетилен мезитилен 2. Получение из соединений алициклического ряда. 2.1. Дегидрирование циклоалканов. При каталитическом дегидрировании циклогексана и его производных в качестве катализатора используется платина или палладий при температуре 300C. 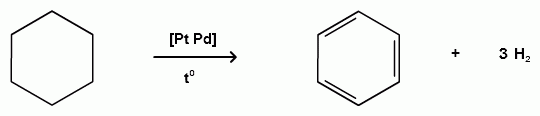 циклогексан бензол 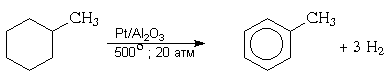 метилциклогексан толуол 2.2. Реакция “необратимого” катализа (реакция диспропорционирования) Циклогексан и циклогексадиен способны к перераспределению (диспропорционированию) водорода в реакциях, приводящих к образованию аренов: 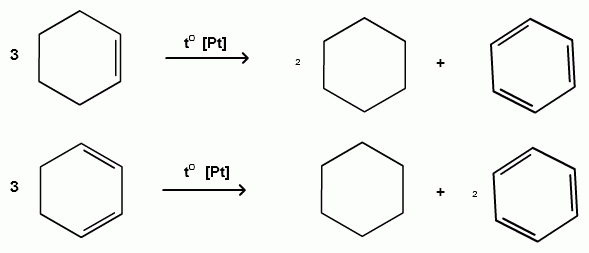 3. Получение из ароматических соединений. 3.1. Реакция Вюрца-Фиттига. Аналогично получению алканов по реакции Вюрца, возможен синтез алкилбензолов при взаимодействии галогенбензолов и галогеналканов с натрием: 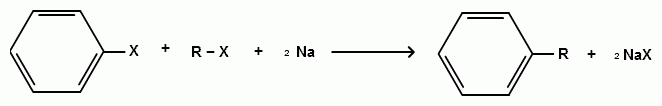 Первоначально образуется натрийорганическое соединений - фенилнатрий, которое затем реагирует с галогеналканом: 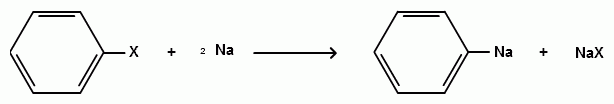 фенилнатрий 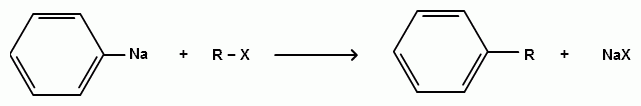 Наряду с получением алкилбензолов (Ar-R) в качестве побочных продуктов образуются: дифенил (Ar-Ar) и алканы (R-R), которые легко отделяются от основного продукта, так как имеют различные с ним температуры кипения. Этим реакция Вюрца-Фиттига отличается от синтеза Вюрца в алифатическом ряду. 3.2. Реакция Вюрца-Гриньяра. Алкилбензолы могут быть получены также при взаимодействии фенилмагнийгалогенидов с галогеналканами: 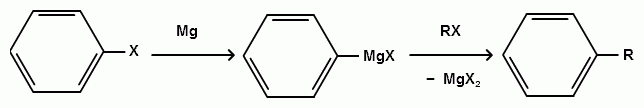 фенилмагнийгалогенид 3.3. Алкилирование по Фриделю-Крафтсу. В присутствии катализаторов кислот Льюиса(AlCl3; FeCl3; SnCl4; BF3; ZnCl2 и др.), а также протонных кислот (HF; H2SO4; H3PO4), арены алкилируются галогеналканами, алкенами или спиртами с образованием алкилбензолов:  Эта реакция имеет большое промышленное значение. Однако недостатками этого способа являются: 1) образование в качестве побочных продуктов полиалкилзамещенных соединений, при этом предпочтительнее образуются 1,4-дизамещенные продукты; 2) изомеризация алкильных радикалов в процессе реакции, что приводит к получению смеси изомерных алкилбензолов: 3.4. Восстановление ароматических кетонов (по Клеменсену). Алкилбензолы получают восстановлением ароматических кетонов, которые образуются при взаимодействии бензола с хлорангидридами кислот по реакции ацилирования Фриделя-Крафтса: 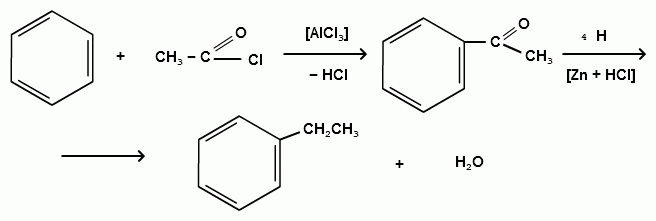 3.5. Сплавление солей ароматических кислот со щелочами. 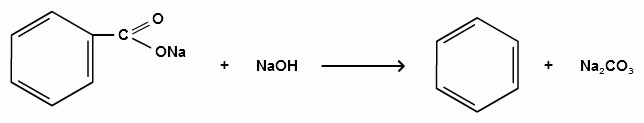 натриевая соль бензол бензойной кислоты 3.6. Декарбоксилирование ароматических кислот. Реакции декарбоксилирования протекают при нагревании в присутствии катализаторов - оксидов металлов: 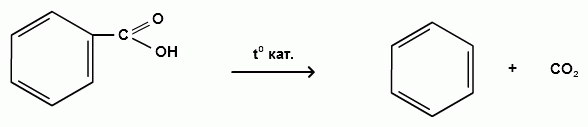 бензойная кислота бензол 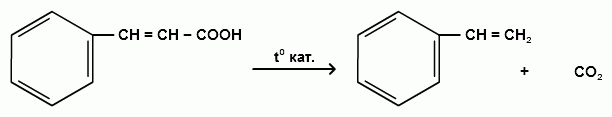 коричная кислота стирол Физические свойства аренов. Арены - это обычно жидкости и реже твердые вещества с сильным специфическим запахом. Температура кипения бензола (80,10 С) выше температуры кипения гексана (68,80 С). В ряду гомологов бензола каждая новая группа СН2 повышает температуру кипения на 300 С. Температура кипения и температура плавления аренов зависят от состава и изомерии боковых цепей, а также от их положения относительно друг друга. 1) Изомеры с несколькими радикалами кипят при более высокой температуре, чем изомеры с одним более сложным радикалом: 2) Изомеры, имеющие заместитель с нормальным строением, кипят при более высокой температуре, чем изомеры с изостроением заместителя; 3) При сближении радикалов температура кипения обычно возрастает. Поэтому, орто-изомеры обычно кипят при более высокой температуре, чем пара-изомеры; 4) Изомеры с симметричным строением имеют более высокую температуру плавления. Поэтому пара-изомеры плавятся при наиболее высокой температуре. Плотность и показатели преломления аренов значительно выше, чем алифатических и алициклических углеводородов. Арены почти нерастворимы в воде, но смешиваются во всех соотношениях с органическими растворителями - спиртами, эфиром, ацетоном и др. Химические свойства аренов Для аренов наиболее характерными являются реакции электрофильного замещения, а в реакции присоединения они вступают с трудом, только при наличии особых условий, таких как интенсивное освещение или в присутствии катализаторов. Для гомологов бензола характерны также реакции с участием боковой цепи. 1. Реакции электрофильного замещения 1.1. Реакции нитрования Под действием концентрированной азотной кислоты или смеси концентрированных азотной и серной кислот (нитрующая смесь) атомы водорода бензольного ядра замещаются на нитрогруппу:  нитробензол Нитрованию предшествует образование электрофильного реагента NO2 - катиона нитрония. В реакции нитрования бензола нитрующей смесью катион нитрония (NO2) образуется в результате протонирования азотной кислоты присутствующей концентрированной серной кислотой:  Дальнейшее нитрование происходит с трудом, так как нитрогруппа является заместителем второго рода и затрудняет течение реакций с электрофильными реагентами: 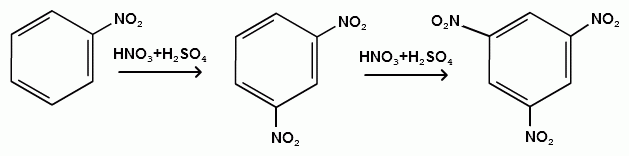 нитробензол 1,3-динитробензол 1,3,5-тринитробензол Гомологи бензола (толуол, ксилолы) нитруются легче, чем бензол, так как алкильные группы являются заместителями первого рода и облегчают течение реакций с электрофильными реагентами: 1,3,5-тринитробензол 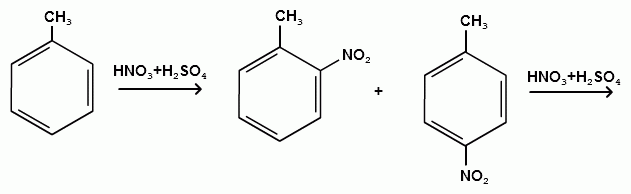 толуол орто-нитротолуол пара-нитротолуол 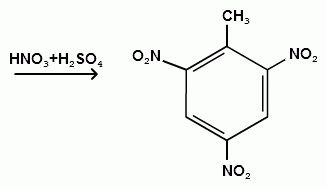 1,3,5-тринитробензол   1.2. Реакции сульфирования. При действии на бензол и его гомологи концентрированной серной кислотой или триоксидом серы атомы водорода в бензольном ядре замещаются на сульфогруппу: 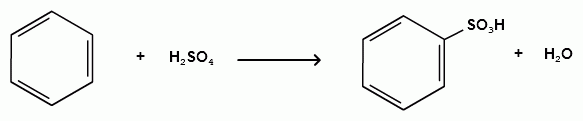 бензолсульфокислота Механизм реакции Сульфированию предшествует образование электрофильного реагента HSO+3 - гидросульфониевого иона: 3H2SO4 → Н3О+ + HSO+3 + 2HSO-4 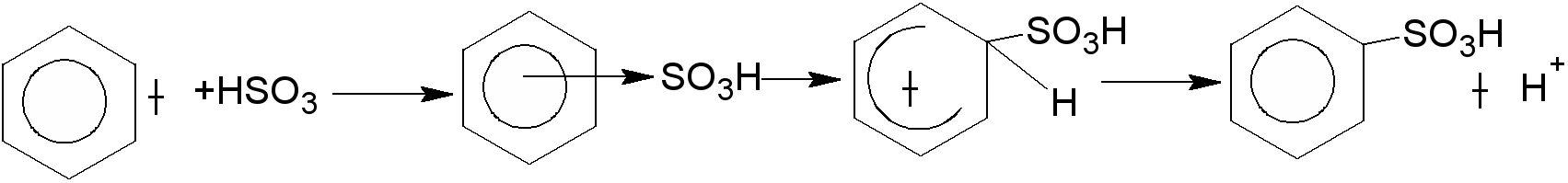 π-комплекс σ-комплекс H+ + HSO-4 → H2SO4 Еще более активным электрофильным реагентом является триоксид серы, в котором имеется дефицит электронной плотности на атоме серы: 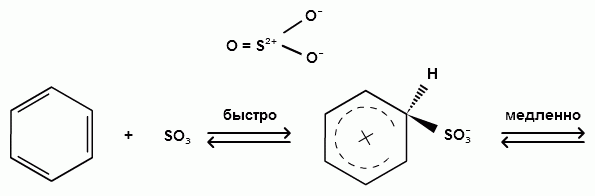 σ- комплекс биполярный ион 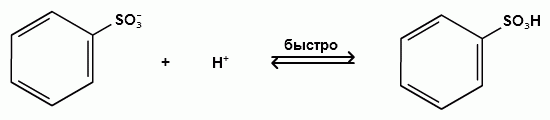 Гомологи бензола сульфируются легче, чем бензол, так как алкильные группы являются заместителями первого рода и облегчают течение реакций с электрофильными реагентами: 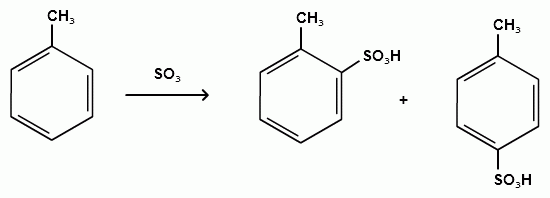 1.3. Реакции галогенирования. В присутствии катализаторов кислот Льюиса (AlCl3; AlBr3; FeCl3; FeBr3; ZnCl2) при комнатной температуре происходит замещение атомов водорода бензольного ядра на атомы галогена: 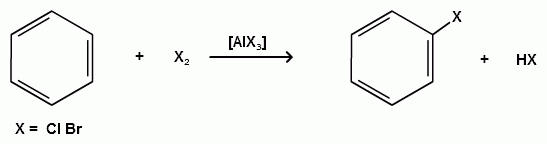 Причем хлор замещает водород в ароматическом ядре активнее брома, а осуществить иодирование и фторирование аренов практически не удается, вследствие недостаточной активности иода и чрезмерной активности фтора. Роль катализатора заключается в образовании или положительного иона галогена или комплекса галогена с кислотой Льюиса с поляризацией связи галоген-галоген: 1) образование положительного иона галогена: 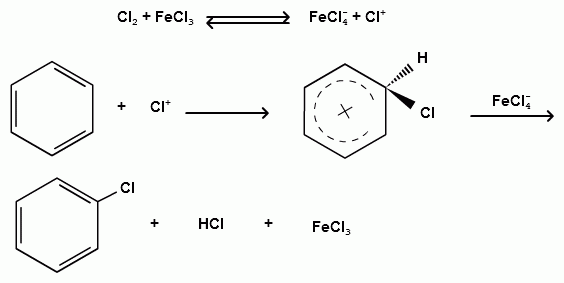 2) образование комплекса галогена с кислотой Льюиса с поляризацией связи галоген-галоген: 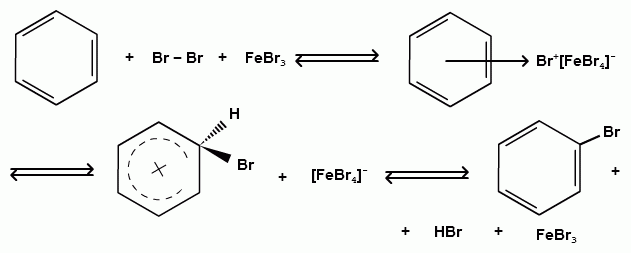 Дальнейшее галогенирование происходит с трудом, так как галогены затрудняют реакции с электрофильными реагентами, но являются орто- и пара-ориентантами: 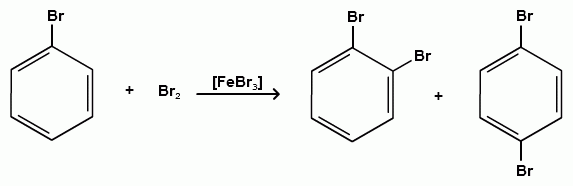 бромбензол 1,2-дибромбензол 1,4-дибромбензол Гомологи бензола галогенируются легче, чем бензол, так как алкильные группы являются заместителями первого рода и облегчают течение реакций с электрофильными реагентами: 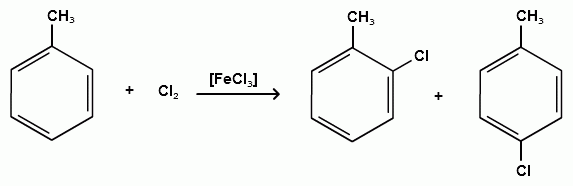 толуол орто-хлортолуол пара-хлортолуол 1.4. Реакции алкилирования по Фриделю-Крафтсу. Бензол и его гомологи в присутствии катализаторов кислот Льюиса (AlCl3; AlBr3; FeCl3; FeBr3; ZnCl2) легко алкилируются галогеналканами: 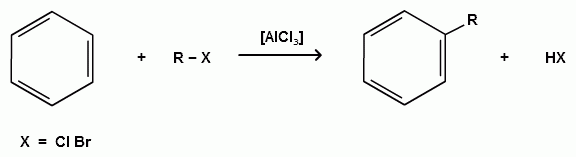 Катализатор кислота Льюиса при взаимодействии с галогеналканами образует или карбокатион, или комплекс галогеналкана с кислотой Льюиса с поляризацией связи углерод-галоген: 1) образование карбокатиона: 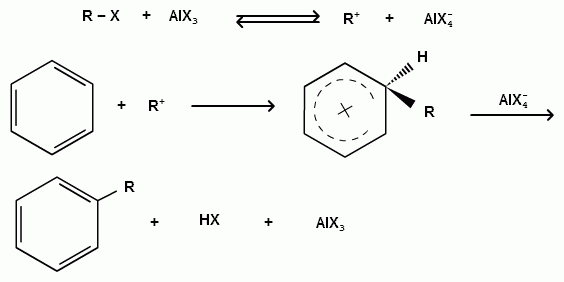 2) образование комплекса галогеналкана с кислотой Льюиса с поляризацией связи углерод-галоген: 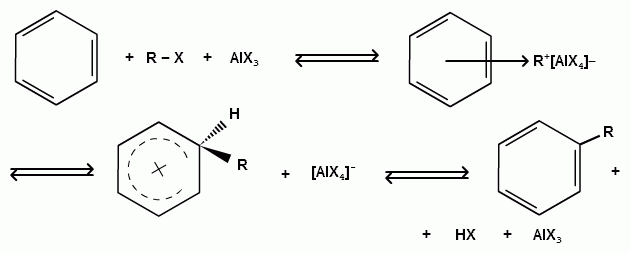 При алкилировании бензола первичными или вторичными галогеналканами образуется смесь изомерных алкилбензолов: 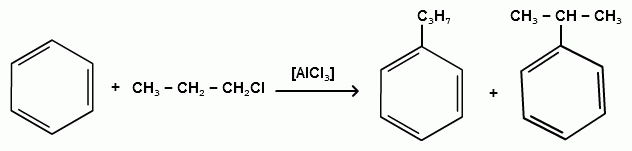 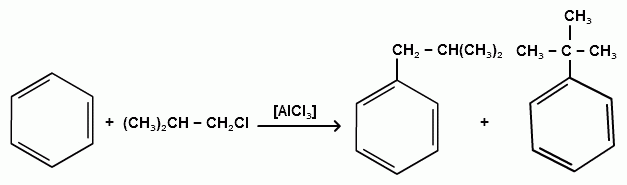 Это объясняется переходом менее устойчивого первичного карбокатиона в более устойчивый вторичный, а при соответствующих структурах - в более устойчивый третичный карбокатион. + СН3-СН2-СН2Cl + AlCl3 → CH3-CH2-CH+2 ↔ CH3-CH-CH3 + AlCl-4 +  (СН3)2СН-СН2Cl + AlCl3 → (CH3)2CH-CH+2 ↔ CH3-C-CH3 + AlCl-4 (СН3)2СН-СН2Cl + AlCl3 → (CH3)2CH-CH+2 ↔ CH3-C-CH3 + AlCl-4CH3 Для алкилирования аренов можно использовать также алкены и спирты в присутствии катализаторов - протонных кислот ( HF; H2SO4; H3PO4 и др.)    Гомологи бензола алкилируются легче, чем бензол, так как алкильные группы являются заместителями первого рода и облегчают течение реакций с электрофильными реагентами: 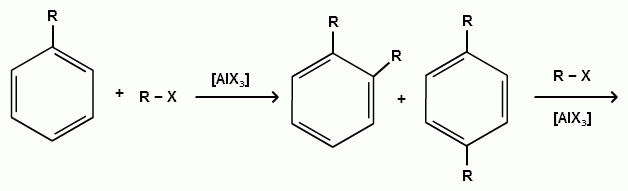 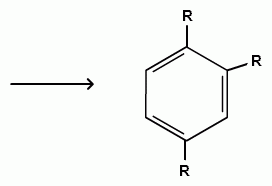 1.5. Реакции ацилирования по Фриделю-Крафтсу. Бензол и его гомологи в присутствии катализаторов кислот Льюиса (AlCl3; AlBr3; FeCl3; FeBr3; ZnCl2) легко ацилируются галогенангидридами с образованием ацилпроизводных - ароматических кетонов: 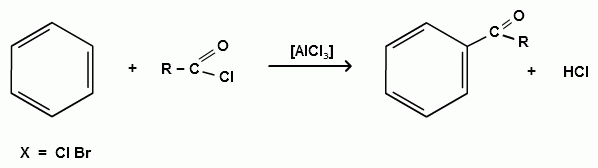 Катализатор кислота Льюиса поляризует молекулу ацилгалогенида, тем самым увеличивая ее электрофильность:  Реакция обычно ограничивается образованием моноацилпроизводных и не сопровождается перегруппировками в боковой цепи. 2. Реакции присоединения Арены с трудом вступают в реакции присоединения, которые характе-ризуют их как непредельные соединения. 2.1. Реакции гидрирования Бензол и его гомологи гидрируются трудно, только при повышенных температурах, давлении и в присутствии катализаторов гидрирования:  циклогексан В реакции гидрирования удается выделить только конечный продукт - циклогексан. Выделить промежуточные продукты (циклогексадиен, циклогексен) не удается, так как они гидрируются быстрее, чем бензол. 2.2. Присоединение галогенов Бензол под влиянием УФ-излучения присоединяет галогены с образованием гексагалогенидов, которые при дальнейшем нагревании отщепляют три молекулы галогенводорода с образованием тригалогенбензолов: 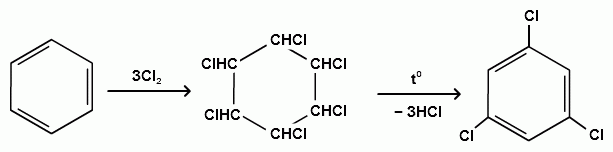 сим-трихлорбензол 2.3. Присоединение озона Бензол и его гомологи присоединяют озон с образованием триозонидов (взрывчатых веществ), гидролизом которых получают дикарбонильные соединения (глиоксаль, диальдегиды, кетоальдегиды), которые при последующем окислении пероксидом водорода дают карбоновые кислоты: 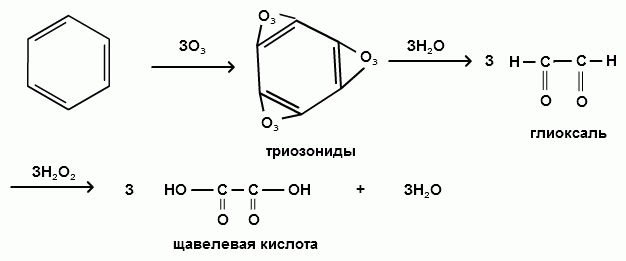 2.4. Окисление бензола. Устойчивость бензольного ядра к окислению является одним из важнейших свойств ароматических соединений. Это свойство отличает арены от алкенов. К окислителям бензол даже более устойчив, чем алканы. Такие окислители, как азотная кислота, перманганат калия, хромовая смесь, пероксид водорода при обычных условиях на бензол не действуют. Однако при очень энергичном окислении происходит разрушение бензольного ядра. Так, например, при действии на бензол кислородом воздуха в присутствии катализаторов (смесь оксидов ванадия и молибдена) и при высоких температурах (350-4500С) образуется малеиновый ангидрид: 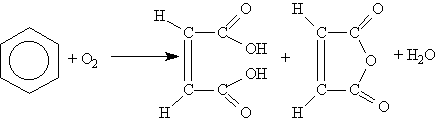 малеиновая малеиновый кислота ангидрид 3. Реакции гомологов бензола с участием боковой цепи 3.1. Реакции галогенирования. В отсутствии катализаторов при нагревании или освещении гомологов бензола происходит замещение атомов водорода в алкильных радикалах. В зависимости от количества галогена можно получить моно- и поли-галогенопроизводные: 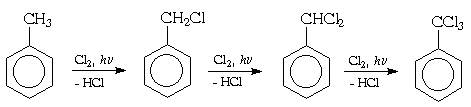 хлористый хлористый бензотрихлорид бензил бензилиден Реакция протекает по свободнорадикальному механизму: hʋ Сl2 → 2 Cl* 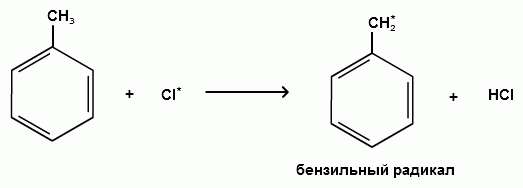 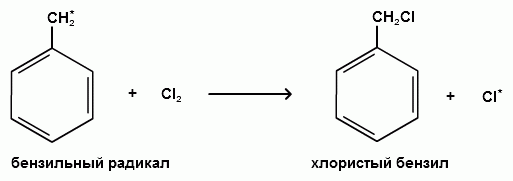 Бензильный радикал является очень устойчивым, так как неспаренный электрон значительно делокализован вследствие сопряжения с бензольным кольцом. 3.2. Реакции окисления. 3.2.1. Окисление кислородом воздуха. При действии высоких температур на гомологи бензола образуются свободные бензильные радикалы, которые легко реагируют с кислородом воздуха с образованием пероксидных радикалов, гидропероксидов и продуктов их дальнейшего превращения - альдегидов и карбоновых кислот. 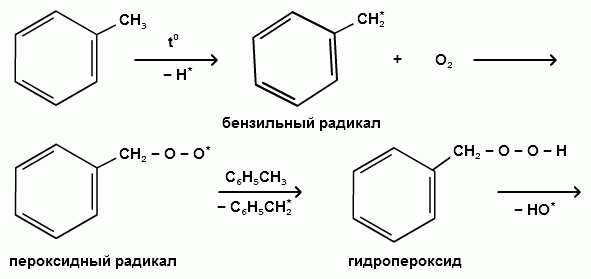 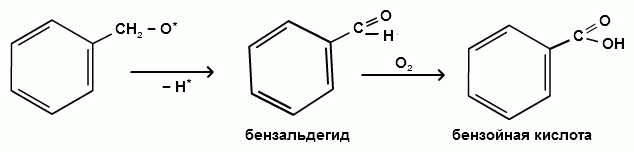 3.2.2. Окисление сильными окислителями. Окисление гомологов бензола такими сильными окислителями, как перманганат калия, дихромат калия приводит к образованию ароматических карбоновых кислот. При этом какой бы сложной ни была боковая цепь, она под действием сильных окислителей разрушается (“сгорает”) за исключением ближайшего к бензольному кольцу атома углерода, который окисляется в карбоксильную группу. 1) Гомологи бензола с одной боковой цепью при окислении дают одноосновные кислоты: 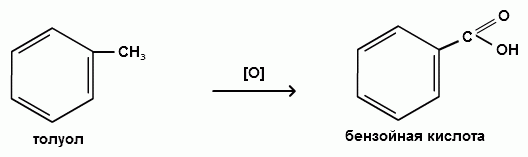 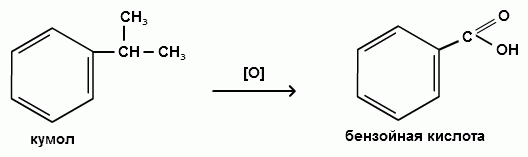 2) Гомологи бензола, содержащие две боковые цепи, при окислении дают двухосновные кислоты: 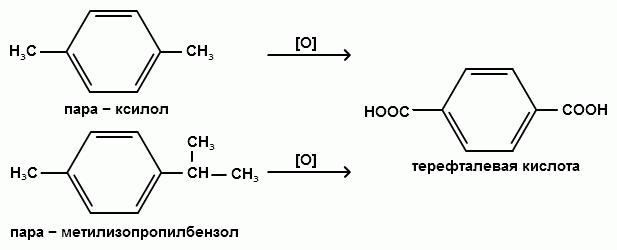 По образующимся в результате окисления ароматическим кислотам можно судить о положении боковых цепей и их числе. |
