скорость химической реакции. Тема практической работы Определение скорости химической реакции Цель
 Скачать 184.19 Kb. Скачать 184.19 Kb.
|
|
Тема практической работы: Определение скорости химической реакции Цель: установить влияние концентрации реагирующих веществ на скорость протекания химической реакции. Опыт 1. Определение скорости химической реакции. Исследуемая реакция (уравнение): Na2S2O3+H2SO4→Na2SO4+H2O+SO2↑+S↓ Таблица экспериментальных результатов: «Время протекания и скорость химической реакции»
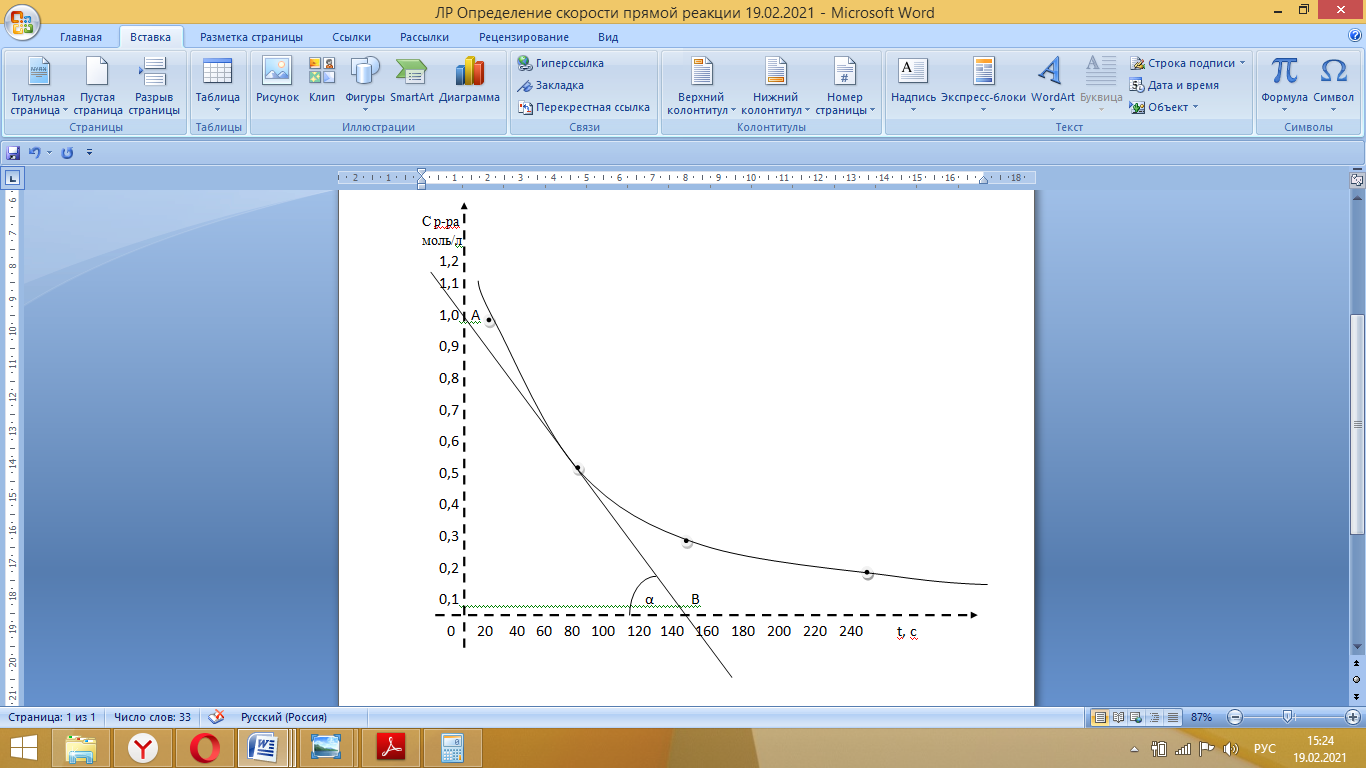 График зависимости времени реакции от концентрации раствора, на котором представлена касательная, угол наклона, точки пересечения с осями координат. Расчёт значения мгновенной скорости реакции: 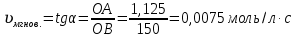 Выражение закона действующих масс для изучаемой реакции Na2S2O3+H2SO4→Na2SO4+H2O+SO2↑+S↓: 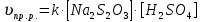 Вывод: чем больше концентрации исходного вещества (Na2S2O3), тем быстрее появляется осадок серы, то есть тем выше скорость химической реакции. Таким образом, скорость химической реакции в каждый момент времени прямо пропорциональна концентрациям реагентов, возведенным в степени, равные их стехиометрическим коэффициентам. |
