Теоретические сведения 1. Теоретическое введение
 Скачать 47.19 Kb. Скачать 47.19 Kb.
|
|
Теоретическое введение Термохимия – раздел физической химии, задачей которого является расчет тепловых эффектов при фазовых переходах и протекании химических реакций. Основой термохимии является закон Гесса: тепловой эффект процесса в изобарно-изотермических условиях (∆Н) и изохорно-изотермических (∆U) условиях не зависит от пути процесса и определяется только начальным и конечным состояниями системы. Для конкретных расчетов, например, тепловых эффектов химических реакций, используются следствия из закона Гесса. Следствие 1. Тепловой эффект реакции равен разности теплот образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов участников реакции. Например, для реакции: 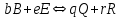 (1.1) (1.1) в изобарно-изотермических условиях 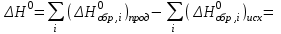 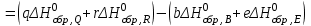 . (1.2) . (1.2)Величины стандартных теплот образования различных веществ 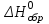 приведены в различных справочниках по химии и физической химии и в таблице 1.1. приведены в различных справочниках по химии и физической химии и в таблице 1.1.Таблица 1.1 Стандартные энтальпии образования веществ
Следствие 2. Тепловой эффект реакции равен разности теплот сгорания исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов участников реакции. Для реакции (1.1) в изобарно-изотермических условиях 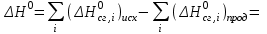 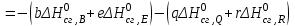 . (1.3) . (1.3)Второе следствие из закона Гесса обычно используется для тепловых расчетов органических реакций, т. к. большинство органических веществ можно сжечь до оксидов углерода и воды. В таблицах справочников приведены величины энтальпий образования и сгорания веществ ∆Н, поэтому для расчета тепловых эффектов реакций в изохорно-изотермических условиях, численно равных изменению внутренней энергии ∆U системы в ходе реакции, используют известную взаимосвязь этих величин: 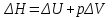 . (1.4) . (1.4)Если участниками реакции являются вещества в виде идеальных газов, то, по уравнению Менделеева – Клапейрона: 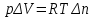 , (1.5) , (1.5)где ∆n – изменение количества вещества в системе при протекании реакции: 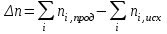 . .Здесь: 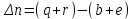 . (1.6) . (1.6)С учетом уравнения (1.5) уравнение (1.4) можно переписать: 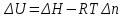 . (1.7) . (1.7)Из уравнения (1.4) следует, что разницу между ∆H и ∆U обеспечивает изменение объема системы ∆V в процессе. Следовательно, вещества в конденсированной фазе (жидкой или твердой), объем которых в процессах практически неизменен, не дают вклад в разность между ∆H и ∆U . Поэтому при подсчете ∆n по уравнению (1.6) стехиометрические коэффициенты веществ в конденсированной фазе приравниваются к нулю, т. е. не учитываются. 1.2.2. Решение типового задания Вычислить тепловой эффект реакции Al2O3(корунд) + 3SO3 → Al2(SO4)3(кр) при 298 К: 1) при Р = const; 2) при V = const. Решение 1. По первому следствию из закона Гесса для реакции в изобарно-изотермических условиях тепловой эффект по уравнению (1.2): 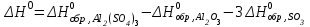 . .Подставляем из таблицы 1.1 численные значения энтальпий образования участников реакции: ∆Н0 = – 3434 + 1675 + 3×395,2 = –447,7 кДж/моль. 2. В изохорно-изотермических условиях тепловой эффект по уравнению (1.7): 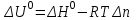 . (1.8) . (1.8)Здесь: 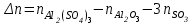 . .С учетом того, что Al2O3 и Al2(SO4)3 находятся в твердой фазе: 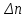 = 0 – 0 –3 = –3. = 0 – 0 –3 = –3.Отсюда, по уравнению (1.8): ∆U0 = –447,7 + 8,31× 10–3× 298 × 3 = –440,3 кДж/моль. Таблица 1.2 Индивидуальные задания
|
