|
|
Теория для С1 по химии. Теория для С1 по химии Перманганат калия как окислитель
Теория для С1 по химии
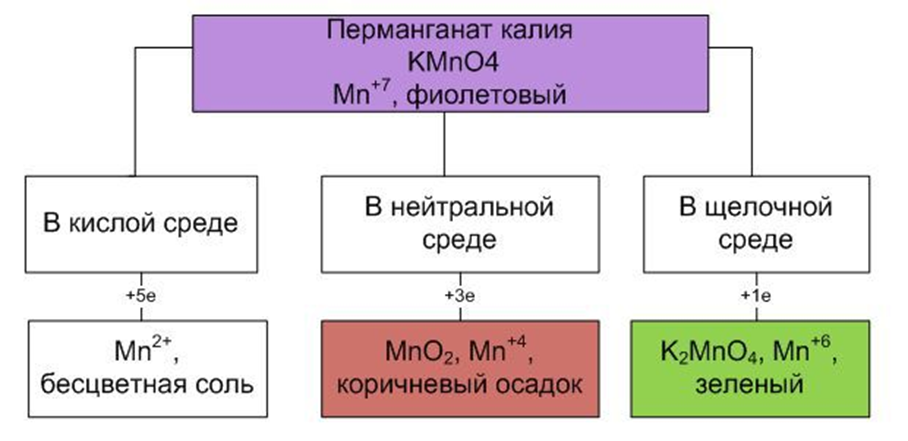
Перманганат калия как окислитель.
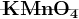 + восстановители + восстановители 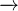
|
в кислой среде 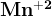
|
в нейтральной среде 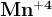
|
в щелочной среде 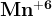
|
(соль той кислоты, которая участвует в реакции)
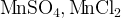
|
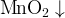
|
Манганат 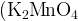 или или 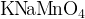 , , 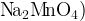
|
Дихромат и хромат как окислители.
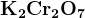 (кислая и нейтральная среда), (кислая и нейтральная среда), 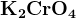 (щелочная среда) + восстановители (щелочная среда) + восстановители 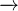 всегда получается всегда получается 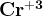
|
кислая среда
|
нейтральная среда
|
щелочная среда
|
Соли тех кислот, которые участвуют в реакции: 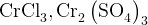
|
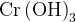
|
![\rm k_3[cr(oh)_6]](39420_html_m42a84fbf.png) в растворе, в растворе, 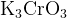 или или 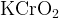 в расплаве в расплаве
|
Повышение степеней окисления хрома и марганца.
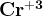 + очень сильные окислители + очень сильные окислители 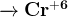 (всегда независимо от среды!) (всегда независимо от среды!)
|
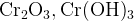 , соли, гидроксокомплексы , соли, гидроксокомплексы
|
+ очень сильные окислители:
а)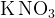 , кислородсодержащие соли хлора (в щелочном расплаве) , кислородсодержащие соли хлора (в щелочном расплаве)
б) 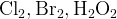 (в щелочном растворе) (в щелочном растворе)
|
Щелочная среда:
образуется хромат 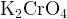
|
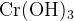 , соли , соли
|
+ очень сильные окислители в кислой среде 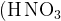 или или 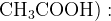 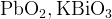
|
Кислая среда:
образуется дихромат 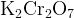 или дихромовая кислота или дихромовая кислота 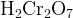
|
— оксид, гидроксид, соли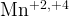
|
+ очень сильные окислители:
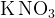 , кислородсодержащие соли хлора (в расплаве) , кислородсодержащие соли хлора (в расплаве)
|
Щелочная среда: 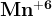
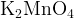 — манганат — манганат
|
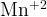 — соли — соли
|
+ очень сильные окислители в кислой среде 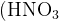 или или 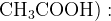
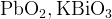
|
Кислая среда: 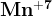
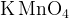 — перманганат — перманганат
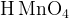 — марганцевая кислота — марганцевая кислота
|
Азотная кислота с металлами.
Чем активнее металл и чем меньше концентрация кислоты, тем дальше восстанавливается азот
|
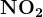
|
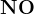
|
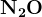
|
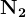
|
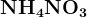
|
Неактивные металлы (правее железа) + конц. кислота
Неметаллы + конц. кислота
|
Неактивные металлы (правее железа) + разб. кислота
|
Активные металлы (щелочные, щелочноземельные, цинк) + конц. кислота
|
Активные металлы (щелочные, щелочноземельные, цинк) + кислота среднего разбавления
|
Активные металлы (щелочные, щелочноземельные, цинк) + очень разб. кислота
|
Пассивация: с холодной концентрированной азотной кислотой не реагируют:
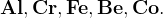
|
Не реагируют с азотной кислотой ни при какой концентрации:
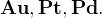
|
— не выделяется водород, образуются продукты восстановления азота.
Серная кислота с металлами.
— разбавленная серная кислота реагирует как обычная минеральная кислота с металлами левее 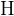 в ряду напряжений, при этом выделяется водород; в ряду напряжений, при этом выделяется водород;
— при реакции с металлами концентрированной серной кислоты не выделяется водород, образуются продукты восстановления серы.
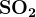
|
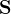
|
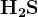
|
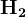
|
Неактивные металлы (правее железа) + конц. кислота
Неметаллы + конц. кислота
|
Щелочноземельные металлы + конц. кислота
|
Щелочные металлы и цинк + концентрированная кислота.
|
Разбавленная серная кислота ведет себя как обычная минеральная кислота (например, соляная)
|
Пассивация: с холодной концентрированной серной кислотой не реагируют:
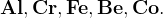
|
Не реагируют с серной кислотой ни при какой концентрации:
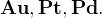
|
Диспропорционирование.
Реакции диспропорционирования — это реакции, в которых один и тот же элемент является и окислителем, и восстановителем, одновременно и повышая, и понижая свою степень окисления:
-
Диспропорционирование неметаллов — серы, фосфора, галогенов (кроме фтора).
Сера + щёлочь 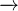 2 соли, сульфид и сульфит металла (реакция идёт при кипячении) 2 соли, сульфид и сульфит металла (реакция идёт при кипячении)
|
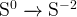 и и 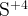
|
Фосфор + щелочь 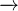 фосфин фосфин 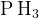 и соль гипофосфит и соль гипофосфит 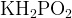 (реакция идёт при кипячении) (реакция идёт при кипячении)
|
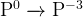 и и 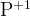
|
Хлор, бром, иод + вода (без нагревания) 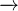 2 кислоты, 2 кислоты, 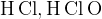
Хлор, бром, иод + щелочь (без нагревания) 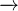 2 соли, 2 соли, 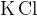 и и 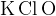 и вода и вода
|
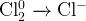 и и 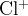
|
Бром, иод + вода (при нагревании)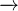 2 кислоты, 2 кислоты, 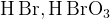
Хлор, бром, иод + щелочь (при нагревании)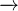 2 соли, 2 соли, 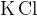 и и 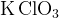 и вода и вода
|
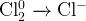 и и 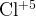
|
Диспропорционирование оксида азота (IV) и солей.
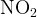 + вода + вода 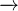 2 кислоты, азотная и азотистая 2 кислоты, азотная и азотистая
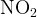 + щелочь + щелочь 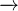 2 соли, нитрат и нитрит 2 соли, нитрат и нитрит
|
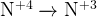 и и 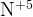
|
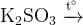
|
|
сульфид и сульфат калия
|
|
|
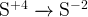 и и 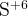
|
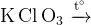
|
|
2 соли, хлорид и перхлорат 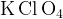
|
|
|
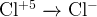 и и 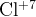
|

 |
|
|
 Скачать 1.18 Mb.
Скачать 1.18 Mb.


