Теория к ЛР 1 Растворы 20.09.20. Теория к Лабораторной работе Растворы Истинные растворы
 Скачать 73.94 Kb. Скачать 73.94 Kb.
|
|
Теория к Лабораторной работе «Растворы» Истинные растворы — однородная смесь двух и более веществ, с размером частиц менее 1 нм. Растворённое вещество присутствует в растворе в виде молекул, атомов или ионов. По количеству растворенного вещества, содержащегося в растворе, растворы делятся на насыщенные, ненасыщенные и пересыщенные. Насыщенным называется такой раствор, который находится в динамическом равновесии с избытком растворяемого вещества: сколько частиц вещества будет переходить в раствор в единицу времени, столько же частиц будет выделяться (переходить в осадок) из раствора. растворение, V1 О  садок Раствор V1=V2 садок Раствор V1=V2 кристаллизация, V2 В ненасыщенном растворе содержится меньше вещества,а в пересыщенном - больше, чем в насыщенном. Пересыщенные растворы весьма неустойчивы. Простое сотрясение сосуда или введение в раствор кристаллика соли вызывает выпадение в осадок избытка растворенного вещества. Важнейшей характеристикой любого раствора является его состав, который выражается концентрацией. Концентрация раствора — это относительное содержание любого компонента в растворе. Количество растворенного вещества в определенном массовом или объемном количестве раствора или растворителя. Для приблизительного выражения концентрации растворов используют термины концентрированный и разбавленный растворы. Концентрированный раствор содержит такие количества растворенного вещества, которые сравнимы с количеством растворителя. Например, в 100 г воды растворено 20 г поваренной соли. Это концентрированный раствор (20 и 100 сравнимые величины). Разбавленный раствор содержит очень малое количество растворенного вещества по сравнению с количеством растворителя. Например, в 100 г воды растворено 0,2 г поваренной соли. Это разбавленный раствор (0,2 г соли очень мало по сравнению со 100 г растворителя). Границы между концентрированными и разбавленными растворами условны. Существуют различные способы численного выражения концентрации растворов: массовая доля (ω), объемная доля (χ), молярность (CМ), нормальность или молярная концентрация эквивалента (Cн), моляльность (Cm), мольная доля (N), титр (Т) и т.д. 1. Процентная концентрация (массовая доля ω) раствора показывает, сколько грамм растворенного вещества содержится в 100 граммах раствора. Процентная концентрация – это безразмерная величина и выражается соотношением 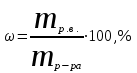 где ω – концентрация раствора, %; mр.в. – масса растворенного вещества, г; mр-ра – масса раствора, г. Пример: Найти процентную концентрацию раствора хлорида калия, содержащего 53 г КСl в 500 мл раствора. Плотность раствора ρ=1,063 г/мл. Решение: Масса раствора равна mр-ра = Vр-ра ∙ρр-ра= 1,063 г/мл∙500 мл = 531,15 г ω= 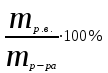 = = 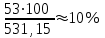 . .Процентная концентрация раствора КСl ω=10 %. 2. Молярная концентрация раствора (молярность) СМ (М) показывает число молей растворенного вещества в 1 л раствора. Молярная концентрация имеет размерность [моль/л], [M] и выражается формулой См= 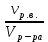 = =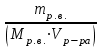 , моль/л, , моль/л,где νр.в. – число молей растворенного вещества. mр.в. – масса растворенного вещества, г; Мр.в. - молярная масса растворенного вещества, г/моль; Vр-ра - объем раствора, л. Пример: Найти массу NаОН, содержащегося в 0,2 л раствора, если молярная концентрация раствора равна 0,2 моль/л. Решение: Молярная масса NаОН, М(NаОН ) = 40 г/моль. mNaОН = См ∙М(NаОН )∙Vр-ра = 0,2 моль/л ∙40 г/моль ∙0,2л =1,6 г. 3. Моляльная концентрация раствора (моляльность) Сm(m) показывает число молей растворенного вещества в 1 кг растворителя. Размерность моляльной концентрации [моль/кг]: Сm = 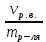 = = 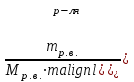 , моль/кг, , моль/кг,где νр.в. – число молей растворенного вещества. mр.в. – масса растворенного вещества, г; mр-ля – масса растворителя, кг; Мр.в. – молярная масса растворенного вещества, г/моль. Пример: В каком количестве эфира надо растворить 3,0 г анилина С6H5NH2, чтобы получить раствор, моляльность которого равна 0,3 моль/кг? Решение: М(С6H5NH2) = 93 г/моль. Масса растворителя (эфира) равна mр-ля = 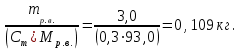 4. Нормальная или эквивалентная концентрация раствора, молярная концентрация эквивалента (нормальность) Сн (N) показывает число эквивалентов или моль-эквивалентов растворенного вещества в 1 л раствора ([экв/л]; [моль-экв/л]; [н]): 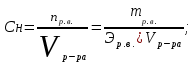 г-экв/л, г-экв/л,где nр.в. – число эквивалентов растворённого вещества; mр.в. – масса растворенного вещества, г; Эр.в. – эквивалентная масса растворённого вещества или масса одного эквивалента растворенного вещества, г/экв; или г/моль-экв. Vр-ра – объем раствора, л. Закон эквивалентов: Все вещества взаимодействуют между собой в соотношениях масс, пропорциональных их эквивалентам. Один эквивалент одного вещества всегда реагирует с одним эквивалентом другого вещества: 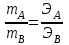 или или  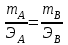 или nA = nB, или nA = nB,где mA и mB – массы взаимодействующих веществ А и В, г; ЭА и ЭВ – эквивалентные массы или молярные массы эквивалентов этих веществ, г/моль-экв; nA и nB – число эквивалентнов вещества А и вещества В. Эквивалент вещества – это целая часть формульной единицы вещества, которая в данной реакции химически равноценна 1 атому водорода. Эквивалентная масса вещества (Э) рассчитывается в общем случае по формуле 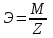 [г/моль-экв], где [г/моль-экв], гдеМ – молярная масса вещества г/моль, Z – фактор эквивалентности, определяется типом вещества и реакцией, в которой оно участвует. Для кислот в реакции нейтрализации Z равно числу протонов Н+, замещающихся на катионы металла. Для оснований в реакции нейтрализации Z равно числу гидроксогрупп (ОН)-, замещающихся на кислотные остатки. Для солей в реакциях обмена Z равно произведению числа катионов на заряд катиона. Связь между СМ и СН СН = Z∙СМ Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка: СН1∙V1 = СН2∙V2, Объемы растворов реагирующих веществ обратно пропорциональны их нормальностям. Пример: Определить нормальность раствора объёмом 300 мл, содержащего 32,44 г FеС13. Решение: Молярная масса эквивалента FеС13 равна ЭFeС13 = 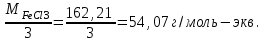 Молярная концентрация эквивалента раствора FeCl3 равна СН = 32,44 г : (54,07 г/моль-экв∙0,3 л) = 2,0 моль-экв/л, нормальность раствора СН = 2 н 5. Мольная доля (Ni) растворенного вещества и растворителя в растворе. Мольная доля Ni вещества в растворе равна отношению числа молей данного вещества к сумме чисел молей всех компонентов, содержащихся в растворе. Например, если раствор состоит из двух компонентов (растворитель (р-ль) + одно растворенное вещество (р.в.), мольные доли компонентов будут равны Nр.в.= 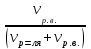 и Nр-ля= и Nр-ля=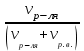 , ,где Nр.в. и Nр-ля – мольные доли растворителя и растворенного вещества соответственно; νр-ля – число молей растворителя; νр.в. – число молей растворенного вещества. 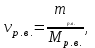 где mр.в. – масса растворенного вещества, г; где mр.в. – масса растворенного вещества, г;Мр.в. – молярная масса растворенного вещества, г/моль; 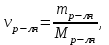 где mр-ля – масса растворителя, г; где mр-ля – масса растворителя, г;Мр-ля – молярная масса растворителя, г/моль; Пример: Рассчитать мольные доли глюкозы С6H12O6 и воды в 36%-ном водном растворе глюкозы. Решение: В 100 г 36%-ного раствора глюкозы содержится 36 г глюкозы и 64 г воды. Определяем число молей глюкозы и воды М(С6H12O6) = 180 г/моль; М(Н2O) =18г/моль: ν(С6H12O6) = 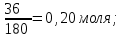 ν(Н2O) ν(Н2O)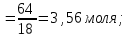 N(С6H12O6) = 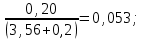 N(Н2О) = N(Н2О) = 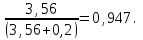 Сумма мольных долей компонентов раствора всегда равна 1. N(С6H12O6 ) + N(H2O) = 0,053 + 0,947 = 1,0. 6. Титр раствора (Т) показывает количество граммов растворенного вещества в 1 мл раствора. Размерность титра – [г/мл]. 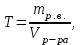 г/мл, г/мл, где mр.в. – масса растворенного вещества, г; Vр-ля – объем раствора, мл. Пример: Определить титр 0,01н КОН. Решение: В 1л раствора гидроксида калия с концентрацией Сн = 0,01н, (ЭKOH=56 г/экв) содержится m(KOH) = Сн∙ЭKOH∙Vр-ра = 0,01 экв /л∙56 г/экв∙1л = 0,56 г Титр этого раствора равен ТКОН = 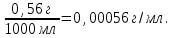 Вопросы к ЛР «Растворы» 1. Дать определение истинных растворов. 2. Дайте определение качественных характеристик растворов: насыщенные, ненасыщенные и пересыщенные, разбавленные и концентрированные, растворы. 3. Что выражает величина, называемая концентрацией раствора? 4. Дайте определение, указать размерность, записать формулу для расчёта следующих концентраций: - массовая доля или процентная концентрация по массе ω. - молярность СМ, - моляльность Сm, - нормальность Сн, - мольноя доля Nр.в., Nр-ля - титр Т, 5. Как перевести концентрацию раствора, заданную в одной из единиц измерения концентрации, в любую другую? Какая дополнительная информация при этом необходима? |
