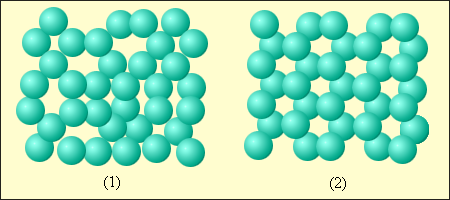8 Тепловые явления. Теория к разделу элементы содержания 8 (Тепловые явления)
 Скачать 78.44 Kb. Скачать 78.44 Kb.
|
|
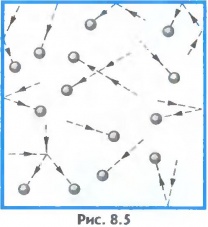
Теория к разделу «ЭЛЕМЕНТЫ СОДЕРЖАНИЯ № 8» (Тепловые явления) I Вещество состоит из частиц. Частицы беспорядочно (хаотически) и непрерывно движутся. Частицы взаимодействуют друг с другом силами притяжения и отталкивания. Молекула – наименьшая частица вещества, обладающая химическими свойствами данного вещества. (Простые одноатомные молекулы имеют размер порядка 10–10 м.) Атом – наименьшая частица, обладающая свойствами химических элементов, входящих в состав данного вещества. Движение молекул доказывают:
II Любое вещество при определенных условиях может находиться в различных агрегатных состояниях – твердом, жидком и газообразном.
Идеальный газ — математическая модель газа, в которой предполагается, что: потенциальной энергией взаимодействия частиц газа можно пренебречь по сравнению с их кинетической энергией; суммарный объём частиц газа пренебрежимо мал; между частицами нет дальнодействующих сил притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги. III Тепловые явления – явления, связанные с нагреванием или охлаждением тел. Тепловое движение - непрерывное хаотическое движение частиц вещества. Температура t, 0C: (термометр - прибор для измерения температуры) физическая величина, характеризующая состояние теплового равновесия системы тел: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру; физическая величина, характеризующая степень нагретости тела. Абсолютная температура обозначается буквой Т {\displaystyle T}ТТТттттЕ , измеряется в Кельвинах {\displaystyle (K)} К и отсчитывается по абсолютной шкале (Кельвина). Абсолютная термодинамическая шкала является основной шкалой в физике и в уравнениях термодинамики. Температура тела зависти от скорости движения молекул! Внутренняя энергия равна сумме кинетических энергий беспорядочного движения Ек и потенциальных энергий взаимодействия друг с другом Еп всех молекул тела: U= Екм +Епм, Дж зависит от температуры тела, агрегатного состояния и т. д.; не зависит ни от движения тела, ни от его положения. Внутренняя энергия тела может изменяться: при совершении работы (над телом U ↑, само тело U↓); без совершения работы - теплопередача - процесс изменения внутренней энергии без совершения работы. Способы теплопередачи:
IV Количество теплоты Q [Дж] - энергия, которую тело получает или теряет при теплопередаче.
Фазовый переход - переход из одного агрегатного состояния в другое. 1. Парообразование – процесс перехода вещества из жидкого состояния в газообразное. 2 способа:
2. Конденсация - переход вещества из газообразного состояния в жидкое (процесс возврата молекул пара в жидкость). 3. Плавле́ние — переход тела из кристаллического твёрдого состояния в жидкое. 4. Кристаллизация (отвердевание) — процесс перехода вещества из жидкого (газообразного) состояния в твёрдое кристаллическое с образованием кристаллической решетки. Вещества отвердевают при той же t , при которой плавятся! Динамическое равновесие между жидкостью и паром – состояние, при котором число молекул, покидающих жидкость за некоторое время, равно числу молекул, возвращающихся из пара в жидкость за то же время. Насыщенный пар - пар, находящийся в динамическом равновесии со своей жидкостью. Влажность воздуха - содержание водяного пара в воздухе. Измеряется психрометром. Характеризуют рядом величин: Парциальное давление водяного пара - давление, которое производил бы водяной пар, если бы все остальные газы отсутствовали. Относительная влажность воздуха - выраженное в процентах отношение парциального давления водяного пара, содержащегося в воздухе при данной температуре, к давлению насыщенного пара при той же температуре. 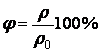 Точка росы - температура, при которой пар данного давления становится насыщенным (и относительная влажность становится равной 100%). |