фкх. ФКХ. Теория коагуляции длфо. Влияние электролитов на величину электрокинетического потенциала. Изолектролитическое состояние
 Скачать 89.52 Kb. Скачать 89.52 Kb.
|
|
ТЕОРИЯ КОАГУЛЯЦИИ ДЛФО. ВЛИЯНИЕ ЭЛЕКТРОЛИТОВ НА ВЕЛИЧИНУ ЭЛЕКТРОКИНЕТИЧЕСКОГО ПОТЕНЦИАЛА. ИЗОЛЕКТРОЛИТИЧЕСКОЕ СОСТОЯНИЕ. Разработана учёными Б.В. Дерягиным и Л.Д. Ландау в 1937 – 1941 гг. и позже независимо от них голландскими учёнными Фервеем и Овербеком. Теория удовлетворительно описывает закономерности поведения типично лиофобных дисперсных систем, для которых можно пренебречь адсорбционно-сольватным фактором устойчивости. Дерягин показал, что здесь проявляются силы особого рода, называемые расклинивающим давлением – результирующая межчастичного взаимодействия, возникает при сильном уменьшении толщины слоя в результате перекрывания поверхностных слоёв. Расклинивающее давление представляет собой дополнительное давление в слое между коллоидными частицами, когда толщина слоя дисперсионной среды достигает величины меньше 100 – 200 нм, и обусловлено силами отталкивания и притяжения. В соответствии теорией ДЛФО все частицы взаимодействую друг с другом следующим образом: 1. Между частицами существуют силы отталкивания, имеющие электростатическую природу. Эти силы не проявляются на значительном расстоянии друг от друга. Когда диффузные слои перекрываются, возникает электростатической взаимодействие между противоионами и происходит перераспределение. Природа сил отталкивания при сближении мицелл сложнее, чем просто кулоновское взаимодействие. Дерягин вычислил зависимость энергии отталкивания от расстояния между частицами, взяв за основу систему расчетов для двух пластин: 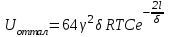 , ,где  l – расстояние между частицами; С – концентрация электролита; δ – толщина диффузного слоя; R – универсальная газовая постоянная; γ – параметр, зависящий от потенциала частиц, рассчитывается по формуле: l – расстояние между частицами; С – концентрация электролита; δ – толщина диффузного слоя; R – универсальная газовая постоянная; γ – параметр, зависящий от потенциала частиц, рассчитывается по формуле: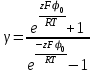 Энергия электростатического отталкивания может быть также рассчитана по следующей формуле: 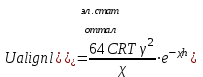 , ,где χ –обратная величина толщины диффузного ДЭС; h – расстояние между частицами, h=2l; 2. Силы притяжения между частицами (Ван-дер-Ваальсовы силы). Возникновение таких сил обусловлено: а) взаимодействием диполей - эффект Кеезома – если молекулы полярны, их дипольный момент описывается по формуле μ=ql, где q – величина эффективного заряда, l – расстояние между центрами тяжести положительного и отрицательного заряда в молекуле, то энергия взаимодействия между диполями – энергия ориентационного взаимодействия – описывается формулой: 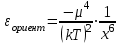 , ,где х – расстояние между диполями. б) поляризацией одной молекулы другой - эффект Дебая - наблюдается при взаимодействии между диполем и индуцированным диполем – возникает под действием стабильного диполя, называется энергией индукционного взаимодействия: 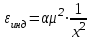 , ,где х – расстояние между диполями; α – поляризуемость частицы. в) взаимодействием мгновенных и индуцированных моментов – эффект Лондона – обусловлено электронными переходами, называется энергией дисперсионного взаимодействия: 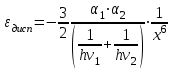 , ,где h – постоянная Планка; ν – волновое число; х – расстояние между диполями; α – поляризуемость частицы. В общем случае электрическое межмолекулярное взаимодействие определяется: 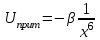 Поскольку коллоидная частица имеет определённый размер, то ДЭС можно представить как плоский, тогда 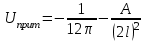 , ,где А – Ван-дер-ваальсовская постоянная – константа Гамакера, учитывает природу взаимодействующих частиц, выражается в единицах энергии и имеет значение порядка 10-19 Дж. При сближении частиц ионно-стабилизированных золей баланс возникающих сил отталкивания и Ван-дер-ваальсовых (межмолекулярных) сил притяжения определяет суммарную потенциальную энергию взаимодействия частиц. 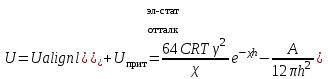 Уравнение справедливо для случая, когда толщина ДЭС меньше радиуса частиц, т.е. поверхность может рассматриваться как плоская. 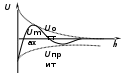 Рис. - Зависимость Uотт, Uприт и суммарной потенциальной энергии U от расстояния между частицами h При сближении частиц энергия притяжения резко возрастает, а суммарная потенциальная энергия на некотором расстоянии между частицами проходит через max. Umax – потенциальный барьер отталкивания, который характеризует агрегативную устойчивость золя. При увеличении концентрации электролита силы электростатического отталкивания уменьшается вследствие сжатия диффузных ДЭС частиц и потенциальный барьер отталкивания Umax снижается.  Рис. - Потенциальные кривые, характеризующие изменение энергии взаимодействия U двух коллоидных частиц от расстояния между их поверхностями h Кривая 1 – агрегативно устойчивый золь: потенциальный барьер отталкивания Umax достаточно высок, так что кинетической энергии при их столкновении недостаточно для его преодоления – коагуляция отсутствует. Кривая 2 и 3 – концентрация электролита увеличивается. По мере увеличения концентрации электролита Umax снижается, доля эффективных соударений растёт и скорость коагуляции увеличивается - медленная коагуляция. Кривая 4 отвечает наступлению быстрой коагуляции Umax=0, при любых расстояниях преобладают силы притяжения. Все столкновения эффективны, скорость коагуляции предельна. Таким образом, скорость коагуляции зависит от интенсивности коагулирующего воздействия: концентрация электролита, заряд коагулирующих ионов и др. 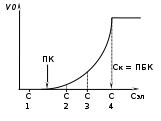 Рис. - Зависимость начальной скорости коагуляции от концентрации электролита-коагулянта. Вначале с увеличением концентрации скорость коагуляции растёт – медленная коагуляция, затем скорость перестаёт зависеть от концентрации электролита – быстрая коагуляция. Ск – концентрация электролита, при которой происходит переход от медленной к быстрой коагуляции, называется ПБК – порогом быстрой коагуляции. Экспериментально порог коагуляции можно определить несколькими методами: визуальным и оптическим. Для определения порога коагуляции оптическим методом готовят растворы в заданных объемах золя, воды и электролита. После смешивания растворов содержимое сразу выливают в кювету для измерения оптической плотности (D) и через минуту, считая от момента прибавления электролита к золю, определяют оптическую плотность. По данным (10 точек) строят график зависимости оптической плотности (D) от объема электролита (Vэл). Находят порог коагуляции для исследованного электролита как значения концентраций, при которых оптическая плотность золя достигает максимального значения и не изменяется при дальнейшем добавлении электролита. Расчет порога коагуляции проводят по формуле 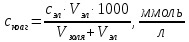 . .Распределение ионов в ДЭС, особенно в его диффузной части, является функцией концентрации электролитов в объеме раствора. Следовательно, концентрация электролита влияет на величину x-потенциала. По отношению к коллоидным растворам электролиты можно подразделить на индифферентные и неиндифферентные. В индифферентных электролитах отсутствуют ионы, которые могли бы специфически адсорбироваться на поверхности коллоидных частиц. Неиндифферентные электролиты содержат такие ионы. Введение в коллоидные растворы индифферентных солей сопровождается двумя явлениями: 1) ионным обменом между противоионами ДЭС и ионами добавленного электролита; 2) сжатием диффузной атмосферы вокруг поверхности частиц. В качестве примера рассмотрим процессы, происходящие при добавлении раствора NaNO3 к золю AgI с отрицательно заряженными частицами. В таком золе противоионами служат катионы K+. Между введенными ионами Na+ и противоионами ДЭС (K+) происходит ионный обмен. Взаимодействие ионов K+ и Na+ с ионами I‑, являющимися потенциалобразующими, примерно одинаково, поэтому их взаимный обмен подчиняется в основном закону действующих масс. Диффузный слой содержит смесь тех и других ионов. Однако здесь проявляется и другая сторона действия электролита, поскольку добавка электролита приводит к повышению ионной силы раствора. Согласно теории Дебая—Хюккеля, с повышением ионной силы раствора уменьшается толщина ионной атмосферы и происходит сжатие диффузной части ДЭС. При этом некоторое число противоионов переходит из диффузного слоя в адсорбционный. Следствием такого распределения противоионов является снижение величины x-потенциала (рис. 2 – кривая 1) 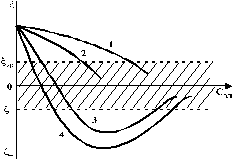 Рис. 2. Зависимость x-потенциала золя от концентрации введенных электролитов: 1 — NaNO3, 2 — Ca(NO3)2, 3 — Al(NO3)3, 4 — Th(NO3)4; заштрихованная область отвечает неустойчивому состоянию золя. Влияние электролитов усиливается, если в их составе имеются многозарядные ионы (Cu2+, Ca2+, Al3+, Th4+). Многозарядные катионы более активно взаимодействуют с отрицательными зарядами (в данном случае с ионами I‑). Вследствие этого такие ионы вытесняют ионы ионы K+ из диффузного и адсорбционного слоев в раствор, становясь на их место. При этом падение ξ-потенциала происходит быстрее, чем при действии однозарядных ионов (рис. 2 – кривая 2). При добавлении электролитов с ионами, имеющими заряд 3, 4 и более, может происходить не только снижение ξ-потенциала до нулевого значения, но и перемена знака заряда коллоидной частицы (рис. 2 – кривые 3,4). Это явление называют перезарядкой золей. Многозарядные катионы перезаряжают отрицательные золи, а многоосновные анионы - положительные золи. При перезарядке золей ξ-потенциал в какой-то момент времени принимает нулевое значение, при этом общий заряд коллоидной частицы тоже близок к нулю. В этом случае говорят, что коллоидная частица находится в изоэлектрическом состоянии. Явление перезарядки возникает из-за сверхэквивалентной адсорбции многозарядных ионов. |
