Кислотно-основное равновесие. Водородный показатель. Кислотноосновное равновесие. Водородный показатель Растворы электролитов, их свойства. Электролиты в организме человека
 Скачать 267.78 Kb. Скачать 267.78 Kb.
|
|
Кислотно-основное равновесие. Водородный показатель 1. Растворы электролитов, их свойства. Электролиты в организме человека Характеристика растворов электролитов. Значение электролитов для организма человека. Электролиты – вещества, подвергающиеся в растворах или расплавах электролитической диссоциации и проводящие электрический ток за счет движения электронов. К электролитам относятся вещества с ионной или сильнополярной ковалентной связью. К электролитам относятся соли, основания и кислоты. Электролиты являются проводниками второго рода. Передача электричества в них осуществляется движением положительных и отрицательных ионов, а в проводниках первого рода (металлах) – движением электронного газа. Сила электролита в значительной степени зависит от природы растворителя. Мерой воздействия растворителя является диэлектрическая проницаемость, значение которой для воды достаточно высоко и при 200 С составляет 81. Для воды, как для растворителя, свойство ослаблять химические связи между ионами выражено особенно сильно. Различают сильные и слабые электролиты. Сильные электролиты при растворении в воде полностью диссоциируют на ионы. К ним относятся: почти все растворимые соли (например, NaCl, CuSO4); многие неорганические кислоты (H2SO4, HNO3); гидроксиды щелочных и щелочноземельных металлов (NaOH, Ca(OH)2). Слабые электролиты при растворении в воде незначительно диссоциируют на ионы. К ним относятся: почти все органические кислоты (уксусная CH3COOH); некоторые неорганические кислоты (угольная Н2СО3, сернистая Н2S), многие гидроксиды, аммиак. Вода также является слабым электролитом. Деление электролитов на сильные и слабые в некоторой степени условно, т. к. оно отражает не свойства самих электролитов, а их состояние в растворе. Состояние электролитов в растворе зависит от ряда факторов: концентрации, природы растворителя, температуры, давления и др. По количеству ионов, на которые диссоциирует в растворе одна молекула, различают: бинарные, илиодно-одновалентные электролиты (КСl), одно-двухвалентные электролиты (CaCl2) и т. д. Свойства разбавленных растворов слабых электролитов описываются классической теорией электролитической диссоциации – процесса распада электролита на ионы при растворении его в воде.При растворении в воде веществ с ионной связью полярные молекулы воды притягиваются полюсами к положительно заряженным ионам вещества. В результате происходит снижение электростатического притяжения между ионами в кристаллической решетке и переход ионов в раствор. В организме постоянно происходит синтез, распад, окисление, выделение тех или иных химических веществ, что обеспечивает его жизнедеятельность, так как одним из признаков живого является постоянный обмен веществ и энергии с окружающей средой. Одним из основных (по количеству и значению) веществ, содержащихся в организме, является вода, в которой растворены другие химические соединения. Определяющее место среди них занимают электролиты. Физиологическая активность электролитов тесно связана с диссоциацией электролитов на ионы. Функции электролитов определяются свойствами их катионов и анионов и зависят от их концентрации. В организме человека роль электролитов чрезвычайно велика: а) осмотическое давление физиологических жидкостей (кровь, моча, спинномозговая жидкость и др.) определяется концентрацией находящихся в них ионов; б) свойства и функции белков определяются их амфотерностью и зависят от концентрации водородных и гидроксильных ионов ( Н+ и ОН-); в) сокращение мышц, нервная возбудимость, проницаемость клеток, окислительно-восстановительные процессы организма связаны с влиянием ионов электролитов; г) основное физиологическое условие нормального существования клетки – равенство осмотического давления внутри и снаружи клетки, что определяется концентрацией ионов электролитов. Степень и константа диссоциации. Закон разведения Оствальда. Константа диссоциации (Кд)– мера силы электролита в растворе. В зависимости от свойств растворителя, растворённое вещество может быть сильным электролитом, слабым электролитом, либо вообще не подвергаться диссоциации (неэлектролит). Если растворителем является вода, сила электролита определяется величиной константы диссоциации следующим образом: 1. Кд ˃ 10-2 – сильные электролиты (например, Н2SO4); 2. Кд ≈ 10-2 - 10-4 – электролиты средней силы (например, Н3РО4); 3. Кд<10-4 – слабые электролиты (например, Н2О). Амфотерные электролиты – электролиты, проявляющие в одном и том же растворителе свойства и кислоты и основания. Например, растворы Zn(OH)2, Al(OH)3, аминокислот. Константа диссоциации зависит только от природы растворителя, электролита и температуры, но не зависит от концентрации. Поэтому, для характеристики слабого электролита удобнее пользоваться константой диссоциации. Чем больше Кд, тем лучше данный электролит распадается на ионы, тем сильнее электролит. Степень диссоциации – отношение продиссоциировавших молекул Ni к общему числу молекул электролита в растворе N: 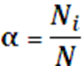 Cтепень диссоциации зависит от природы вещества и его концентрации в растворе. Степень диссоциации может принимать следующие значения: α = 0 – раствор не является электролитом; α = 1 – раствор является сильным электролитом; 0 < α << 1 – раствор является слабым электролитом. Степень диссоциации зависит от природы электролита и растворителя, температуры, присутствия в растворе других ионов и от концентрации. Закон разведения Оствальда Закон разведения Оствальда устанавливает связь между константой диссоциации Кд, степенью диссоциации α и концентрацией слабого электролита С. Уксусная кислота СН3СООН является слабым электролитом и диссоциирует по схеме: СН3СООН ↔ СН3СОО- + Н+ . Математическое выражение константы диссоциации данного процесса имеет вид: 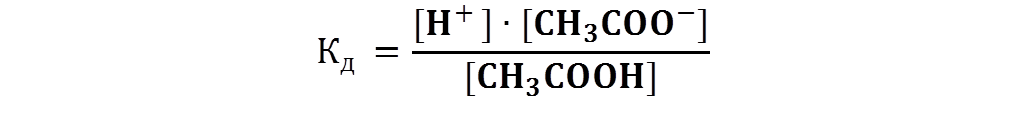 Пусть С – начальная концентрация кислоты СН3СООН, α – степень диссоциации электролита. Пусть С – начальная концентрация кислоты СН3СООН, α – степень диссоциации электролита.В момент равновесия: [Н+] = [СН3СОО-] = C∙ α. Концентрация продиссоциированных молекул составляет C∙ α. Соответственно концентрация непродиссоциированных молекул составляет: [СН3СООН] = С – C ∙ α = С(1–α). Подставив значения равновесных концентраций в выражение константы диссоциации, имеем следующее равенство: 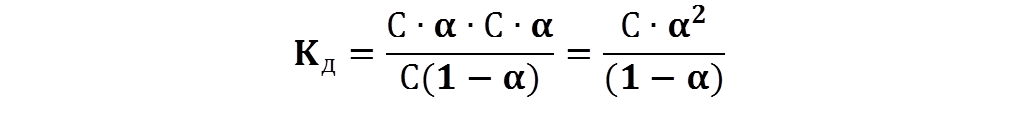 Данное равенство является математическим выражением закона разведения Оствальда: степень диссоциации увеличивается с уменьшением концентрации раствора электролита. Для очень слабых электролитов α˂˂1, следовательно, знаменателем можно пренебречь и математическое выражение закона разведения Оствальда принимает вид: Кд=C∙ α2. Отсюда, степень диссоциации равна:  Используя данное выражение, можно определитьвеличины [H+] и [А-] :  Закон разбавления Оствальда является частным случаем закона действующих масс. Свойства растворов сильных электролитов. Активность, ионная сила растворов сильных электролитов. Теория растворов сильных электролитов Разработана в 1923 г. П.Дебаем и С.Хюккелем. Основные положения теории растворов сильных электролитов. При разработке теории авторы исходили из следующих основных положений: 1. Электролиты в растворе полностью диссоциируют на ионы. 2. Все отклонения активности (а) от концентрации (С) обусловлены только кулоновскими силами взаимодействия между ионами. 3. Дебай и Хюккель ввели представление об ионной атмосфере в растворе электролита. 4. Авторы теории пренебрегали собственными размерами ионов, считая их точечными зарядами. Сильные электролиты в водных растворах полностью диссоциируют, т.е. степень диссоциации a = 1 или 100%. В связи с этим теория, созданная П.Дебаем и С.Хюккелем называется «теорией полной диссоциации». В растворах электролитов ионы взаимодействуют с полярными молекулами растворителя и образуются сольватные оболочки (гидратные оболочки, если растворитель – вода). Гидратные оболочки увеличивают размер ионов, в связи с чем уменьшается способность иона переносить электрический ток, участвовать в химических реакциях. Ионы взаимодействуют друг с другом и вокруг каждого гидратированного иона возникает “ионная атмосфера” из гидратированных ионов противоположного знака, что тормозит действие каждого иона. 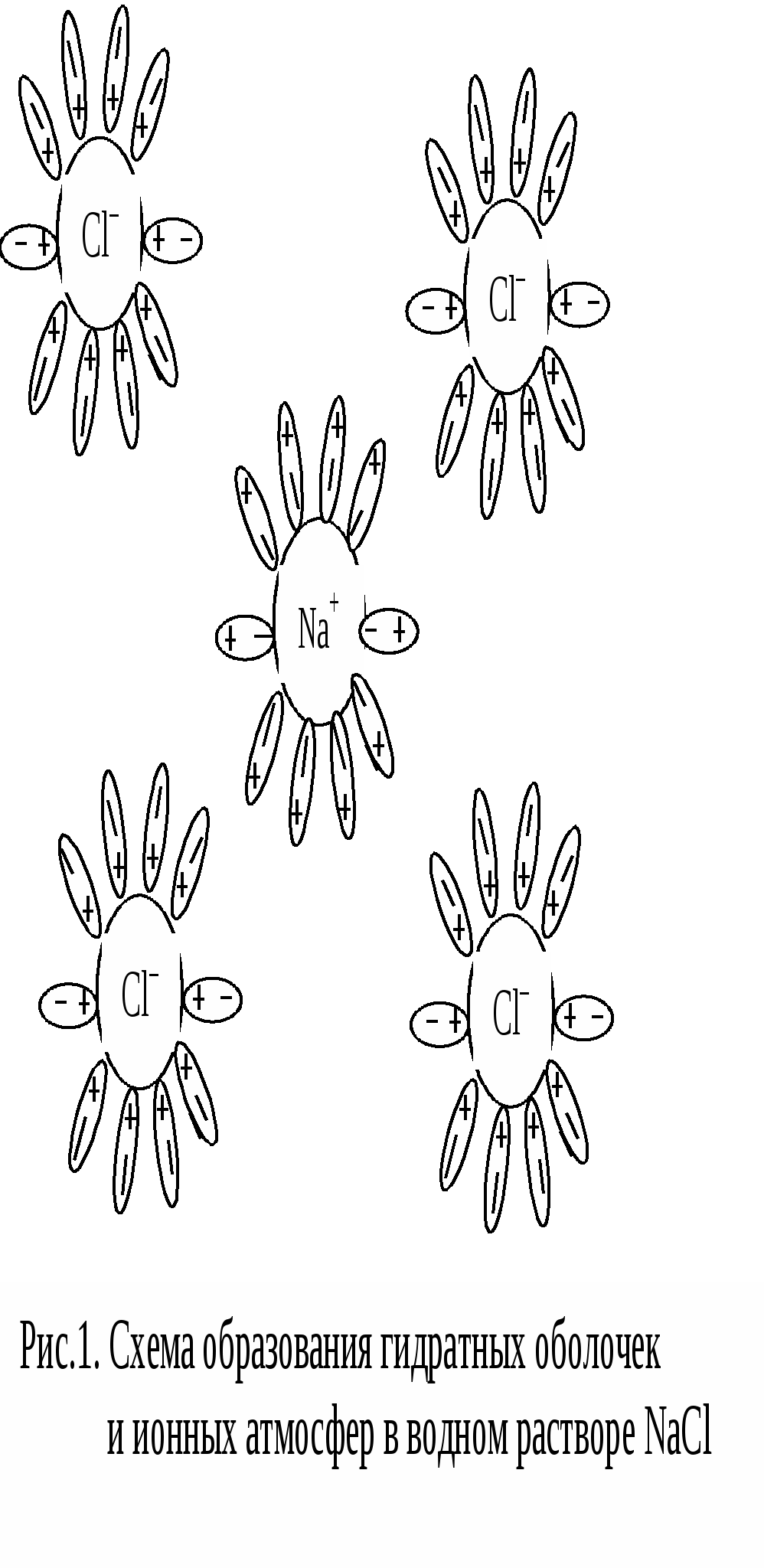 Сильные электролиты не подчиняются закону разбавления Оствальда. Константа диссоциации Кдсильных электролитов изменяется с изменением их концентрации. Сильные электролиты ведут себя в растворах так, как если бы они продиссоциировали не полностью. Это происходит за счёт наличия сил межионного притяжения. Степень диссоциации сильного электролита α, определяемая в эксперименте, называется кажущейся. Действительная степень диссоциации, которая называется активностью, определяется формулой: а = С∙ fа где а – активность; С – аналитическая концентрация; fа – коэффициент активности. При большом разведении а = С, так как fа = 1; во всех остальных случаях – f <1. Коэффициент активности fа зависит от величины заряда иона, природы растворителя, температуры и концентрации ионов. Расчет коэффициента активности ионов может быть произведен только на основании теоретических рассуждений. Например, исходя из предельного закона Дебая-Хюккеля, согласно которому коэффициент активности данного иона (катиона или аниона) в разбавленных растворах сильных электролитов определяется его зарядом и общей ионной силой раствора. Влияние силовых полей ионов на свойства разбавленных растворов описывает ионная сила раствораI. Понятие ионной силы раствора I было введено в теорию электролитов Льюисом (1921). Ионная сила раствора – полусумма произведений ионных концентраций в растворе на квадрат их валентности: где сi – моляльная концентрация ионов, входящих в состав раствора (моль/кг); z – валентность ионов. Между ионной силой раствора I и коэффициентом активности fа существует взаимосвязь: где z – заряд иона. Чем больше ионная сила раствора и величина заряда ионов, тем меньше коэффициент активности. Плазма крови человека близка к 0,15 моль/кг. 2.Теории кислот и оснований. Типы протолитических реакцийТеория кислот и оснований Аррениуса В соответствии с теорией кислот и оснований Аррениуса кислота – вещество, поставляющее при диссоциации в раствор ионы водорода: H2SO4 ↔ 2H+ + SO42- Основание по Аррениусу – вещество, поставляющее при диссоциации в раствор гидроксид-ионы: NaOH ↔ Na+ + OH- Протонная (протолитическая) теория кислот и оснований Бренстеда –Лоури Протонная теория кислот и оснований была разработана И.Бренстедом и Т.Лоури (1923 г) . Кислотно-основное (или протолитическое) равновесие – это равновесие в котором участвует протон (ион водорода Н+). При этом в равновесии участвуют вещества, способные отдавать и принимать протоны. В соответствие с протолитической теорией Бренстеда и Лоури все частицы, способные при ионизацииотщеплять протон, называются кислотами, все частицы, способные присоединять протон –основаниями. Кислоты и основания могут быть нейтральными молекулами или заряженными частицами (катионы и анионы). Примерами кислот в рамках этой теории являются: HCN (к) ↔ H+ + CN- (осн) HS- (к) ↔ H+ + S2- (осн) Примерами оснований: CN- (осн) + H+↔ HCN (к) NН3 (осн) + H+↔ NH4+ (к) Как видно из приведенных примеров, в результате отщепления протона от кислоты образуется частица, способная принимать протон (основание), а при присоединении протона к основанию образуется кислота. Такие кислоты и основания, находящиеся в кислотно-основном равновесии, называютсясопряженными, то есть HCN и CN- – сопряженные кислота и основание, аммиак и ион аммония – сопряженные основание и кислота. Некоторые вещества способны как отдавать, так и принимать протоны, то есть одновременно проявлять как кислотные, так и основные свойства: НСО3- ↔ Н+ + СО32- НСО3- + Н+↔ Н2СО3 Такие вещества называются амфолитами (амфотерными веществами). К амфолитам относится и вода, молекулы которой способны либо отдавать протоны: Н2О ↔ Н+ + ОН- (CN- + H2O ↔ HCN + OH-) либо присоединять их: Н2О + Н+ ↔ Н3О+ (HCN + H2O ↔ H3O+ + CN-) Обобщая вышеизложенное, сформулированы основные положения протонной теории Бренстеда – Лоури: 1. Кислоты – это нейтральные молекулы или ионы, способные отдавать протон (доноры протонов). Основания – это нейтральные молекулы или ионы, способные присоединять протон (акцепторы протонов). 2. В зависимости от партнера вещество может быть или основанием или кислотой. CH3COOH + H2O ⇄ СН3СОО — + Н3О+ кислота основание сопряжённое сопряжённая основание кислота NH3 + Н2О ⇄ NH4+ + OH- основание кислота сопряженная сопряженное кислота основание Кислота превращается в основание, которое называют сопряженным этой кислоте, основание превращается в сопряженную ему кислоту. 3. Протолитическая реакция — это перенос протона от кислоты к основанию. В любой протолитической реакции имеем две пары: кислота и сопряженное ей основание; основание и сопряженная ему кислота. НСl + NH3 ⇄ NH4+ + Cl- кислота 1 основание 2 сопряженная сопряженное кислота 2 основание 1 4. Протон в водных растворах существует в виде иона гидроксония Н3О+. Типы протолитических реакций Протолитические реакции сопровождаются переносом протона. 1. Реакция ионизации: HCl + H2O ⇄ H3O+ + Cl– кислота 1 основание 2 кислота 2 основание 1 2.Реакция нейтрализации: HCO3- + OH- ⇄ CO3- + Н2О кислота1 основание 2 основание1 кислота 2 3.Реакция гидролиза: СН3СОО– + Н2О ⇄ СН3СООН + ОН– основание 1 кислота 2 кислота1 основание 2 Классификация кислот. 1. Нейтральные кислоты: Н2О, HCl, H2SO4, HClO4 и другие. 2. Катионные кислоты: H3O+, (CH3)3HN+, NH4+. 3. Анионные кислоты: HSO4-, H2PO4-, HPO4- . Классификация оснований 1. Нейтральные основания: H2O, NH3, C2H5OH и другие. 2. Анионные основания: Cl- , CH3COO- , OH-. 3. Катионные основания: продукты неполного протонирования оснований, например, ион гидразиниум H2N–NH3+. Классификация растворителей Все растворители, согласно теории, делятся на апротонные и протолитические. Апротонные не содержат протонов и не могут служить донoрами протонов. К апротонным растворителям относятся CCl4, CS2. Протолитические растворители делятся на три группы: 1. Протогенные. Способны отдавать протоны. К ним относятся H2SO4, HNO3 и другие. 2. Протофильные. Способны принимать протоны. К ним относятся жидкий аммиак, амины и другие. 3. Амфипротонные. Способны принимать и отдавать протоны. К ним относятся H2O, C2H5OH и другие. Теория кислот и оснований Льюиса (апротонная или электронная) Теория Льюиса рассматривает кислоту как вещество, частичка которого является акцептором свободной пары электронов другой молекулы или иона для образования устойчивой электронной оболочки. К кислотам Льюиса относятся ион водорода и катионы металлов: H+, Ag+, Na+, Fe 2+; галогениды элементов второго и третьего периодов BF3, AlCl3, FeCl3, ZnCl2; галогены; соединения олова и серы: SnCl4, SO3). В соответствии с электронной теорией Льюиса основание – вещество, частичка которого является донором электронной пары, то есть обладающее свободной парой электронов. □BF3 + ꞉F- → [BF4]- □BF3 –кислота Льюиса; ꞉F- – основание Льюиса. Основаниями Льюиса являются спирты, алкоголят-анионы, простые эфиры, амины и т.д. Таким образом, основания Бренстеда и Льюиса – это одни и те же частицы. Однако основность по Бренстеду есть способность присоединять только протон, в то время как основность по Льюису – понятие более широкое и означает способность к взаимодействию с любой частицей, имеющей низколежащую свободную орбиталь. 3. Кислотно - основное равновесие. Водородный показатель биологических жидкостей Диссоциация воды. Ионное произведение воды. Водородный показатель. Вода – слабый амфотерный электролит, диссоциация которого протекает по схеме: Н2О ↔ Н++ ОН- Диссоциация молекул воды характеризуется концентрационной константой диссоциации, которая имеет вид:  Считая, что в большинстве растворов вода находится в молекулярном виде (концентрация ионов H+ и OH− мала), и учитывая, что молярная масса воды составляет 18,0153 г/моль, а плотность при температуре 25 °C — 997,07 г/л, чистой воде соответствует концентрация [H2O] = 55,346 моль/л. Поэтому предыдущее уравнение можно переписать в виде: [H+] ∙ [OH-] = 10-14 (моль/л) При температуре 298 K (250С) значение Kд = 1,8 ∙ 10-16, а молярная концентрация воды в чистой воде: 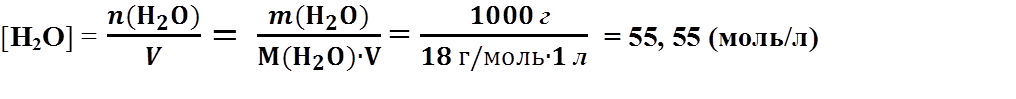 Следовательно, Кw = K∙ [H2O] = [H+] ∙ [OH-] = 10-14 , т.е. [H+]∙[OH-] = 10-14 (моль/л). Данная величина Кw называется ионным произведением воды. Так как для чистой воды [H+] = [OH−] , можно записать [H+] = [OH-] = 10-7 (моль/л). Водородный показатель воды, таким образом, равен: рН = –lg[H+] = 7,0. Величина KW называется константа автопротолиза воды или ионное произведение воды. При повышении температуры степень ионизации воды увеличивается и значение константы автопротолиза растет. Если для величин, входящих в выражение ионного произведения воды, использовать их показатели (отрицательные десятичные логарифмы), то получим: lg KW= lg [H+] + lg [OH-] –lg KW= –lg [H+] + –lg [OH-] pKW= pH + pOH = 14, где pH = –lg [H+] – водородный показатель, pOH = –lg [OH-] – гидроксильный показатель. В чистой воде, где концентрации ионов водорода и гидроксида одинаковы, то есть [H+] = [OH-] = 10-7, имеем нейтральную среду (рН = 7); в кислых водных растворах [H+] >10-7 (рН < 7), в щелочных – [H+] <10-7 (рН > 7). Таким образом, величина рН может использоваться для характеристики кислотности среды: еслирН < 3 – раствор сильнокислый, при 4<рН <7 – слабокислый; для слабощелочных растворов характерно значение рН от 7 до 10, а для сильнощелочных – рН >11. Для точного определения рН различных жидкостей, в том числе биологических, в лабораториях применяются pH-метры и иономеры. pH-метр – прибор для измерения водородного показателя (показателя pH), характеризующего активность ионов водорода в растворах, воде, биологических жидкостях, пищевой продукции и сырье, объектах окружающей среды и производственных системах непрерывного контроля технологических процессов, в том числе в агрессивных средах. В частности, pH-метр применяется для аппаратного мониторинга pH растворов разделения урана и плутония. Иономеры предназначены для измерения активности и концентрации более чем 26 химических элементов и соединений в водных растворах. Иономеры используются в лабораториях для выполнения точных и ответственных измерений. Благодаря расширенным функциональным возможностям по измерению pH, а также концентрации и активности нитратов, иономеры очень удобно использовать как лабораторные pH - метры, нитратомеры. Кислотно-основное титрование. Теория кислотно-основных индикаторов. Метод кислотно-основного титрования основан на связывании катионов Н+ анионами ОН- . Он позволяет определять в растворах не только концентрацию кислот или оснований, но и концентрацию гидролизующихся солей.Для количественного определения кислот и солей, дающих при гидролизе кислую реакцию, используют рабочие титрованные растворы щелочей (алкалиметрия), а для анализа щелочей и солей с щелочной реакцией применяются рабочие титрованные растворы кислот (ацидиметрия). В качестве рабочих титрованных растворов обычно применяются растворы сильных кислот (НСl или H2SO4) и щелочей (NaOH и KOH). Процесс титрования изображают графически в виде кривых титрования, которые позволяют наглядно представить весь ход титрования и выбрать индикатор, наиболее пригодный для получения точных результатов, т.к. кривую титрования можно сопоставить с интервалом изменения окраски индикатора. Окончание реакции (точка эквивалентности) фиксируется по изменению окраски индикатора (лакмус, метиловый оранжевый, фенолфталеин и др.). Индикаторы представляют собой органические красители сложного строения со слабыми кислотными кислотными или основными свойствами, легко меняющие свою окраску в зависимости от кислотности или щелочности среды. Кислотно - основные индикаторы (Ind) – сложные органические соединения, которые в растворах изменяют окраску в зависимости от реакции среды, то есть от концентрации [H+]. Окраска индикаторов обусловлена наличием хромофорных групп, таких как –N=N–, хиноидной группы и др. Индикаторы делятся на 2 типа: а) одноцветные – имеют только одну окраску в кислой и в щелочной среде (фенолфталеин, различные нитрофенолы и др.); б) двухцветные – имеют различную окраску в кислой и щелочной средах (метиловый красный, лакмус и др.). По химической структуре индикаторы (Ind) представляют собой слабые кислоты (НInd) или слабые основания (IndОН). В зависимости от рН среды раствора они могут диссоциировать или недиссоциировать на ионы, изменяя окраску среды. Так, например, кислотные индикаторы НInd в кислой среде не диссоциируют на ионы: (НInd) → - раствор остаётся окрашенным в красный цвет; кислотные индикаторы в щелочной среде диссоциируют на ионы: (НInd ↔ Н+ + Ind-) – раствор приобретает жёлтое окрашивание. Основные индикаторы, напротив, в кислой среде диссоциируют на ионы (IndОН↔Ind++ ОН-), в щелочной – не диссоциируют. Промежуток между двумя значениями рН, при котором происходит постепенное изменение окраски индикатора, называется интервалом перехода или зоной перемены окраски индикатора. Таким образом, определяя точку эквивалентности титрования кислот и оснований с различными индикаторами, титрование заканчивается при различных значениях рН. Зона перемены окраски, а следовательно, и показатель титрования, зависят от природы индикатора. На рисунке приведены ориентировочные данные о существовании разных цветных форм индикаторов в водных растворах. 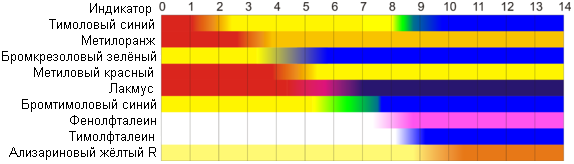 Рис.2. Интервалы перехода цвета индикаторов Индикаторы применяются: а) для определения конца титрования при определении кислотности желудочного сока, а также содержания кислот и щелочей в различных растворах; б) для колориметрического определения рН биологических жидкостей; в) для качественного определения кислотности или щелочности среды. Для всех этих целей индикаторы применяют в виде водных или спиртовых растворов или в виде специальных индикаторных бумажек (полоски фильтровальной бумаги, пропитанные растворами индикаторов). Водно-электролитный баланс организма. Значение рН биологических жидкостей. Общеизвестно, что неотъемлемой частью гомеостаза является водно-электролитный обмен. При различных заболеваниях концентрация воды и электролитов может меняться — увеличиваться либо уменьшаться. Общее содержание воды в организме человека составляет 60–65%, т. е. приблизительно 40–45 л; 2/3 количества воды приходится на внутриклеточную жидкость, 1/3 — на внеклеточную. Регуляция обмена воды и электролитов взаимосвязаны. Основные катионы организма — натрий, калий, кальций, магний. Анионы — хлор, гидрокарбонат, фосфаты, сульфат. Концентрацию электролитов в Международной системе единиц (СИ) выражают в ммоль/л. Имеются значительные различия в количественном распределении электролитов между внутри- и внеклеточной жидкостями. Во внеклеточной жидкости представлены в основном ионы натрия, хлора, гидрокарбоната. Во внутриклеточной жидкости — более высокие концентрации ионов калия, магния, фосфатов и сульфата. Электролиты выполняют в организме следующие функции: отвечают за осмолярность жидкостей тела, образуют биоэлектрический потенциал, катализируют процессы обмена веществ, определяют рН жидкостей тела, стабилизируют костную ткань, служат в качестве «энергетического депо», участвуют в свертывании крови, обладают иммунотропной активностью. Для постановки окончательного диагноза и выбора метода терапии необходимо установить вид и степень изменений обмена воды и электролитов, поскольку клиническая картина отдельных нарушений не имеет характерных признаков. Для определения концентрации электролитов используют следующие методы исследования: пламенная фотометрия, ионометрический (потенциометрический) и фотометрический. Несмотря на то, что физиологические функции натрия и калия в организме различны, для их изучения используются одинаковые физические принципы. Электролиты в жидких средах организма специфичны по своему количественному и качественному составу. Из катионов плазмы натрий занимает ведущее место и составляет 93% всего их количества. Среди анионов следует выделить прежде всего хлор. Сумма катионов и анионов практически одинакова, т. е. система электронейтральна. Таким образом, постоянство рН внутренних сред организма определяется посредством: а) физиологических систем (почки, печень, лёгкие, кишечник); б) физико-химических (буферные системы организма). Различают три вида кислотности в биологических жидкостях:
Постоянство концентрации водородных ионов является одной из существенных констант внутренней среды организмов. Так, кислотность плазмы артериальной крови человека колеблется в пределах от 7,35 до 7,45 рН, составляя в среднем 7,4 рН. Кислотно-щелочное равновесие в крови человека является одним из самых стабильных параметров, поддерживающее кислые и щелочные компоненты в определенном равновесии в очень узких границах. Даже небольшой сдвиг от указанных пределов может привести к тяжелой патологии. При сдвиге в кислотную сторону возникает состояние, называемое ацидозом, в щелочную — алкалозом. Изменение кислотности крови выше 7,8 рН или ниже 6,8 рН несовместимо с жизнью. Кислотность венозной крови — 7,32–7,42 рН. Кислотность эритроцитов составляет 7,28–7,29 рН. Активность разнообразных биологических катализаторов (фер ментов), а нередко и специфика происходящих в тканях биохимических процессов связаны с ограниченными зонами значения рН. Например, пепсин желудочного сока активен при рН 1,5 — 2,1 каталаза крови — при рН 7,0; тканевые катепсины при реакции среды, близкой к нейтральной, катализируют синтез белка, а pH кислой реакции его расщепляют. У здорового человека при нормальном питьевом режиме и сбалансированном питании кислотность мочи находится в пределах от 5,0 до 6,0 рН, но может колебаться от 4,5 до 8,0 рН. Кислотность мочи новорожденного в возрасте до месяца в норме — от 5,0 до 7,0 рН. Кислотность мочи повышается, если в рационе человека преобладает мясная пища, богатая белками. Увеличивает кислотность мочи тяжелая физическая работа. Молочно-растительная диета приводит к тому, что моча становится слабощелочной. Повышение кислотности мочи отмечается при повышенной кислотности желудка. Пониженная кислотность желудочного сока не влияет на кислотность мочи. Изменение кислотности мочи чаще всего соответствует изменению кислотности крови. Кислотность мочи изменяется при многих заболевания или состояниях организма, поэтому определение кислотности мочи является важным диагностическим фактором. Кислотность жидкостей внутри человеческого организма в норме совпадает с кислотностью крови и находится в пределах от 7,35 до 7,45 pH. Кислотность некоторых других биологических жидкостей человека в норме приведена в таблице 1: Таблица 1. Интервал значений рН важнейших биологических жидкостей.
Целый ряд патологических процессов, протекающих в организме, может приводить к изменению рН некоторых биологических жидкостей. Поэтому определение рН биологических жидкостей (желудочный сок, моча и др) используются при диагностике и контроле за эффективностью терапии. Определение реакции среды и знание концентрации ионов Н+ в биожидкостях часто является необходимым в биохимических исследованиях (исследование активности ферментов). Задания по теме: Сильные и слабые электролиты. Протолитические равновесия. рН1. Приведите определение кислоты по теории Аррениуса. Запишите уравнение диссоциации H2SO3 по стадиям и общее выражение константы диссоциации. 2. рН водного раствора уксусной кислоты равно 4. Рассчитайте концентрацию ионов ОН- и укажите характер среды данного раствора. 3. Дайте определение основанию согласно теории Льюиса. Приведите пример данного основания и запишите формулу сопряженной с ним кислоты. 4. Водный раствор аммиака характеризуется величиной рОН=6. Рассчитайте концентрацию ионов Н+ и укажите характер среды данного раствора. 5. Запишите определение кислоты, принятое в теории Бренстеда-Лоури. Приведите пример, запишите уравнение взаимодействия приведенной кислоты с основанием в рамках данной теории. 6. Рассчитайте значение рН водного раствора, мольное содержание ионов ОН- в котором составляет 1∙10-5 моль/л. Определите характер среды данного раствора. 7. Запишите уравнение диссоциации воды. Выражение константы диссоциации данного процесса, а так же выражение ионного произведения воды. 8. Молярная концентрация ионов Н+ в водном растворе органической кислоты равна 1∙10-6 моль/л. Вычислите величину рОН и укажите характер среды данного раствора. 9. Приведите определение основанию согласно теории Аррениуса. Запишите диссоциацию Fe(OH)2 по стадиям и общее выражение константы диссоциации. 10. Водный раствор пропионовой кислоты имеет значение рН=5. Рассчитайте молярную концентрацию ионов ОН- в данном растворе и укажите характер среды данного раствора. |
