водородный показатель. Исправление Лабораторная работа №1 Водородный показатель Шатерни. Водородный показатель
 Скачать 2.26 Mb. Скачать 2.26 Mb.
|
|
Министерство образования и науки Российской Федерации Государственное образовательное учреждение высшего профессионального образования «НОВГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИМЕНИ ЯРОСЛАВА МУДРОГО» Институт сельского хозяйства и природных ресурсов Отделение естественных наук и природных ресурсов Кафедра фундаментальной и прикладной химии Лабораторная работа Вартант№3 Водородный показатель Выполнил: Студент гр.0042зу Шатерников Е.А. Проверил: Телешова Е.Н. Великий Новгород 2022г Отчет о лабораторной работе по теме: «Водородный показатель» Цель работы: изучить способы расчета рН растворов электролитов и освоить методы экспериментального определения рН растворов. Задание по вариантам: определить различными экспериментальными методами рН растворов, выданных в соответствии с вариантом 3. Оборудование и реактивы: пробирки, стеклянная палочка, колба, рН-метр, индикаторы: фенолфталеин, метиловый оранжевый, универсальный индикатор. Растворы для исследования (в соответствии с вариантом задания): 1)NaOH 0,1 Н 2)NH4OH 0,5H 3)H2С2O4 0,1 H 4) HCl 0,1H 5) Na2CO3 2,65% Ходработы. 1. Определили окраску индикаторов фенолфталиена и метилового оранжевого в растворах пяти электролитов согласно варианту задания. Для этого наливали в пять пробирок по 1мл раствора и добавляли в каждую пробирку 1-2 капли фенолфталеина. Затем повторили опыт с использованием метилового оранжевого. 2. Выполнили приближенное определение рН растворов с помощью универсальной индикаторной бумаги. Для этого наносили 2-3 капли исследуемого раствора на универсальную индикаторную бумагу и сравнивали окраску влажных пятен с цветной шкалой. 3. Определили значение рН одного из растворов (раствора без указания его количественного состава) электрохимическим методом – с помощью прибора рН-метра. Для этого налили небольшое количество раствора в небольшой стаканчик и опустили в раствор электроды прибора. Результаты наблюдений и измерения внесли в таблицу 1 «Результаты исследования рН растворов электролитов»      Таблица 1 - Результаты исследования рН растворов электролитов
4.Для электролитов, количественный состав которых приведены не в виде молярной концентрации, привели пересчет данной концентрации или доли в молярную: 5. Написали уравнения электролитической диссоциации сильных и слабых электролитов: Гидроксид натрия – сильный электролит, диссоциация полная NaОН → Na+ + ОН- Хлорная кислота– сильный электролит, диссоциация полная HCl → H+ + Cl- Карбонат натрия– сильный электролит, диссоциация полная Nа2CО3 → 2Na+ + CО3- Слабые электролиты Гидроксид аммония – слабый электролит NH4OH ↔ NH4+ + OH- Щавелевая кислота – слабый электролит, диссоциация обратимая протекает в две ступени 1 ступень Н2С2О4 ↔ Н+ + НС2О4- 2 ступень НС2О4- ↔ Н+ + С2О42-  6. Написали ионно-молекулярные молекулярные уравнения гидролиза Карбонат натрия – средняя соль, образованная сильным основанием – гидроксидом натрия (NaOH) и слабой кислотой – угольной (H2CO3). Гидролизуется по аниону. Характер среды щелочной. Уравнение гидролиза выглядит следующим образом: Na2CO3 ↔ 2Na+ + CO32- (диссоциация соли); 2Na+ + CO32- + H2O ↔ HCO3— + OH— + 2Na+ (полное ионное уравнение); CO32- + H2O ↔ HCO3— + OH— (сокращенное ионное уравнение); Na2CO3 + H2O ↔NaHCO3 + NaOH (молекулярное уравнение). Теоретически возможна вторая ступень: NaHCO3↔ Na+ +HCO3— (диссоциация соли); Na+ + HCO3— + H2O ↔ H2CO3 (H2O + CO2) + OH— + Na+ (полное ионное уравнение); HCO3— + H2O ↔ H2CO3 (H2O + CO2) + OH— (сокращенное ионное уравнение); NaHCO3 + H2O ↔ H2CO3 (H2O + CO2) + NaOH (молекулярное уравнение). В результате гидролиза образовались гидроксид-ионы (OH-), поэтому раствор имеет щелочную среду (pH > 7). 7. Рассчитали рН четырех растворов электролитов (значения констант диссоциации брали из таблицы в Приложении) 1) pH H2С2O4 [OH-] = CM(H2С2O4) = 0,2 моль/л рН = 14 + lg[OH-] =14 + lg0,2 = 14 – 0,7 = 13,3 2) pH 0,5 н. NH4OH. рН = 14 + lg[OH-] = 14 + lg(2,99∙10-3) = 14 – 2,5 = 11,5 3) pH 0,05 н. Na2CO3 вычислим степень гидролиза 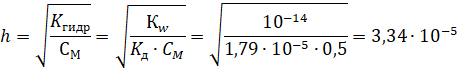 рН = - lg[H+] = - lg(1,67∙10-5) = 10,8 4) pH 0,1 NaOH. [OH-] = CM(NaOH) = 0,1 моль/л рН = 14 + lg[OH-] =14 + lg0,1 = 14 – 1 = 13 5) pH 0,1 НCl рН = - lg[H+] = - lg0,1 = 1 8. Рассчитали См(молярную концентрацию) для одного электролита гидроксида натрия рН = 11,98. [H+] = 10-рН = 10-11,98 = 10-12 моль/л 9. Сравнили результаты расчетов с опытными данными Результаты расчетов рН совпадают с опытными данными. Вывод: В ходе лабораторной работы мы изучили способы расчета рН растворов гидролизующихся солей, сильных и слабых кислот и оснований. Также освоили методы экспериментального определения рН растворов с помощью индикаторов (фенолфталеин, метиловый оранжевый, универсальный) и рН-метра. Вопросы для контроля: 1. Можно ли с помощью фенолфталеина отличить: а)кислую среду от нейтральной; ответ: нет б)нейтральную от слабощелочной рН=8; ответ: да в) слабощелочную от умеренно щелочной рН=11 ответ: нет? Т.к. интервал рН перехода бесцветной окраски фенолфталеина в малиновую 8,2-10,0. 2. Можно ли с помощью метилового оранжевого отличить: а)умеренно кислую среду рН=З от слабокислой рН=5,0. ответ: да; б) слабокислую среду от нейтральной.ответ: нет; в)нейтральную среду от щелочной. ответ: нет? Т.к. интервал рН перехода красной окраски метилового оранжевого в оранжевую 3,1 – 4,4. 3. Можно ли с помощью универсального индикатора различить бесцветные растворы с рН: а) 4,0 и 4,5; б) 8,0 и 8,5; в) 4,0 и 5,0 ? Ответ: нет 4. С помощью какого метода определения рН можно различить растворы с любым значением рН ? Ответ: используя методику определения с помощью рН-метра. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
