Теория строения органических соединений А. Теория строения органических соединений А. М. Бутлерова. (1861г)
 Скачать 1.07 Mb. Скачать 1.07 Mb.
|
|
Теория строения органических соединений А.М. Бутлерова. (1861г) Атомы в молекулах располагаются небеспорядочно,а в определенной последовательности согласно их валентности. Углерод в орган.соед. 4-х валентен и способен соедин.в цепи. Св-ва в-в зависят не только от того атомы каких элементов входят в состав молекул но и от порядка соединения. По строению можно определить св-ва в-ва, а по св-ву можно определить строение. Атомы и группы атомов взаимно влияют друг на друга 2.Строение атома углерода. Углерод (С) – шестой элемент периодической таблицы Менделеева с атомным весом 12. Элемент относится к неметаллам и имеет изотоп 14С. Строение атома углерода лежит в основе всей органической химии, т. к. все органические вещества включают молекулы углерода. Состоит из ядра, имеющего положительный заряд +6 и эл.оболочки, на которой находится 6 электоронов, расположенных на 2-х энергетических слоях. 3.Изомерия и ее виды. Изомерия-Явление существования веществ, имеющих одинаковый состав, но разное строение и поэтому разные свойства. Существуют два основных типа изомерии. Это структурная и пространственная. Структурная: 1-Изомерия углеродного скелета характерна для любых классов органических соединений. Например, для вещества С4Н10 изомерами будут бутан и 2-метилпропан, для С5Н8 – это пентин и 3-метилбутин-1. 2-Если рассмотреть изомерию положения кратной связи или функциональной группы, то существуют структурные изомеры с одинаковым углеродным скелетом, которые отличаются положением кратных связей (двойных и тройных) или функциональных групп. (Например, изомерия положения кратных связей характерна для алкенов, алкинов и диенов. Так, изомерами по отношению друг к другу будут бутен-1 и бутен-2, бутин-1 и бутин-2, бутадиен-1,2 и бутадиен-1,3. Изомерия положения функциональных групп характерна для спиртов и аминов. Так пропанол-1 и пропанол-2 будут по отношению к друг другу изомерами, как и бутанамин-1 и бутанамин-2). 3-В межклассовой изомерии вещества относятся к различным классам органических соединений, как этанол и диметиловый эфир имеют общую формулу – С2Н6О или бутин-1 и бутадиен-1,3, относящиеся к классам алкинов и диенов. Пространственная: 1-Геометрическая изомерия характерна для соединений с двойной углерод-углеродной связью. Так для молекулы бутена-2 характерно 2 изомера: цис-изомер и транс-изомер. У цис-изомера одинаковые группы атомов находятся по одну сторону от плоскости, а у транс-изомера – по разные стороны. 2-Оптической изомерией обладают только те вещества, у которых есть асимметрический, или хиральный атом, то есть это атом, который связан с четырьмя различными заместителями. Оптические изомеры являются зеркальным изображением друг друга, подобно двум ладоням и несовместимы. Так, молочная кислота, или 2-оксипропановая кислота, существует в виде двух оптических изомеров, потому что она содержит 1 асимметрический атом углерода. 4. Решение задач на вывод формул органических соединений. 1. При сгорании 9 г первичного амина выделилось 2,24 л азота. Определите молекулярную и структурную формулу амина, приведите его название. Элементы ответа: 1) Записана стехиометрическая схема реакции горения амина: 2RNH2 →N2 2) Найдено количество вещества амина: n(RNH2)=2n(N2)=2*2,24/22,4=0,2 моль 3) Определена молярная масса амина: M=m/n=9/0,2=45 г/моль 4) Установлена молекулярная формула амина: на радикал R приходится 45-(14+2)=29. Таким радикалом может быть только этил C2H5 Молекулярная формула амина C2H5NH2 5) Записана структурная формула амина и дано его название: CH3-CH2-NH2 этиламин 2. Какую молекулярную формулу имеет одноатомный спирт, при взаимодействии 14,8г которого с металлическим натрием выделяется 2,24л водорода? Элементы ответа: 1)Составлено уравнение реакции 2CnH2n+1ОН + 2Na → 2CnH2n+1ОNa + H2↑ Определены количества веществ спирта и водорода n(H2) = 2,24л : 22,4л/моль = 0,1 моль по уравнению реакции n(CnH2n+1ОН ) : n(H2) = 2 : 1 следовательно, прореагировало 0,2 моль спирта 2) Определено число атомов углерода в радикале и установлена формула спирта 14,8г : (14 n + 18) = 0,2 n = 4 С4Н9ОН бутанол 5. Гомологический ряд алканов. CnH2n+2. . 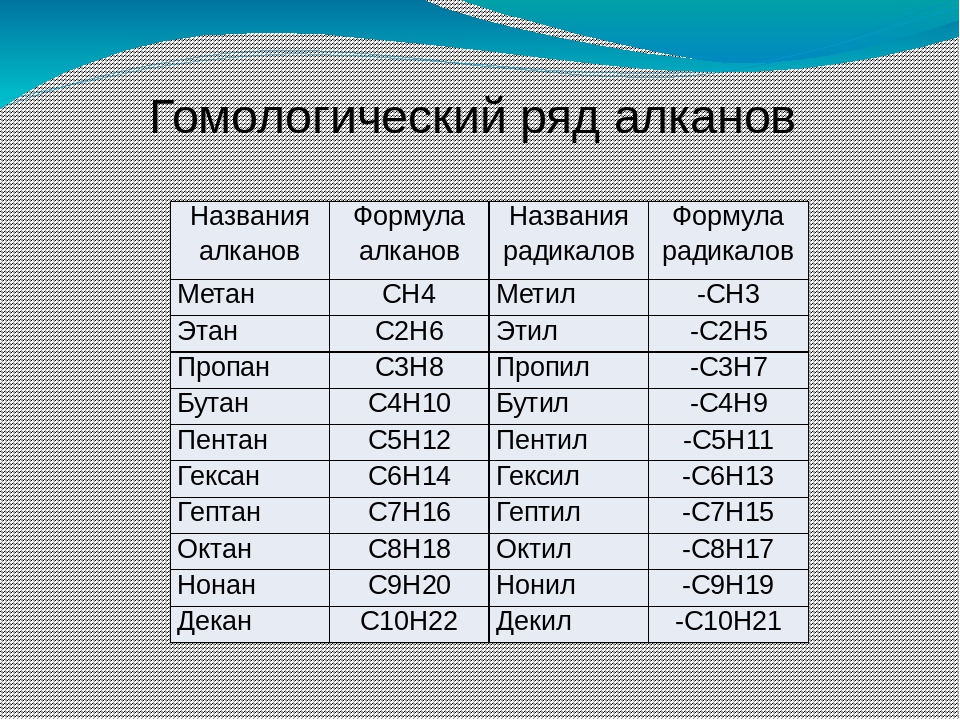 6. Свойства и получение алканов. Циклоалканы. Алканы- углероды, молекуле которых атомы связны одинарными связями каждый соответствует формуле СnH2n+2. 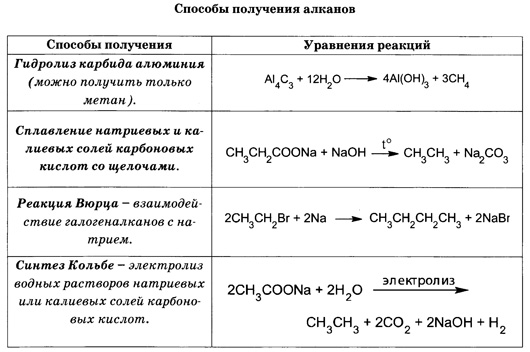 Физические св-ва: В нормальных условиях – С1-С4 – газы, С5-С17 – жидкости, а углеводороды с количеством атомов углерода больше 18 – твердые вещества. С ростом цепи повышается температура кипения и плавления. Разветвленные алканы имеют более низкие температуры кипения, чем нормальные. Алканы нерастворимы в воде, но хорошо растворяются в неполярных органических растворителях. Легко смешиваются друг с другом. Химические в-ва: 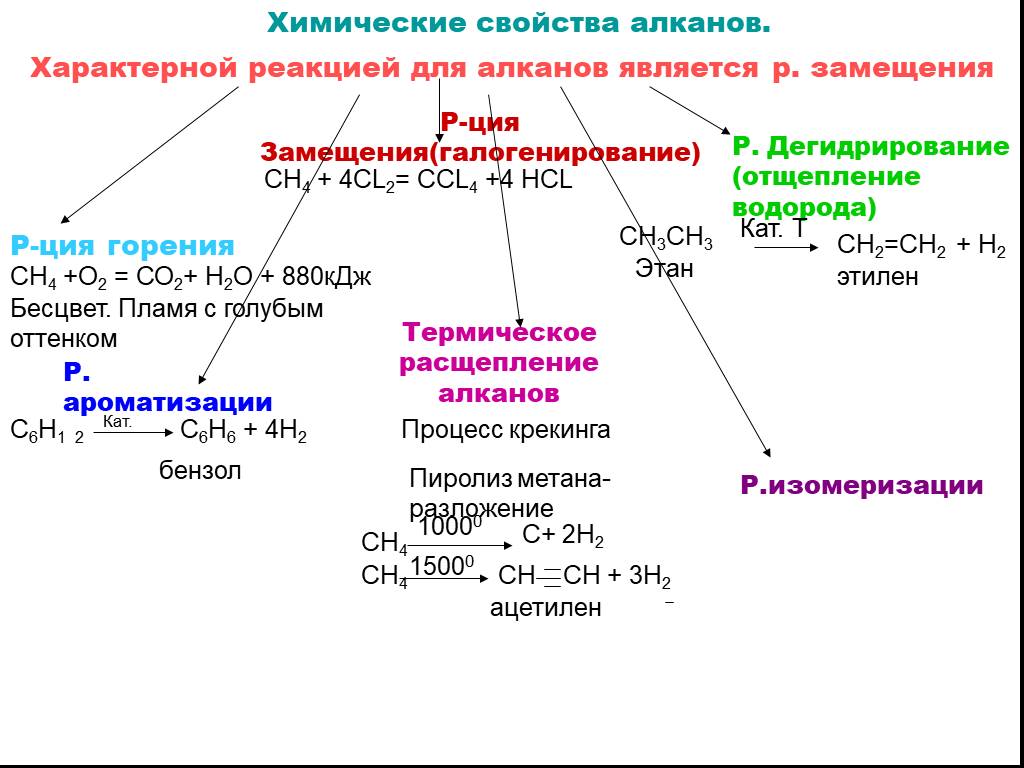 7. Гомологический ряд алкенов. CnH2N C2h4- эктен C3h6- пропен C4h8- бутен C5h10-пентен C6h12-гексен C7h14- гетен C8h16- октен C9h18- нонен C10h20- декен 8. Свойства и получение алкенов.  Св-ва: Физические свойства алкенов, такие как температура плавления и кипения немного ниже температуры кипения соответствующих алканов. Первые представители данного класса с C1по C4 — газообразные вещества, практически не имеющие запаха, C5-C17 – жидкости с резким запахом, более 17 атомов углерода – твердые вещества. Растворимость. Они плохо растворимы в воде, и хорошо растворимы в органических соединениях. Их плотность меньше плотности воды. Алкены-неполярные соединения, практически нерастворимые в воде и растворимые в органических растворителях. Они менее плотные, чем вода. Температура плавления и кипения. Температура кипения/плавления увеличивается прямо пропорционально относительной молекулярной массы соединения. В таблице представлены некоторые физические характеристики алкенов, а на рисунке зависимость температур их кипения/плавления от числа углеродных атомов. Устойчивость алкенов. В целом цис-алкен менее устойчив, чем его стерео транс-изомер. Это обусловлено нестабильностью цис-изомера вследствие влияния стерического фактора. 9.Алкадиены. Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С. Общая формула алкадиенов CnH2n+2 Сопряженные- если двойные св-зи разделены в цепи только 1-ой σ-связью. бутадиен-1,3: CH2=CH–CH=CH2 Изолированные двойные связи разделены в углеродной цепи двумя или более σ-связями С–С. Например, в пентадиене-1,4: CH2=CH–CH2–CH=CH2 Кумулированные двойные связи расположены в углеродной цепи у одного атома углерода. Например, пропадиен:CH2=C=CH2 Для алкадиенов характерна структурная и пространственная изомерия. Характерны реакции присоединения. 10. Алкины. Алкины – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна тройная связь между атомами углерода С≡С. Общая формула гомологического ряда алкинов CnH2n-2. Алкины плохо растворимы в воде и хорошо растворимы в органических растворителях. Тип гибридизации- sp Валентный угол- 180 Длина св-зи- с=с, 0,12нм Строение- линейное 11-12. Ароматические углеводороды. Бензол как представитель аренов Ароматические углеводороды (арены) - углеводороды, в молекулах которых есть одно или несколько бензольных колец. Состав аренов с одним бензольным кольцом отвечает общей формуле CnH2n-6. Гибридизация- sp2 Между атомами углерода и углерода и водорода образуются сигма связи, лежащие в 1-ой плоскости. Валентный угол- 120 Длина св-зи-с-с 0,140нм 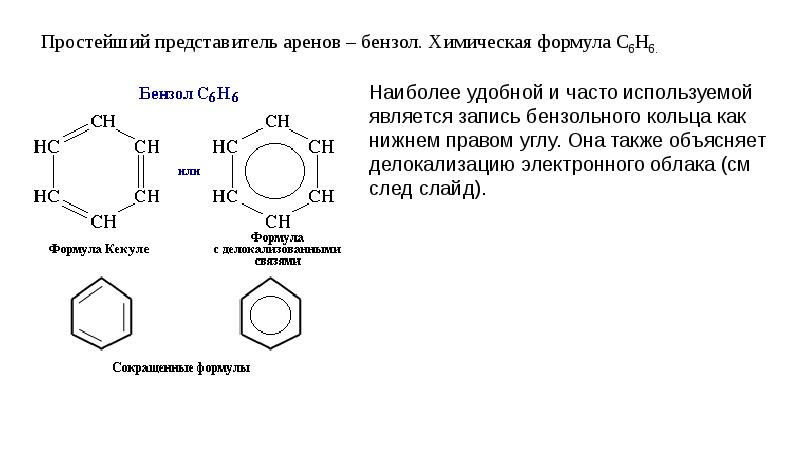 Правильный шестиугольик означает,что все сигма связи в молекуле бензола расположены одинаково. Правильный шестиугольик означает,что все сигма связи в молекуле бензола расположены одинаково.Окружность означает,что р-связь равномерно распределена между каждым атомом углерода. Физические свойства бензола Бензол – жидкость без цвета, но обладающая специфическим резким запахом. Образует с водой азеотропную смесь, хорошо смешивается с эфирами, бензином и различными органическими растворителями. Температура кипения – 80,1С, плавления – 5,5С. Токсичен, канцероген (т.е. способствует развитию онкологических заболеваний). 13. Строение и свойства спиртов. Спирты – соединения, содержащие одну или несколько гидроксильных групп –ОН, связанных с углеводородным радикалом. Формула: R-OH. СТРОЕНИЕ:  Физические свойстваНизшие спирты (до С15) – жидкости, высшие – твердые вещества. Метанол и этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы растворимость спиртов в оде падает. Спирты имеют высокие температуры кипения и плавления за счет образования водородных связей.14. Многоатомные спирты. Многоатомными являются спирты, содержащие две и более гидроксильные группы в составе молекулы органического вещества. Наиболее широко известны два многоатомных спирта - этиленгликоль и глицерин. 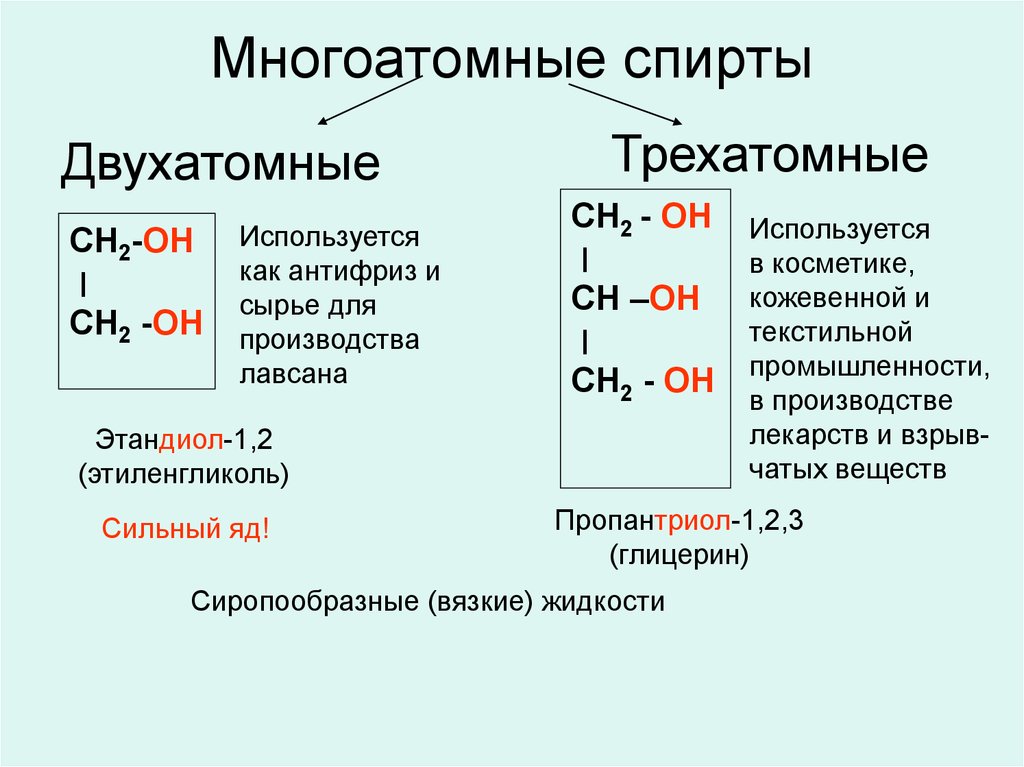 15. Фенол. Фенолы- органические в-ва, молекулы которых содержат радикал фенил, связанных с 1-ой или несколькими гидроксигруппами. |
