Тепловой эффект химических реакций. Экзо- и эндотерми¬ческие реа. Тепловой эффект химических реакций. Экзо и эндотермические реакции
 Скачать 56 Kb. Скачать 56 Kb.
|
|
Урок 3 Тема: Тепловой эффект химических реакций. Экзо- и эндотермические реакции. Цель: Образовательная:Сформировать понятие об экзо- и эндотермических реакциях, тепловом эффекте химической реакции, термохимическом уравнении. Научиться составлять термохимические уравнения и производить расчеты теплоты по уравнению реакции. Развивающая:Развитие логического мышления и умений сравнивать, обобщать, анализировать, наблюдать, анализировать природные явления и проводимый химический эксперимент. Воспитательная:Воспитаниеинтереса к предмету химия. Формированиеу учащихся коммуникативных навыков, чувства товарищества и взаимопомощи, умения работать в парах. Оборудование: вещества: штатив с пробирками, 2 термометра, Zn; HCI; NH4NO3 , свеча , спички. Мультимедийный проектор, компьютер, презентация “Тепловой эффект химических реакций. Ход урока I. Организационно-мотивационный этап Приветствие учащихся. II. Актуализация знаний учащихся На столе зажженная свеча. Зачитывается отрывок из стихотворения Б.Пастернака «Зимняя ночь» Мело, мело по всей земле Во все пределы. Свеча горела на столе, Свеча горела. О каком явлении идет речь в этом стихотворении? О горении свечи. А горение свечи это какое явление физическое или химическое? Правильно, химическое. А как иначе называются химические явления? Верно, химическими реакциями. Опишите признаки наблюдаемой реакции. Выделение света и тепла. А все ли реакции сопровождаются выделением тепла и света? Давайте проведем химический эксперимент и найдем ответ на поставленный вопрос. III. Объяснение нового материала Приступим к выполнению эксперимента: Опыт 1. Взаимодействие цинка с кислотой. В пробирку с Zn осторожно прилейте раствор соляной кислоты HCl, что наблюдаете? Потрогайте нижнюю часть пробирки, что вы ощущаете? Давайте запишем уравнение данной реакции и укажем ее признаки. Zn + 2HCl = ZnCl2 + H2↑ + Q Признаками проводимой реакции будут выделение газа и теплоты. Опыт 2.Растворение аммиачной селитры в воде В пробирку с белым кристаллическим веществом прилейте имеющуюся воду, встряхните.Потрогайте нижнюю часть пробирки, что вы ощущаете? NH4NO3 + H2O ⇄ NH4OH + HNO3 – Q Признаком проводимой реакции будет поглощение теплоты. Мы провели с вами 2 реакции, по какому признаку можно их классифицировать ? Правильно, по поглощению или по выделению теплоты. Количество теплоты, которое выделяется или поглощается при химической реакции, называют тепловым эффектом реакции. Тепловой эффект обозначается Q и измеряется в Дж или кДж. Давайте запишем классификацию химических реакций по тепловому эффекту. Реакции, протекающие с выделение теплоты, называют экзотермическими. Реакции, протекающие с поглощением теплоты, называют эндотермическими. 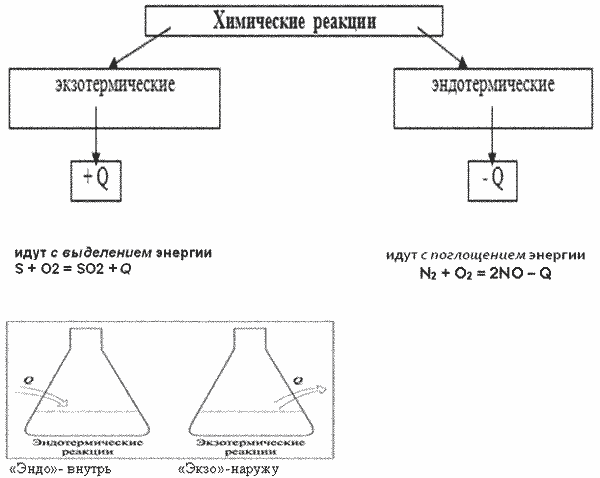 Химические уравнения, в которых указывается тепловой эффект, называют термохимическими. Например:2HgO —> 2Hg + O2 – 180 кДж,С(тв) + O2(г) —> СO2(г) + 394 кДж Раздел химии, в задачу которого входит определение и изучение тепловых эффектов реакции называется Термохимией. 4. По термохимическим уравнениям реакций можно проводить различные расчёты. Для решения задач по термохимическим уравнениям реакций нужно записать само уравнение и провести необходимые расчеты по нему. Алгоритм решения задач по термохимическому уравнению реакции Кратко записать условия задачи (“дано”). Записать термохимическое уравнение реакции (ТХУ), одной чертой в уравнении реакции подчеркивают то, что известно, двумя чертами подчёркивают то, что необходимо определить. Провести вспомогательные вычисления.m=M*v Составитьпропорцию, используя вспомогательные вычисления и условия задачи, и решить ее. Записать ответ. Объяснение решения задач: 1. Вычислите массу разложившегося мела (СаСО3), если известно, что на его разложение затрачено 1570 кДж. 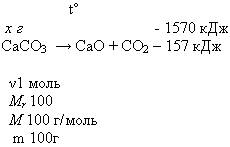 Мr(СаСО3) = Аr(Са) + Аr(С) + Аr(О) 3 = 40 + 12 + 16 3 = 100 Мr = Мrm = v * М M(СаСО3) = 1 моль* 100 г/моль = 100г 100г СаСО3 - 157 кДж - х г СаСО3 - 1570 кДж 100г : 157 кДж = х г : 1570 кДж х = 1000г СаСО3 Ответ: m (СаСО3) = 1 кг (или разложилось 1000г мела) 2. При взаимодействии 2г кальция с кислородом выделилось 127кДж теплоты. Напишите термохимическое уравнение для данной реакции. IV. Закрепление изученного материала Чтобы проверить степень усвоения вами нового материала, давайте проведем небольшую тестовую работу. 1. Заполни пропуски Реакции, протекающие с выделением теплоты и света, называют реакциями …. Это реакции …. Выберите пропущенные слова (укажи буквы, соответствующие по смыслу пропускам): а) разложения; б) эндотермические; в) экзотермические. г)замещения 2. Какие схемы можно назвать термохимическими уравнениями реакций? а) 2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж б) 2 H2 + O2 = 2 H2О + 572 кДж в) 2 H2(г) + O2(г) = 2 H2О(ж) 3. Какая запись, соответствует эндотермической реакции? а) С(тв) + O2(г) = СO2(г) + 394 кДж б) СаСO3 = СO2 + СаО – 310 кДж г) Н2 + I2 = 2HI – 52 кДж д) 3Fe + O2 = Fe3O4 + 118 кДж 4. Приведены уравнения реакций: 1. С+О2 = СО2 + 402,24кДж 2. 2HgO = 2Hg + О2 -180кДж 4.Определите тип, к которому относятся данные реакции. а) обе реакции экзотермические б) обе реакции эндотермические в) А – эндотермическая, а Б – экзотермическая г) А – экзотермическая, а Б – эндотермическая V. Подведение итогов: Подведение результатов, объявление оценок. VI. Д/з § 2, задача3 стр.11 (письменно) |
