г) рассчитать стандартные термодинамические характеристики комплексообразования NH4L+:
Коэффициенты уравнения регрессии lgK = A + B/T
мас.
доли, S
|
A
| B |
r
|
|
lgK298
|
Вода – 2-пропанол – 18-краун-6 – NH4+
|
0.2
0.4
0.6
0.8
1.0
|
-1.75
-2.71
-2.02
-1.76
-1.15
|
919
1654
1586
1844
1479
|
0.999
0.999
0.999
0.999
0.997
|
0.008
0.009
0.004
0.014
0.013
|
1.330.02
2.840.02
3.300.02
4.420.01
3.790.10
|
д) проанализировать полученные результаты.
ВАРИАНТ 7
На основании экспериментальных данных об ЭДС цепи
Мембранный эл-д (NH4+)│NH4Сl (m1), L (m2), H2O-S│AgCl,Ag (II)
по уравнению
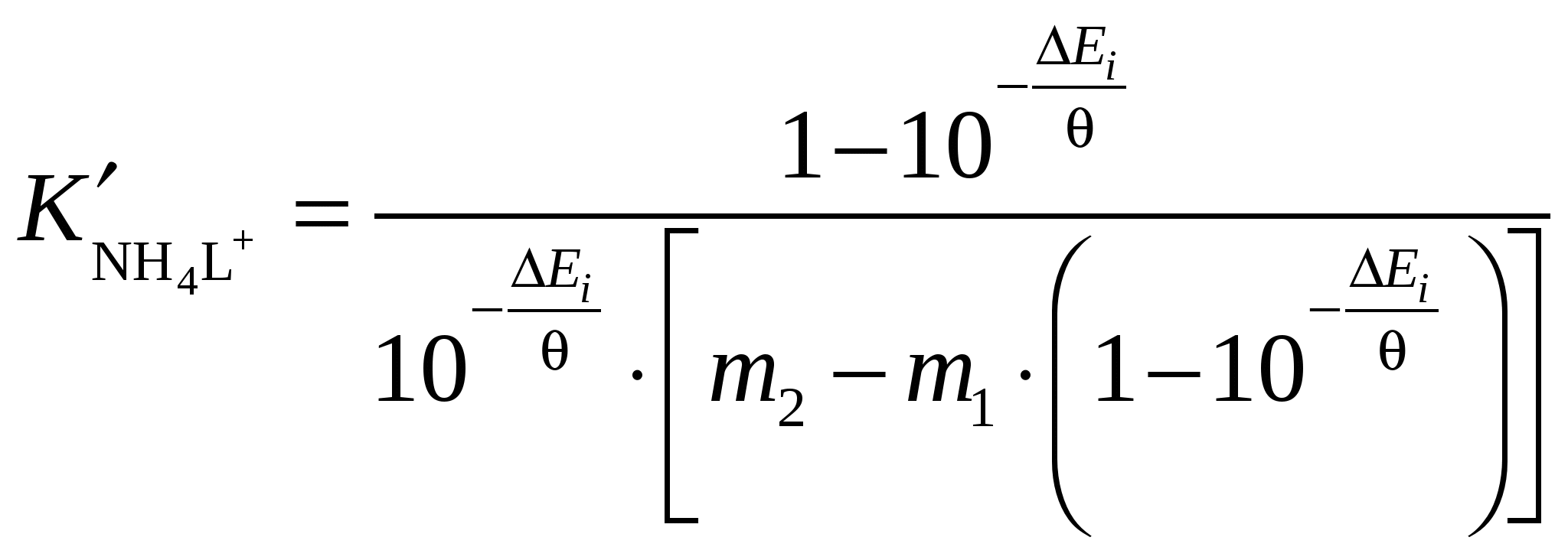 , ,
а) рассчитать концентрационные константы устойчивости коронатов аммония для разных концентраций краун-эфира и соли в данном растворителе;
б) выполнить статистический анализ зависимости lgК' от ионной силы и найти термодинамическую константу комплексообразования lgK NH4L+;
в) выразить константу устойчивости NH4L+ в различных концентрационных шкалах;
Величины Еi (мВ) гальванической цепи ст.эл-д (NH4+)NH4Cl (m1)+18К6 (m2)AgCl, Ag
в водно-пропан-2-ольных растворителях (моляльная шкала)
1.0 мас. долей воды
|
m1
|
7.007∙10-3 моль/кг растворителя
|
m2
|
2.135∙10-2
|
2.973∙10-2
|
3.563∙10-2
| Т, К |
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
283
|
4.4
4.4
|
|
6.0
5.9
|
|
7.0
6.8
|
|
288
|
4.1
4.0
|
|
5.7
5.6
|
|
6.7
6.5
|
|
298
|
3.4
3.6
|
|
4.8
4.7
|
|
5.8
5.9
|
|
308
|
3.4
3.4
|
|
4.7
4.7
|
|
5.5
5.4
|
|
318
|
3.2
3.3
|
|
4.5
4.4
|
|
5.3
5.2
|
|
0.2 мас. долей 2-PrOH - 0.8 мас. долей воды
|
m1
|
5.040∙10-3 моль/кг
|
6.115∙10-3 моль/кг
|
m2
|
1.466∙10-2
|
2.010∙10-2
|
2.873∙10-2
|
1.737∙10-2
|
2.332∙10-2
|
3.678∙10-2
|
Т, К
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
283
|
8.8
9.2
|
|
11.1
10.8
|
|
1.50
14.8
|
|
9.4
9.1
|
|
12.0
10.1
|
|
17.5
17.9
|
|
288
|
8.7
8.7
|
|
10.9
9.8
|
|
14.1
13.8
|
|
8.7
8.4
|
|
11.2
9.1
|
|
16.5
16.3
|
|
298
|
6.7
6.9
|
|
8.6
7.9
|
|
12.5
12.2
|
|
7.7
7.2
|
|
9.9
7.8
|
|
13.9
14.1
|
|
308
|
4.9
5.9
|
|
7.1
6.6
|
|
11.1
10.8
|
|
6.7
6.2
|
|
8.8
6.5
|
|
12.2
12.5
|
|
318
|
5.5
4.8
|
|
6.5
5.5
|
|
10.1
9.7
|
|
6.1
5.0
|
|
7.9
5.4
|
|
11.2
11.3
|
|
0.4 мас. долей 2-PrOH - 0.6 мас. долей воды
|
m1
|
5.262∙10-3 моль/кг
|
7.050∙10-3 моль/кг
|
m2
|
1.475∙10-2
|
2.235∙10-2
|
2.532∙10-2
|
2.055∙10-2
|
3.044∙10-2
|
3.598∙10-2
|
Т, К
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
283
|
67.1
66.6
|
|
78.6
78.0
|
|
82.6
80.6
|
|
76.3
75.9
|
|
87.2
86.1
|
|
92.5
89.7
|
|
288
|
62.3
62.2
|
|
74.0
73.5
|
|
78.1
76.2
|
|
71.9
71.5
|
|
82.7
81.7
|
|
88.3
85.6
|
|
298
|
54.3
54.0
|
|
65.6
65.1
|
|
69.9
67.9
|
|
64.0
63.5
|
|
74.7
73.5
|
|
80.7
77.8
|
|
308
|
47.8
47.6
|
|
58.8
58.4
|
|
63.2
61.3
|
|
56.9
56.3
|
|
67.3
66.4
|
|
73.1
70.7
|
|
318
|
41.5
41.3
|
|
52.3
51.4
|
|
56.3
54.4
|
|
49.8
49.3
|
|
60.3
59.3
|
|
65.4
63.6
|
|
г) рассчитать стандартные термодинамические характеристики комплексообразования NH4L+:
Коэффициенты уравнения регрессии lgK = A + B/T
мас.
доли, S
|
A
| B |
r
|
|
lgK298
|
Вода – ацетонитрил – 18-краун-6 – NH4+
|
0.2
0.4
0.6
0.8
1.0
|
-0.55
-0.20
0.29
1.05
4.35
|
608
632
641
590
-219
|
0.999
0.998
0.995
0.998
0.974
|
0.004
0.008
0.012
0.008
0.007
|
1.490.03
1.920.03
2.460.01
3.040.01
3.610.04
| |
 Скачать 0.78 Mb.
Скачать 0.78 Mb.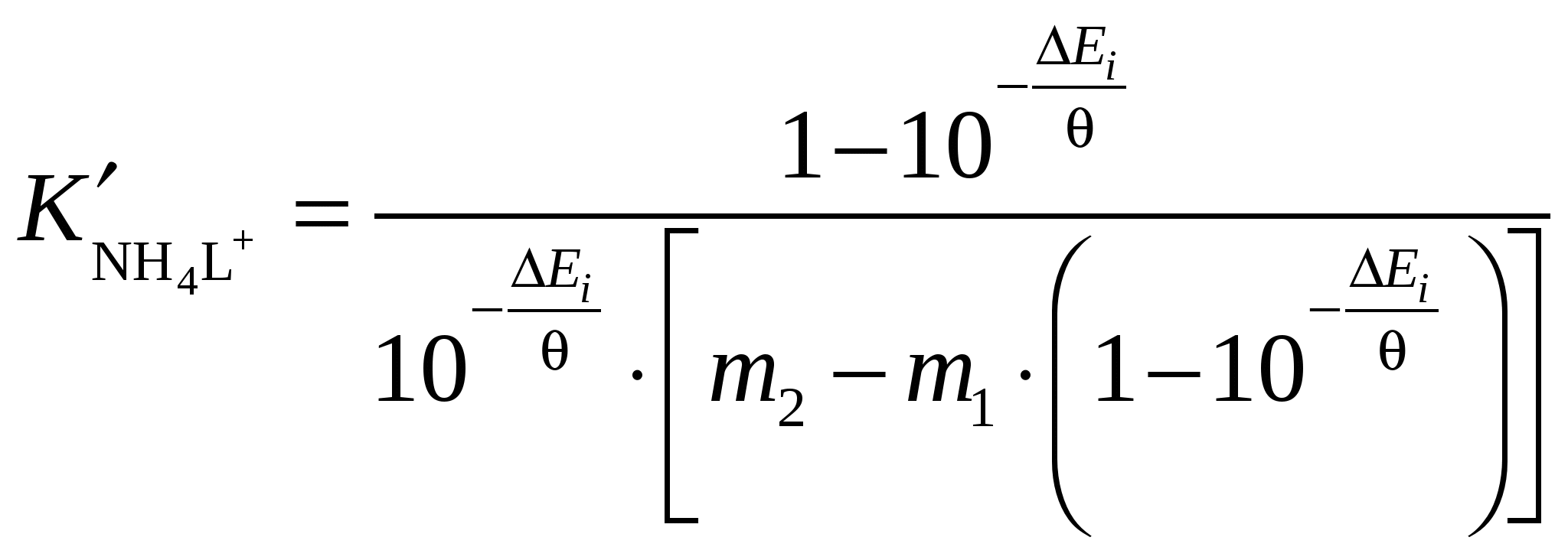 ,
, 