|
|
Термодинамика химических равновесий и сольватации реагентов в растворах
д) проанализировать полученные результаты.
ВАРИАНТ 8
На основании экспериментальных данных об ЭДС цепи
Мембранный эл-д (NH4+)│NH4Сl (m1), L (m2), H2O-S│AgCl,Ag (II)
по уравнению
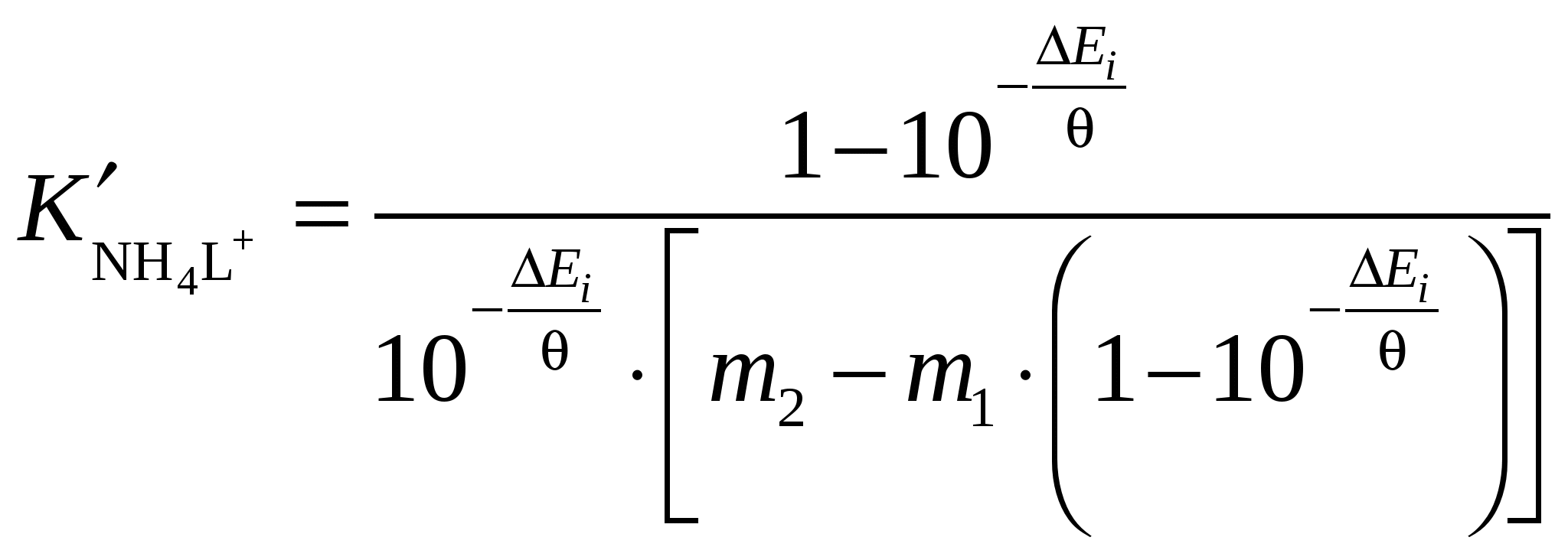 , ,
а) рассчитать концентрационные константы устойчивости коронатов аммония для разных концентраций краун-эфира и соли в данном растворителе;
б) выполнить статистический анализ зависимости lgК' от ионной силы и найти термодинамическую константу комплексообразования lgK NH4L+;
в) выразить константу устойчивости NH4L+ в различных концентрационных шкалах;
Величины Еi (мВ) гальванической цепи ст.эл-д (NH4+)NH4Cl (m1)+18К6 (m2) AgCl, Ag
в водно-пропан-2-ольных растворителях (моляльная шкала)
1.0 мас. долей воды
|
m1
|
7.007∙10-3 моль/кг растворителя
|
m2
|
2.135∙10-2
|
2.973∙10-2
|
3.563∙10-2
| Т, К |
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
283
|
4.4
4.4
|
|
6.0
5.9
|
|
7.0
6.8
|
|
288
|
4.1
4.0
|
|
5.7
5.6
|
|
6.7
6.5
|
|
298
|
3.4
3.6
|
|
4.8
4.7
|
|
5.8
5.9
|
|
308
|
3.4
3.4
|
|
4.7
4.7
|
|
5.5
5.4
|
|
318
|
3.2
3.3
|
|
4.5
4.4
|
|
5.3
5.2
|
|
0.6 мас. долей 2-PrOH - 0.4 мас. долей воды
|
m1
|
5.500∙10-3 моль/кг
|
7.416∙10-3 моль/кг
|
m2
|
3.598∙10-2
|
1.534∙10-2
|
2.286∙10-2
|
2.055∙10-2
|
3.044∙10-2
|
3.598∙10-2
| Т, К |
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
283
|
90.1
89.5
|
|
102
100
|
|
103
100
|
|
100
102
|
|
111
111
|
|
115
115
|
|
288
|
85.6
85.4
|
|
97.8
96.3
|
|
98.8
96.4
|
|
96.0
97.4
|
|
107
108
|
|
111
111
|
|
298
|
78.9
77.9
|
|
91.4
90.1
|
|
92.5
90.0
|
|
89.3
89.8
|
|
100
101
|
|
105
104
|
|
308
|
72.2
71.2
|
|
84.4
83.1
|
|
85.8
83.2
|
|
82.0
82.8
|
|
93.1
93.3
|
|
97.9
97.4
|
|
318
|
64.8
64.3
|
|
77.5
76.2
|
|
79.1
77.2
|
|
75.1
75.9
|
|
86.0
86.2
|
|
91.2
90.8
|
|
0.8 мас. долей 2-PrOH - 0.2 мас. долей воды
|
m1
|
5.103∙10-3 моль/кг
|
6.883∙10-3 моль/кг
|
m2
|
1.506∙10-2
|
1.906∙10-2
|
3.255∙10-2
|
2.220∙10-2
|
3.132∙10-2
|
3.545∙10-2
| Т, К |
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
283
|
156
155
|
|
164
162
|
|
173
170
|
|
165
165
|
|
172
172
|
|
179
178
|
|
288
|
152
151
|
|
161
158
|
|
169
167
|
|
162
162
|
|
169
169
|
|
177
175
|
|
298
|
145
144
|
|
153
151
|
|
162
160
|
|
156
156
|
|
163
164
|
|
170
170
|
|
308
|
137
136
|
|
145
144
|
|
154
153
|
|
149
148
|
|
157
157
|
|
164
162
|
|
318
|
129
128
|
|
138
136
|
|
147
145
|
|
141
141
|
|
150
149
|
|
156
155
|
|
г) рассчитать стандартные термодинамические характеристики комплексообразования NH4L+:
Коэффициенты уравнения регрессии lgK = A + B/T
мас.
доли, S
|
A
| B |
r
|
|
lgK298
|
Вода – ацетон – 18-краун-6 – NH4+
|
0.2
0.4
0.6
0.8
1.0*
|
-0.62
-1.12
-1.87
-2.21
4.00
|
595
920
1302
1616
-165
|
0.988
0.999
0.999
0.999
0.976
|
0.017
0.009
0.011
0.004
0.005
|
1.350.10
1.970.06
2.510.10
3.220.08
3.440.04
|
д) проанализировать полученные результаты.
ВАРИАНТ 9
На основании экспериментальных данных об ЭДС цепи
Мембранный эл-д (NH4+)│NH4Сl (m1), L (m2), H2O-S│AgCl,Ag (II)
по уравнению
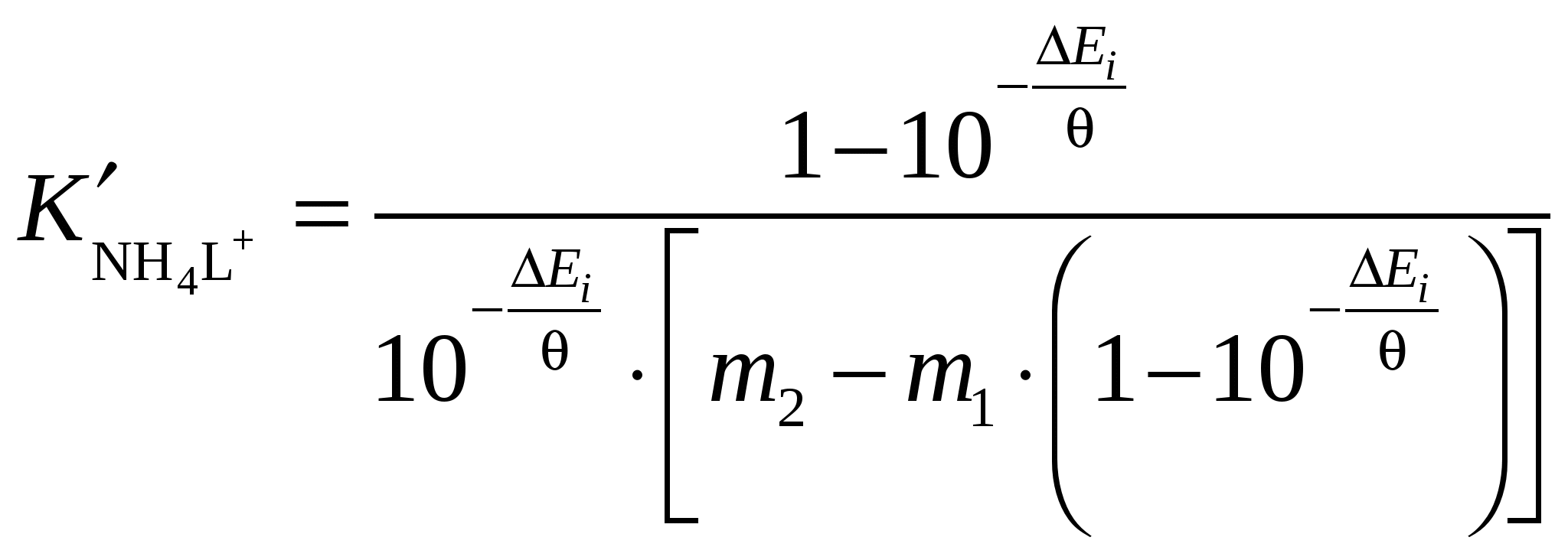 , ,
а) рассчитать концентрационные константы устойчивости коронатов аммония для разных концентраций краун-эфира и соли в данном растворителе;
б) выполнить статистический анализ зависимости lgК' от ионной силы и найти термодинамическую константу комплексообразования lgK NH4L+;
в) выразить константу устойчивости NH4L+ в различных концентрационных шкалах;
Величины Еi (мВ) гальванической цепи ст.эл-д (NH4+)NH4Cl (m1) + 18К6 (m2) AgCl. Ag
в водно-метанольных растворителях (моляльная шкала)
1.0 мас. долей воды
|
m1
|
7.007∙10-3 моль/кг растворителя
|
m2
|
2.135∙10-2
|
2.973∙10-2
|
3.563∙10-2
| Т, К |
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
283
|
4.4
4.4
|
|
6.0
5.9
|
|
7.0
6.8
|
|
288
|
4.1
4.0
|
|
5.7
5.6
|
|
6.7
6.5
|
|
298
|
3.4
3.6
|
|
4.8
4.7
|
|
5.8
5.9
|
|
308
|
3.4
3.4
|
|
4.7
4.7
|
|
5.5
5.4
|
|
318
|
3.2
3.3
|
|
4.5
4.4
|
|
5.3
5.2
|
|
0.2 мас. долей метанола - 0.8 мас. долей воды
|
m1
|
5.040∙10-3 моль/кг
|
6.995∙10-3 моль/кг
|
m2
|
1.622∙10-2
|
2.139∙10-2
|
2.614∙10-2
|
2.247∙10-2
|
2.961∙10-2
|
3.533∙10-2
|
Т, К
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
283
|
11.3
11.5
|
|
14.3
14.2
|
|
15.6
16.0
|
|
14.2
14.7
|
|
17.2
17.5
|
|
20.4
20.3
|
|
288
|
10.6
10.9
|
|
13.8
14.1
|
|
15.5
15.4
|
|
13.0
13.5
|
|
16.9
17.1
|
|
19.8
19.7
|
|
298
|
9.3
9.4
|
|
11.6
12.2
|
|
13.6
13.6
|
|
11.1
11.8
|
|
15.4
15.6
|
|
18.0
18.0
|
|
308
|
8.3
8.1
|
|
10.4
10.6
|
|
12.1
12.0
|
|
11.0
11.6
|
|
14.1
14.2
|
|
16.4
16.4
|
|
318
|
7.4
7.5
|
|
9.2
9.5
|
|
10.3
10.7
|
|
10.1
10.6
|
|
13.8
14.4
|
|
14.5
14.3
|
|
0.4 мас. долей метанола - 0.6 мас. долей воды
|
m1
|
5.060∙10-3 моль/кг
|
7.024∙10-3 моль/кг
|
m2
|
1.689∙10-2
|
2.268∙10-2
|
2.863∙10-2
|
2.289∙10-2
|
3.085∙10-2
|
4.086∙10-2
|
Т, К
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
283
|
30.5
29.3
|
|
34.9
34.0
|
|
40.0
38.6
|
|
34.3
34.7
|
|
41.3
41.3
|
|
48.1
48.0
|
|
288
|
28.1
27.0
|
|
32.9
32.2
|
|
37.7
36.8
|
|
33.5
33.3
|
|
40.0
39.6
|
|
46.9
46.7
|
|
298
|
25.2
24.1
|
|
29.8
29.0
|
|
34.5
33.8
|
|
30.3
29.2
|
|
36.4
36.5
|
|
43.6
43.8
|
|
308
|
22.2
21.2
|
|
26.6
25.8
|
|
30.9
30.7
|
|
26.6
26.7
|
|
32.6
32.8
|
|
40.0
40.2
|
|
318
|
19.2
18.4
|
|
22.9
23.1
|
|
27.7
27.2
|
|
23.5
23.9
|
|
28.7
28.7
|
|
35.5
35.9
|
|
г) рассчитать стандартные термодинамические характеристики комплексообразования NH4L+:
Коэффициенты уравнения регрессии lgK = A + B/T
мас.
доли, S
|
A
| B |
r
|
|
lgK298
|
Вода – диоксан – 18-краун-6 – NH4+
|
0.2
0.4
0.6
0.8
|
-0.11
-1.16
-1.60
-2.63
|
461
902
1209
1628
|
0.992
0.998
0.999
0.999
|
0.011
0.011
0.007
0.005
|
1.450.08
1.870.03
2.460.04
2.830.05
|
д) проанализировать полученные результаты.
ВАРИАНТ 10
На основании экспериментальных данных об ЭДС цепи
Мембранный эл-д (NH4+)│NH4Сl (m1), L (m2), H2O-S│AgCl,Ag (II)
по уравнению
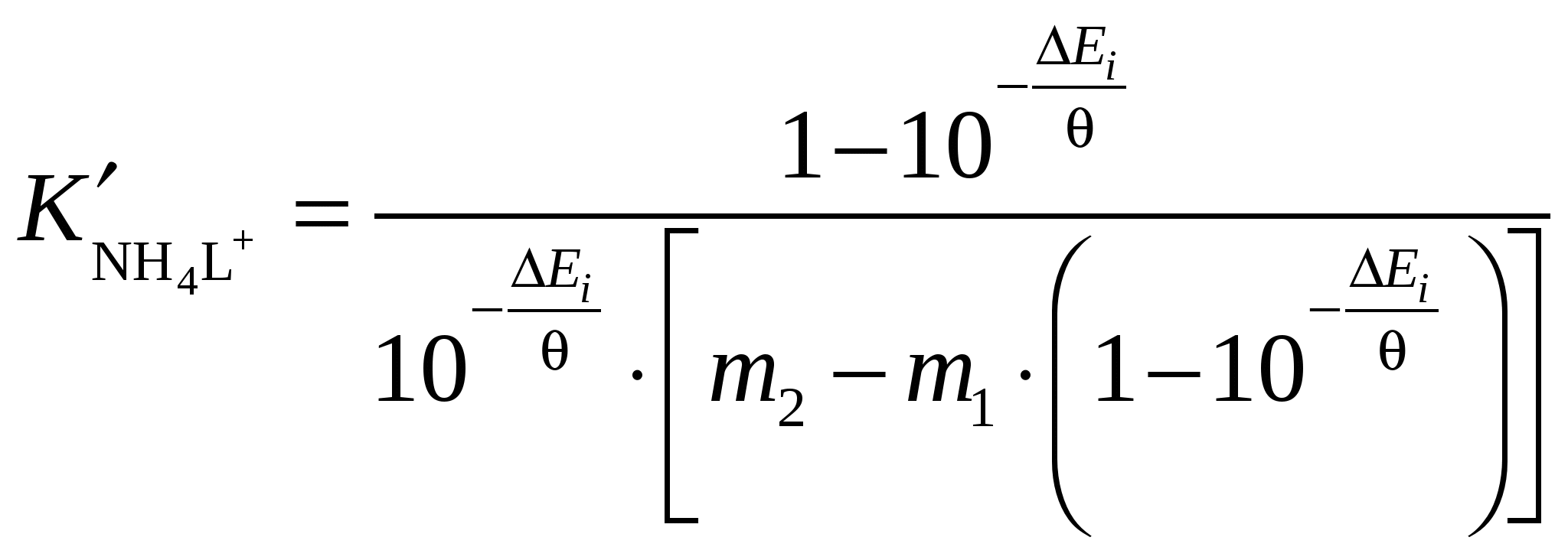 , ,
а) рассчитать концентрационные константы устойчивости коронатов аммония для разных концентраций краун-эфира и соли в данном растворителе;
б) выполнить статистический анализ зависимости lgК' от ионной силы и найти термодинамическую константу комплексообразования lgK NH4L+;
в) выразить константу устойчивости NH4L+ в различных концентрационных шкалах;
Величины Еi (мВ) гальванической цепи ст.эл-д (NH4+)NH4Cl (m1) + 18К6 (m2) AgCl. Ag
в водно-метанольных растворителях (моляльная шкала)
1.0 мас. долей воды
|
m1
|
7.007∙10-3 моль/кг растворителя
|
m2
|
2.135∙10-2
|
2.973∙10-2
|
3.563∙10-2
| Т, К |
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
283
|
4.4
4.4
|
|
6.0
5.9
|
|
7.0
6.8
|
|
288
|
4.1
4.0
|
|
5.7
5.6
|
|
6.7
6.5
|
|
298
|
3.4
3.6
|
|
4.8
4.7
|
|
5.8
5.9
|
|
308
|
3.4
3.4
|
|
4.7
4.7
|
|
5.5
5.4
|
|
318
|
3.2
3.3
|
|
4.5
4.4
|
|
5.3
5.2
|
|
0.6 мас. долей метанола - 0.4 мас. долей воды
|
m1
|
5.020∙10-3 моль/кг
|
7.030∙10-3 моль/кг
|
m2
|
1.281∙10-2
|
2.030∙10-2
|
2.524∙10-2
|
1.808∙10-2
|
2.799∙10-2
|
3.462∙10-2
| Т, К |
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
283
|
38.9
37.8
|
|
51.1
50.3
|
|
57.8
55.1
|
|
47.6
48.2
|
|
60.9
61.4
|
|
65.0
66.7
|
|
288
|
37.3
35.9
|
|
50.0
48.9
|
|
55.7
53.2
|
|
45.0
45.7
|
|
58.3
59.0
|
|
63.7
64.2
|
|
298
|
32.6
32.1
|
|
45.4
44.6
|
|
53.6
49.3
|
|
40.6
40.7
|
|
53.8
55.1
|
|
58.8
58.9
|
|
308
|
28.2
28.5
|
|
41.1
40.5
|
|
45.9
45.0
|
|
36.0
36.0
|
|
48.5
48.6
|
|
54.2
54.3
|
|
318
|
25.6
25.0
|
|
37.3
35.9
|
|
41.5
40.6
|
|
31.5
32.0
|
|
44.7
45.1
|
|
49.0
49.6
|
|
0.8 мас. долей метанола - 0.2 мас. долей воды
|
m1
|
5.020∙10-3 моль/кг
|
7.016∙10-3 моль/кг
|
m2
|
1.433∙10-2
|
1.933∙10-2
|
2.506∙10-2
|
2.063∙10-2
|
2.880∙10-2
|
3.713∙10-2
|
Т, К
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
∆Еi
|
lgK
|
283
|
77.4
75.4
|
|
86.5
85.1
|
|
93.2
93.5
|
|
85.0
85.5
|
|
97.5
97.8
|
|
105
106
|
|
288
|
73.6
71.8
|
|
83.0
82.4
|
|
90.9
90.7
|
|
82.0
82.2
|
|
94.7
94.5
|
|
103
104
|
|
298
|
67.4
66.0
|
|
76.9
76.9
|
|
84.8
84.8
|
|
76.3
76.4
|
|
88.1
88.2
|
|
97.4
97.9
|
|
308
|
61.1
59.7
|
|
70.8
70.6
|
|
79.1
78.3
|
|
68.8
68.7
|
|
81.0
81.0
|
|
90.0
90.3
|
|
318
|
55.0
53.3
|
|
64.2
64.2
|
|
72.3
71.0
|
|
62.6
62.5
|
|
74.0
73.7
|
|
82.3
82.2
|
|
г) рассчитать стандартные термодинамические характеристики комплексообразования NH4L+:
Коэффициенты уравнения регрессии lgK = A + B/T
мас.
доли, S
|
A
| B |
r
|
|
lgK298
|
Вода – 2-пропанол – ДЦГ18-краун-6 – NH4+
|
0
0.2
0.4
0.6
0.8
|
-1.92
-1.72
-2.65
-2.36
-1.18
|
877
911
1247
1221
1055
|
0.998
0.988
0.999
0.999
0.999
|
0.009
0.025
0.006
0.008
0.009
|
1.020.10
1.340.05
1.530.03
1.740.03
2.360.02
|
д) проанализировать полученные результаты.
ЛИТЕРАТУРА
Измайлов Н.А.Электрохимия растворов. – Харьков: изд-во ХГУ, 1959. – 958 с.
Комплексообразование в неводных растворах // Под. ред. Крестова Г.А. -М.: Наука, 1989. – 256 с.
Абросимов В.К. Изотопные эффекты в растворах. В кн. Современные проблемы химии растворов / Под. ред. Б.Д. Березина. М.: Наука, 1986. С. 97–156.
Фиалков Ю.Я. Растворитель как средство управления химическим процессом. Л.: Химия. 1990. 240 с.
Научное наследие Н.А. Измайлова и актуальные проблемы физической химии / Под. ред. В.И. Лебедя, Н.О. Мчедлова-Петросяна, Ю.В. Холина. Х.: ХНУ имени В.Н. Каразина, 2007. 675 с.
Бондарев Н.В. Взаимосвязь термодинамических характеристик сольватации, диссоциации и комплексообразования // Укр. хим. ж. –1995. –Т.61, №11. – С. 14–18.
Бондарев Н.В. Развитие концепции структура-свойство на основе сольватационных параметров // ЖОХ. –1999. –Т. 69, Вып. 2 –С. 229–234.
Tsurko E.N., Bondarev N.V. Mathematical modeling of solvent parameters' relevant contribution to the alpha-amino acid (valine, alpha-alanine) solvation in H2O–MeOH, H2O–EtOH and H2O– PrOH-2 // J. Mol. Liquids. –2007. № 131–132. – P.151–157.
Дубров А.М., Мхитарян В.С., Трошин Л.И. Многомерные статистические методы. М.: Финансы и статистика. 2000. 352 с.
|
|
|
 Скачать 0.78 Mb.
Скачать 0.78 Mb. ,
, 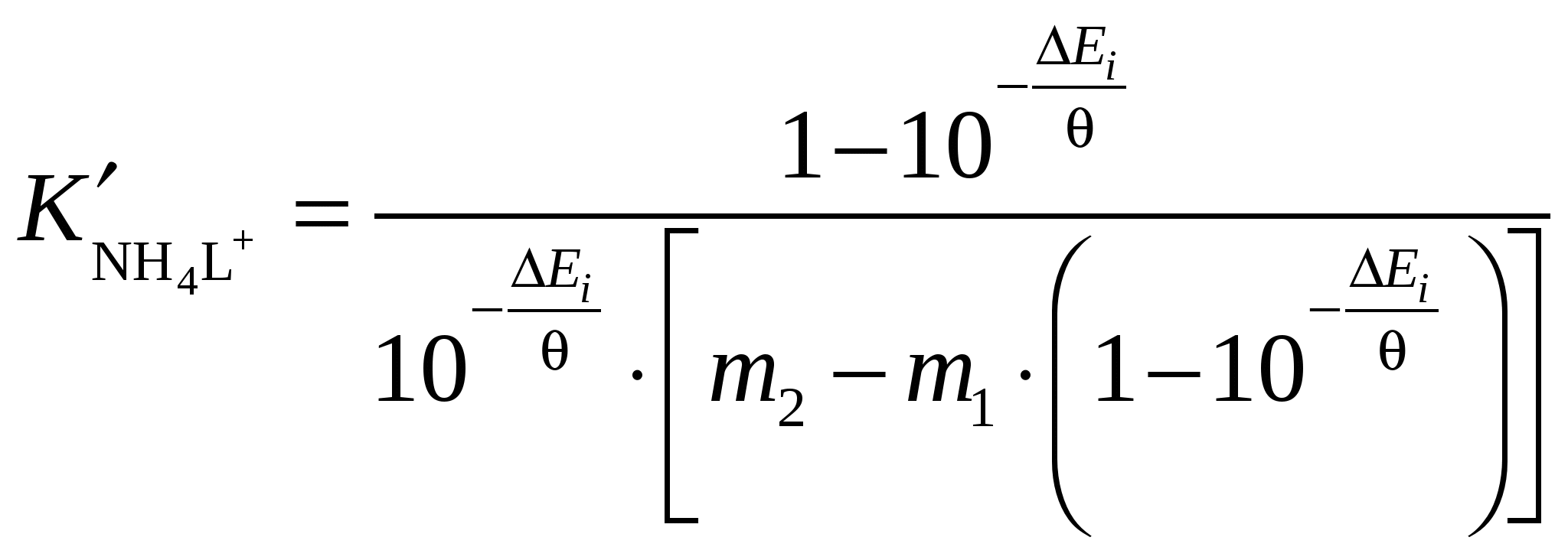 ,
, 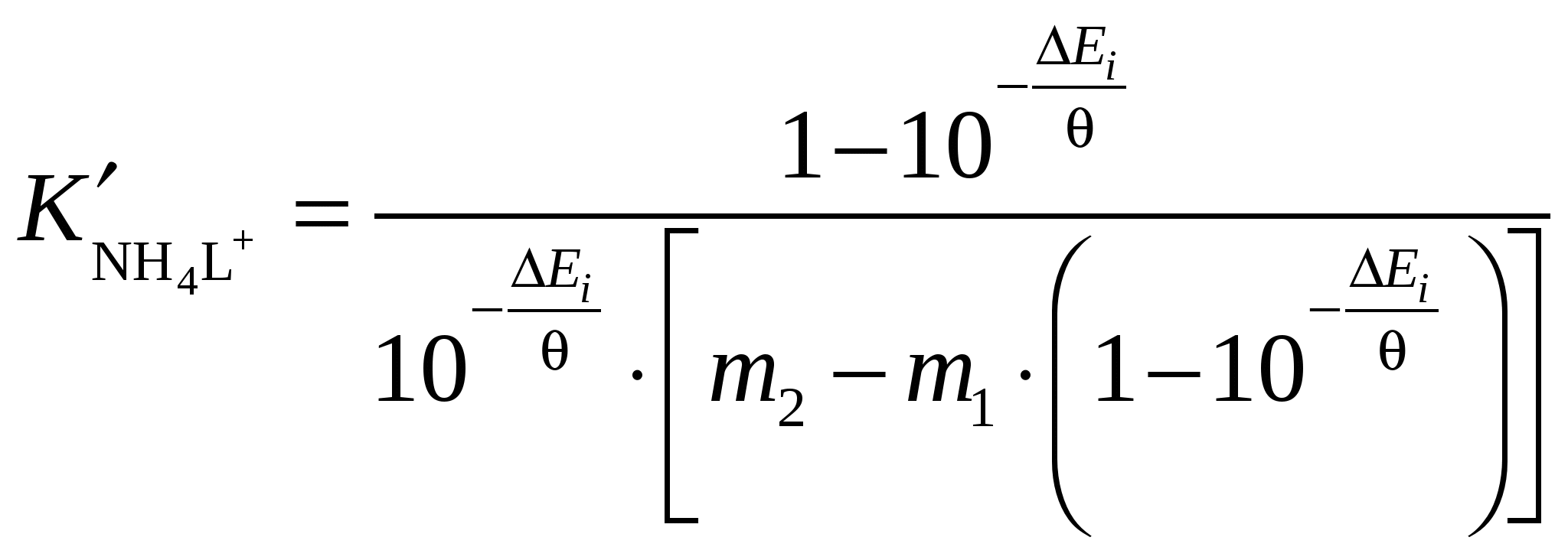 ,
, 