10 практика. 10 практикалық сабақ. Тотыутотысыздану титрлеу. Тотыутотысыздану титрлеу титранттары мен индикаторлары
 Скачать 143.5 Kb. Скачать 143.5 Kb.
|
|
ТАҚЫРЫБЫ: Тотығу-тотықсыздану титрлеу. Тотығутотықсыздану титрлеу титранттары мен индикаторлары. Тотығу-тотықсыздану титрлеу әдістері немесе редокс әдістер электрон ауыса жүретін тотығу-тотықсыздану реакцияларына (ТТР) негізделген. Егер титрант ретінде тотықтырғыш пайдаланылатын болса әдіс - оксидиметрия, ал тотықсыздандырғыш пайдаланылатын болса әдіс – редуктометрия деп аталады. Тотығу-тотықсыздану әдістерін пайдаланып көптеген қосылыстардың атап айтсақ, органикалық, бейорганикалық және элемент органикалық әртүрлі қосылыстардың, мономерлердің, полимерлердің, минералды тыңайтқыштардың, дәрілік және медициналық препараттардың биологиялық және тағам өнімдерінің мөлшерлерін анықтайды. Қазіргі кезде Ттр өте көп, бірақ сандық талдауда оның өте аз шамасы ғана қолданылады, сандық талдауда пайдаланылатын ТТР келесі талаптарға сәйкес болуы тиіс: 1) химиялық реакция аяғына дейін жүруі тиіс (К≥108, 99,99%); 2) реакция жылдамдығы жоғары болуы тиіс; 3) реакция өнімдерінің құрамы тұрақты болуы тиіс; 4) эквиваленттік нүктесі жақсы анықталуы тиіс; 5) жанама процестер жүрмеу қажет; 6) реакция кайтымсыз болу керек. Константалары төмен реакциялар аяғына дейін жүрмейді, ТТР әртүрлі факторлар әсер етеді (мысалы, АsО43- ерітіндісінің І- ерітіндісімен әрекеттесуіне ерітіндінің иондық күші, рН, темпуратурада т.б. әсер етеді). Эквиваленттік нүктені анықтау үшін тотыққан-тотықсызданған жұптың ЭҚК-ін білу қажет, жай химиялық реакцияларда оның мәні 0,4-0,5В, ал эквиваленттік нүкте инструменталдық тәсілмен анықталатын болса, онда ЭҚК 0,2В тең болу қажет. Басқа уақытта химиялық реакция аяғына дейін жүрмейді немесе титрлеу қисығында потенциалдың секіру интервалы өте төмен болып байқалмайды. Жалпы айтқанда эквиваленттік нүктені анықтауға мүмкіншілік болмайды. Тотығу-тотықсыздану титрлеу әдістерін топтастыру. Тотығу-тотықсыздану титрлеу тәсілдерінде титрант ретінде тотықсыздандырғыштардың немесе тотықтырғыштардың ерітінділері пайдаланылады. Барлық редокс әдістер титрлеуде пайдаланылатын негізгі титранттың табиғатына байланысты топтастырылады. Мысалы, перманганатометрия тәсілінде титрант KMnO4, йодиметрия тәсілінде титрант I2,йодометрия тәсілінде титрант КIжәне Na2S2O3 ерітінділері, бромометрия тәсілінде титрант Вч2 (КВчО3 + КВч), цериметрия тәсілінде титрант Се4+ тұздарының ерітіндісі. Титрлеу тәсілдері. 1) тура титрлеу 2) кері титрлеу 3) орынбасу немесе жанама титрлеу тәсілдері. Тура титрлеу тәсілі. Егер талдаудың негізінде жатқан химиялық реакция жоғарыда аталған ТТР қойылатын шарттарды қанағаттандыратын болса, онда тура титрлеу тәсілін пайдаланады. Тура титрлеуде ЭҚК≥0,47В болу тиіс, тек осы жағдайда, ТТР қажетті жылдамдықпен және аяғында дейін жүреді. Мысалы Fe2+ ионын KMnO4 ерітіндісімен титрлеуді қарастырайық. 2KMnO4 + 10FeSO4 + 8H2SO4= 5Fe2(SO4)3 + 2MnSO4 + 8H2O, 5Fe2+ + MnO4-+ 8H+ ↔ 5Fe3+ + Mn2+ + 4H2O. ЭҚК = 1,51 - 0,77 = 0,77В К = 1062,7 электроқозғаушы күшінің және тепе-теңдік константаның мәні химиялық реакция аяғына дейін жүретінін көрсетеді. Егер жанама реакциялар жүрумен байланысты, реакцияның жылдамдығы төмен немесе реакция толық жүрмейтін болса, яғни эквиваленттік нүктені анықтауға мүмкіндік болмаса, онда кері титрлеу немесе орынбасу титрлеу тәсілдері пайдаланылады. Тотығу-тотықсыздану титрлеу тәсілдерінде эквиваленттік нүктені анықтау. 1) Индикатор ролін ТТР қатысатын реагенттің бірі атқаруы мүмкін. Мысалы, перманганатометрияда MnO4- + 8H+ +5e ↔ Mn2+ +4H2O күлгін түсті түссіз эквиваленттік нүктеде 1 тамшы артық қосылған MnO4- ионының әсерінен ерітінді түссізден қызғылтқа өтеді. 2) Спецификалық индикаторлар қолданып титрлеу, яғни индикатор тотықтырғыш немесе тотықсыздандырғышпен спецификалық әрекеттесіп, боялған қосылыстар түзуі мүмкін.Жиі қолданылатын индикаторлардың бірі – крахмал, йодометрияда қолданылады, ерітіндіде J2, дәлірек айтқанда J3- болған жағдайда крахмал көк түске боялады. Көк түске боялуы үшиодид ионының (J3-) крахмалдың бетінде адсарбциялануымен түсіндіріледі. Кейбір жағдайда индикаторлар ретінде аммоний тиоцианатының 1% ерітіндісі пайдаланылады, мысалы темір(III) тұздарын анықтаған жағдайда эквиваленттік нүктеде Fe3+ + 3SCN- = Fe(SCN)3 қызыл түске боялады. 3) Редокс индикаторлар - потенциалдың белгілі бір мәнінде (эквиваленттік нүктеде не оған жақын нүктеде) тотығып немесе тотықсызданып түсін өзгертетін заттар. Тотығу-тотықсыздану титрлеу тәсілдерінде редокс индикаторлар жиі қолданылады. Редокс индикаторлар қайтымды және қайтымсыз болып екіге бөлінеді. Қайтымды редокс индикаторлар. Тотыққан және тотықсызданған түрлерінің түстері әртүрлі болады. Түс өзгеруіне сәйкес келетін редокс индикаторларының жартылай реакциясын жазсақ: IndOх + nē ↔ IndRed Индикатордың бір түрден екінші түрге ауысуы. Индикатор түсінің өзгеруі белгілі потенциал аралығында ғана байқалады. Редокс жұптың IndOх/IndRed тотығу-тотықсыздану потенциалы (ТТП) Нернст теңдеуімен анықталады. 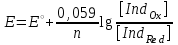 , мұнда [IndOх] = [IndRed] тең болғанда ТТП стандартты тотығу-тотықсыздану потенциалына (СТТП) - E° тең болады. Индикатордың түсінің байқалуы тотыққан және тотықсызданған түрлерінің концентрациясының қатынасымен анықталады. Индикатордың түсінің өзгеруі ерітіндінің тотығу-тотықсыздану потенциалының белгілі бір мәнінде байқалады, оны индикатор түсінің ауысу интервалы деп атайды. , мұнда [IndOх] = [IndRed] тең болғанда ТТП стандартты тотығу-тотықсыздану потенциалына (СТТП) - E° тең болады. Индикатордың түсінің байқалуы тотыққан және тотықсызданған түрлерінің концентрациясының қатынасымен анықталады. Индикатордың түсінің өзгеруі ерітіндінің тотығу-тотықсыздану потенциалының белгілі бір мәнінде байқалады, оны индикатор түсінің ауысу интервалы деп атайды.Индикатор түсінің өзгеруін көзбен шолып, келесі концентрациялардың 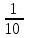 немесе немесе 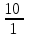 қатынасында байқауға болады. қатынасында байқауға болады. 1) 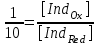 , , 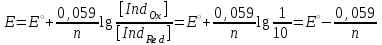 2) 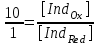 , , 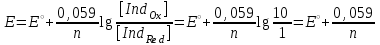 Сонымен, екі теңдеуді біріктірсек, индикатор түсінің ауысу интервалының теңдеуі алынады: 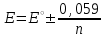 Кейбір қайтымды редокс-индикаторлар:
Тотықтырғыштар әсерінен түссіз дифениламен түссіз дифенилбензидинге қайтымсыз тотығады. Түзілген түссіз дифенилбензидин қайтымды тотығады, нәтижесінде күлгін түсті дифенилдифенохинондииминге өтеді, бұл индикатордың тотыққан түрі -күлгін түсті. Индикатор түсінің ауысу интервалы 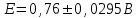 . Сонымен, қайтымды өзгеретін редокс-индикатор дифениламин емес дифенилбензидин. . Сонымен, қайтымды өзгеретін редокс-индикатор дифениламин емес дифенилбензидин. 2. N-Фенилантронил қышқылы (2-дифениламинкарбон қышқылы). Ауысу процестерінің механизмі дифениламинге ұқсас. Тотықсызданған түрі түссіз, ал тотыққан түрі күлгін-қызыл түсті. Индикатор түсінің ауысу интервалы 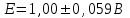 . . 3. Ферроин - Темірдің(II) орто-фенантролинмен қызыл түсті комплексі [FeL3]2+, [FeL3]3+ + 1e → [FeL3]2+ тотыққан түрі тотықсызданған түрі солғын-көкшіл қызыл Индикатор түсінің ауысу интервалы 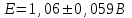 . .Қайтымсыз редокс индикаторлар: метил қызыл сарысы (метилоранж), метил қызыл т.б., бұл топтағы индикаторлар эквиваленттік нүктеде тотықтырғыштың артық мөлшерінің әсерінен қайтымсыз тотығады нәтижесінде өздерінің түсін өзгертеді. ТТТ индикатор түсінің ауысу потенциалы титрлеу қисығының секіру интервалында орналасу қажет. ТТТ пайдаланылатын индикаторлар қышқыл-негіздік қасиет көрсетеді, сондықтан өзінің түсін ерітіндінің рН байланысты өзгерту мүмкін. Сондықтан титрленетін ерітіндінің рН-ын бір қалыпты ұстау қажет (мысалы, дифениламинді тек қышқылдық ортада пайдаланады). ТТТ соңғы нүктесін анықтау үшін физико-химиялық (инструменталды, фотометриялық т.б.) әдістер де қолданылады. ТТТ пайдаланылатын индикаторларға қойылатын талаптар: 1. Индикатор өте сезімтал болуы тиіс, эквиваленттік нүктеде тотықтырғыш немесе тотықсыздандырғыштың өте аз мөлшерімен әрекеттесуі тиіс. 2. Тотыққан және тотықсызданған түрлерінің түстерінде айырмашылық болуы тиіс. 3. Индикатор түсінің ауысу интервалы жоғары болмауы қажет. 4. Индикатордың құрамы ауадағы оттектің немесе тағы басқа қосылыстардың әсерінен өзгермеуі қажет. Тотығу- тотықсыздану тирлеудің қисықтары. ТТТ өлшенетін параметр - ТТП, ол Нернст теңдеумен анықталады. 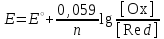 . Анықталатын компонент және титрант өзара тотығу-тотықсыздану реакциясына қатысатын болғандықтан, эквиваленттік нүктеге дейін ТТП анықталатын компоненттің жартылай реакциясымен, ал эквиваленттік нүктеден кейін титранттың жартылай реакциясымен есептеледі. Эквиваленттік нүкте анықталатын компонет пен титранттың СТТП және ТТР-на қатысатын электрон санымен анықталады. Мысал ретінде, 100 мл 0,1н Fe2+ тұздарының ерітіндісін 0,1н церий(IV) тұздары ерітіндісімен титрлеуді қарастырайық. . Анықталатын компонент және титрант өзара тотығу-тотықсыздану реакциясына қатысатын болғандықтан, эквиваленттік нүктеге дейін ТТП анықталатын компоненттің жартылай реакциясымен, ал эквиваленттік нүктеден кейін титранттың жартылай реакциясымен есептеледі. Эквиваленттік нүкте анықталатын компонет пен титранттың СТТП және ТТР-на қатысатын электрон санымен анықталады. Мысал ретінде, 100 мл 0,1н Fe2+ тұздарының ерітіндісін 0,1н церий(IV) тұздары ерітіндісімен титрлеуді қарастырайық.Fe2+ + Ce4+ ↔ Fe3+ + Ce3+ Fe2+ -1e ↔ Fe3+ Е° = 0,77B Ce4+ +1e ↔ Ce3+ Е° = 1,44 B Ерітінді титрленбес бұрын жүйеде Fe3+/Fe2+ редокс жұбы болады, бірақ Fe3+ тотыққан түрінің концентрациясы өте аз, бөгде қосылыстардың әрекеттесуі нәтижесінде пайда болады, сондықтан бастапқы нүкте есептелмейді. Эквиваленттік нүктеге дейін. 1) 100 мл 0,1н Fe2+ ерітіндісі 10 мл 0,1н Ce4+ ерітіндісімен титрленген. ТТП Fe3+/Fe2+ редокс жұбы бойынша есептеледі: Fe3+ +1e→ Fe2+ 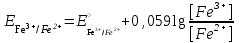 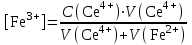 ; ; 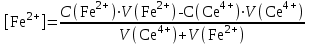 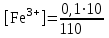 ; ; 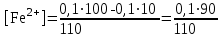 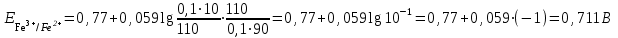 2) 100 мл 0,1н Fe2+ ерітіндісі 50 мл 0,1н Ce4+ ерітіндісімен титрленген. 2) 100 мл 0,1н Fe2+ ерітіндісі 50 мл 0,1н Ce4+ ерітіндісімен титрленген. 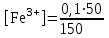 ; ; 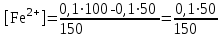 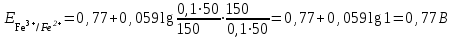 3) 100 мл 0,1н Fe2+ ерітіндісі 90 мл 0,1н Ce4+ ерітіндісімен титрленген. 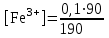 ; ; 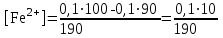 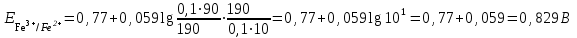 4) 100 мл 0,1н Fe2+ ерітіндісі 99 мл 0,1н Ce4+ ерітіндісімен титрленген. 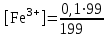 ; ; 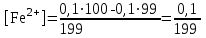 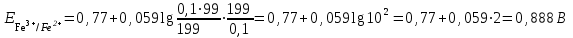 5) 100 мл 0,1н Fe2+ ерітіндісі 99,9 мл 0,1н Ce4+ ерітіндісімен титрленген. 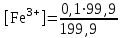 ; ; 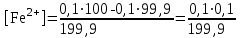 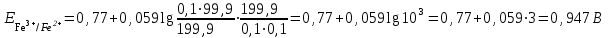 Эквиваленттік нүкте. Эквиваленттік нүкте.6) 100 мл 0,1н Fe2+ ерітіндісі 100 мл 0,1н Ce4+ ерітіндісімен титрленген. Эквивалентті нүктеде темір(ІІ) толығымен темір(ІІІ)-ке ауысады. Ерітіндіде тек Fe3+, Ce3+ иондары, онда потенциал келесі қатынаспен анықталады: 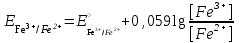 , , 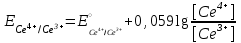 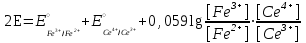 [Fe2+] = [Ce4+], [Fe3+ ] = [Ce3+] 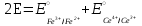 , , 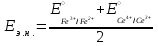 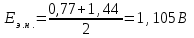 . Жалпы түрде: . Жалпы түрде: 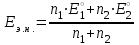 Эквиавленттік нүктеден кейін. ТТП Сe4+/Сe3+ редокс жұбы бойынша есептеледі: Сe4+ +1e→ Сe3+ 7) 100 мл 0,1н Fe2+ерітіндісі 100,1 мл 0,1н Ce4+ ерітіндісімен титрленген. 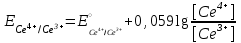 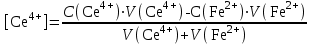 ; ; 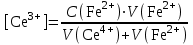 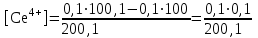 ; ; 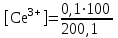 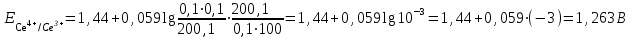 8) 100 мл 0,1н Fe2+ерітіндісі 101 мл 0,1н Ce4+ ерітіндісімен титрленген. 8) 100 мл 0,1н Fe2+ерітіндісі 101 мл 0,1н Ce4+ ерітіндісімен титрленген.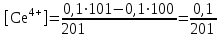 ; ; 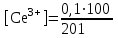 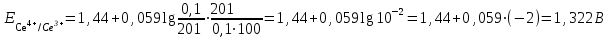 9) 100 мл 0,1н Fe2+ерітіндісі 110 мл 0,1н Ce4+ ерітіндісімен титрленген. 9) 100 мл 0,1н Fe2+ерітіндісі 110 мл 0,1н Ce4+ ерітіндісімен титрленген.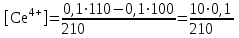 ; ; 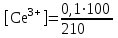 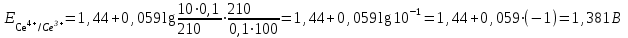
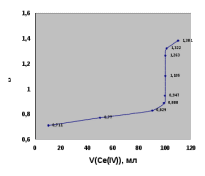 Титрлеу қисығын талдау. Егер n1=n2 тең болса, онда тотығу-тотықсыздану қисығы симметриялы болады. Потенциалдың секіру шамасы тотыққан және тотықсызданған иондардың концентрациясына, температураға, ерітіндінің рН-ына, комплекстүзуші иондарға т.б. факторларға тәуелді. Тотығу-тотықсыздану титрлеудің артықшылықтары. ТТТ өте жоғары дәлдікпен орындалады, оңай қайталанады және тез орындалады. Редокс әдісінің негізінде көптеген химиялық реакцияларды орындауға болады, сондықтан өндірістік химия-аналитикалық бақылауда кеңінен пайдаланылады. ТТТ тәсілдерімен тек тотығатын немесе тотықсызданатын жүйелерді ғана емес, сонымен қатар тотығу-тотықсыздану реакцияларына қатыспайтын компоненттерді де анықтауға болады. Эквиваленттік нүктені индикаторлармен, индикаторсызда және инструменталды әдіспен де анықтауға болады. Анықтауда түрлі титрлеу тәсілдерін: тура, кері, жанама қолдануға болады. Стандартты ерітінділері оңай даярланады, стандартты ерітінді даярлайтын қосылыстардың құрамы тұрақты, химиялық таза болып келеді. Титрлеуді ерітіндінің рН мәні әртүрлі шамада орындауға болады. Көп компонентті жүйелерді титрлеп, құрамын анықтауға болады. Тотығу-тотықсыздану тәсілдерін басқа әдістермен байланыстырып талдау фармацевтикалық талдаудың түрлі салаларында кеңінен қолдануға мүмкіншілік береді. | |||||||||||||||||||||||||||||||||||||||||||||||
