Дрістер тезистері
 Скачать 2.07 Mb. Скачать 2.07 Mb.
|
|
Дәрістер тезистері Тақырып 1: Жылу техникасының теориялық негізі және техникалық термодинамика Мақсаты:Күй параметрін және оның модификациясын күй теңдеуі көмегімен анықтау. Жоспар: 1 Жалпы мағлұмат 2 Термодинамикалық жүйе 3 Термикалық параметрлер күйі 4 Күй теңдеуі 1 Термодинамика –макроскопиялық теңдік жүйесінде жүретін және жүйеден теңдік күйге ауысу жағдайындағы жылу қозғалысының заңдары (термо) және олардың басқа қозғалыс туріне ауысу (динамика) заңдары туралы ғылым. Қарастырылып отырған сұрақтар шеңберінде техникалық және химиялық термодинамика, биологиялық жүйелер термодинамикасы және басқа жүйелерге ажыратылады. Термодинамика жылудың және жұмыстың, осы өзара ауысу заңдылықтарын, сонымен қатар осы ауысуларға қатысатын денелердің қасиеттерін, әр түрлі аппараттар және қондырғылардағы, жылу және тоңазытқыш машиналарында жүретін жылу процесстерін оқытады. Термодинамика жылутехникасының қажеттілігінен пайда болды. XIX ғ жылу қозғалтқыштарын қолдану ғылым алдында мынадай талаптар қойды: жылу машиналар жұмысының теориясын оқу және олардың пайдалы әсер коэффициентін арттыру жолдарын анықтау. Техникалық термодинамика негізінде жылу қозғалтқыштарын, коммпрессорлық машиналарын, тоңазытқыш қондырғыларын, бөлменің ауа ауысымын, ауа кондиционерін, ауыл шаруашылық өнімдерін құрғату және сақтау есептері және жобалау жүргізіледі. Жылу қозғалысы микробөлшектердің өзара әсеріне және қозғалысына негізделген. Материя қозғалысыныңжылуын оқытудың екі формасы белгілі. Статистикалық физика әдісі физикалық жүйелердің молекулярлық моделіне негізделген және математикалық ықтималдық теориясының мүмкіншіліктерін қолданады. Феноменологиялық деп аталатын термодинамикалық әдіс күй жүйесінің өзгерісін анықтайтын макроскопиялық параметрлер арасында байланыс орнатады. Термодинамика тәжірибелік жолмен алынған екі заңға негізделген. Термодинамиканың бірінші заңы термодинамикалық жүйеге қатысты энергияның ауысу және сақталу заңын орнатады. Термодинамиканың екінші заңы энергияның жылу беру сапасын көрсетеді және қайтымды және қайтымсыз процессте энтропия өзгерісімен байланысты. 2 Термодинамикалық жүйе деп жылу және механикалық әсерде жүретін материалды дене жиынтығын айтамыз, яғни термодинамикалық теңдіктегі макроскопиялық жүйелер. Қоршаған ортада энергияалмасу және зат алмасу жүрмейтін жүйені оқшауланған жүйе деп аталады (жабық). Егер жүйеде ішкі ортамен жылу алмасу жүрмесе, онда оны жылуоқшауланған немесе адиабаталық жүйе деп аталады. Термодинамикалық жүйе жұмыс денесінен (газдар, ауа, бу) және жылу көздерінен тұрады. Молекулалар және молекула көлемінің арасында күштің өзара әсеріндегі газдар иделды немесе нақты газдар деп аталады, яғни өзара әсерсіз нүктелер жүйесінің қасиеттері бар газдар. 3 Макроскопиялық өлшемдер, яғни берілген моменттегі жүйе күйін анықтайтын өлшемдер, күй параметрі деп аталады.Күй параметрінің термиялық және калориялық түрлері бар.Термиялық күй параметріне абсолютті қысым р, меншікті көлем v және абсолютті температура Т;ал калориялық күй параметріне ішкі энергия, энтальпия h және энтропию s жатады. Жүйедегі дене массасына немесе бөлшектер санына тәуелсіз параметрлер интенсивтідеп аталады (мысалы, қысым, температура); ал жүйедегі массаға немесе бөлшектер санына мәндері пропорционал параметрлер аддитивті немесе экстенсивті деп аталады (энергия, энтропия және т.б.). Қысым — хаотикалық қозғалатын (реттелмеген қозғалыс)жұмыс денесінің микробөлшектерінің соғылу нәтижесі.В соответствии с молекулярлық-кинетикалық теория негізінде газ қысымы мына теңдеумен анықталады 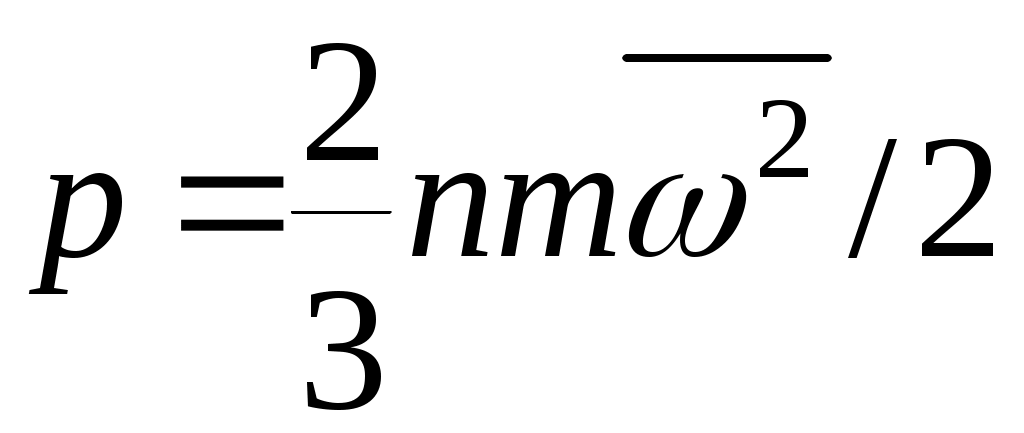 (1.1) (1.1)мұндағы Қысым Паскальмен өлшенеді, яғни. 1 Па=1 Н/м2.Тәжірибеде көбінесе мына өлшемдерді қолданад: 1 кПа=103 Па и 1 МПа =106 Па. Қысымды өлшеуге - манометр, барометр және вакуумметр қондырғылары қолданылады. Абсолютті қысым мына қатынастан табылады: р = рман + В, (В –барометрлік қысым, рман - манометр көрсеткіші) немесе р = В - рвак (рвак - вакуумметр көрсеткіші). Газдардың молекулярлық-кинетикалық теориясы негізінде температура Т жұмыс денесінің бөлшектер қозғалысына пропорционалды. 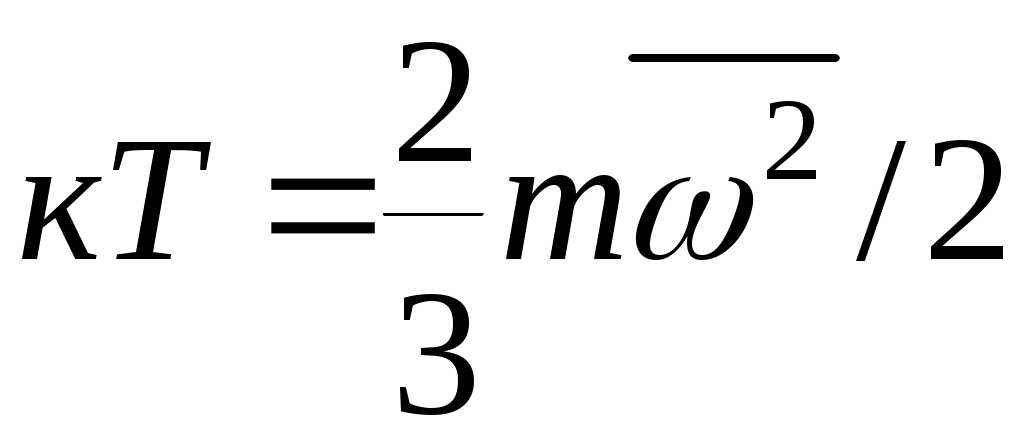 (1.2) (1.2)мұндағы к — Больцман тұрақтысы, 1,380662 10-23 Дж/К тең. Температура тек қана термодинамикалық теңдік жүйесінде болады, олар бір –бірімен әсерлеспейді, яғни температура термодинамикалық теңдік параметрі болып табылады. (1.2) теңдеуінен табылатын температура термодинамикалық деп аталады (абсолютті). Термодинамикалық температура ұғымы термодинамиканың екінші заңынан шығады. Абсолютті температура шкаласы үшін есептік екі нүкте бар. Есептеу алдында абсолютті нолді алады, бұл кезде молекуланың жылулық қозғалысы тоқтатылады.Есептеудің басқа нүктесі (судың үштік нүктесінің температурасы, яғни мұз, су және бу , осы үш фаза арасындағы теңдік . температурасы) 273,16 К (0,01°С) тең. Отношение 1/273,16 қатынасы термодинамикалық температура шкаласы бойынша есептеудің екі неүтесі арасындағы интервал, К (Кельвин). Температураны сонымен қатар Цельсия шкаласы бойынша өлшейді, мұнда ноль ретінде мұздың еру температурасын алады, 100°С-қа 101325 Па қысым кезінде судың қайнау температурасын алады. Термодинамикалық температура Т (К) және Цельсия температурасы t (°C) арасындағы байланыс мынадай: Т=1+273,15 Температураны өлшеу үшін сұйықтық термометрді, термопарды, пирометрді және басқа да құралдарды қолданады. Меншікті көлем v – бұлзаттың бірлік массасын алатын көлем.Массасы т және көлемі V біртекті көлем үшін меншікті көлем мына формуламен анықталады V Меншікті көлемге кері өлшем -дененің тығыздығы p=l/v, бұдан pv=l. Меншікті көлемнің өлшем бірлігі м3/кг, ал тығыздықтың өлшем бірлігі — кг/м3. 4 Термодинамикалық жүйелердің теңдігі үшін термиялық параметрлер арасында күйдің термиялық теңдеуі деп аталатын функционалды байланыс орнатылған. Температураны Т, сыртқы параметрлерді және ішкі энергияны байланыстыратын теңдеулерді күйдің калориялық теңдеуі деп аталады. Егер күйдің термиялық және калориялық теңдеуі белгілі болса, онда термодинамиканың бірінші және екінші заңдары арқылы жүйенің барлық термодинамикалық қасиеттерін анықтауға болады. Идеал газдардың күйтеңдеуі 1 кг газ үшін мұндағы Идеал газ күйінің теңдеуінен табамыз Газ тұрақтысы — бұл тұрақты көлемдігі 1 кг идеал газдың және температураның 1 К өзгеру жұмысы. Егер (1.3) теңдеудегі - ны мұндағы Егер (1.6) теңдеуін нақты физикалық шарттар үшін жазсақ, онда 1 кг нақты жұмыс денесінің газ тұрақтысы мынаған тең Әдебиеттер: 2, б.3-27; 5, б.6-11; 7, б.5-27. Бақылау сұрақтар: 1. Термодинамика нені оқытады? 2. Термодинамикада қандай күй параметрлері бар? 3. Қысымды өлшеуге арналған құралдар? 4. Меншікті көлем неге тәуелді? 5. Күй теңдеуін жаз. Күй теңдеуінің модификациясы? 6. Универсалды газ тұрақтысы нешеге тең? Тақырып 2 : Термодинамиканың бірінші заңы. Мақсаты:термодинамиканың бірінші заңының теңдеуін шығару және осы заң көмегімен энергиялар арасындағы байланысты анықтауды студенттерге үйрету. Жоспар: 1. Ішкі энергия. 2. Жұмыстың аналитикалық өрнегі. 3. Қайтымды және қайтымсыз процесстер. 4. Жылу сыйымдылығы. 5. Термодинамиканың бірінші заңының аналитикалық өрнегі. 1 Термодинамиканың бірінші заңы энергияның сақталу және айналу заңының жалпы заңдылығы болып табылады. Ішкі энергия. Ішкі энергия деп денеде немесе дене жүйісіндегі барлық энергияны айтады. Бұл энергияны әр энергия қосындысы ретінде жазуға болады: мұндағы Ішкі энергияның абсолютті мәнін анықтау мүмкін емес, сондықтан Кинетикалық энергия температураға ғана тәуелді, ал потенциалды энергия меншікті көлемге де тәуелді болуы мүмкін. Ішкі энергия қасиеті: 1. Ішкі энергия күй функциясы болып табылады. 2. Ішкі энергия өзгерісі процесс жолына тәуелді емес және тығыздық берілген бастапқы және ақырғы күймен анықталады. 3.Айналмалы процесстерде 2 Жұмыстың аналитикалық өрнегі. Жұмыс денесі көлемінің өзгеруіменбайланысты бір денеден екінші дееге энергияны беру процессін жұмыс деп атайды. Жасалған жұмыс Р, V, Т параметрлерінің өзгерісіне тәуелді. Жұмыс теңдеуін шығару үшін мысал қарастырайық. 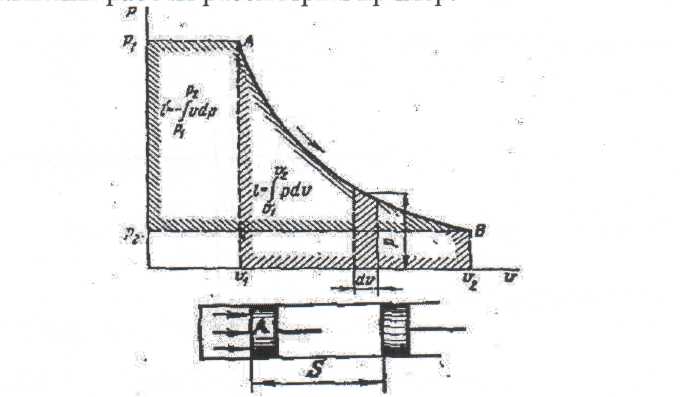 Сурет 2.1 – Жұмыс процессінің анализі Поршенді цилиндрде теңдік процессінде қоршаған орта қысымына және V меншікті көлемге тең Р қысымды газ болсын, поршен ауданы F. Егер газға жылу мөлшерін жіберсек, онда ол тұрақты қысым кезінде кеңейеді. Поршенге әсер ететін күш Р F тең, s жол (орын ауыстыру) Жұмыс мына формуламен анықталады: онда 1-2 процесстегі жұмыс 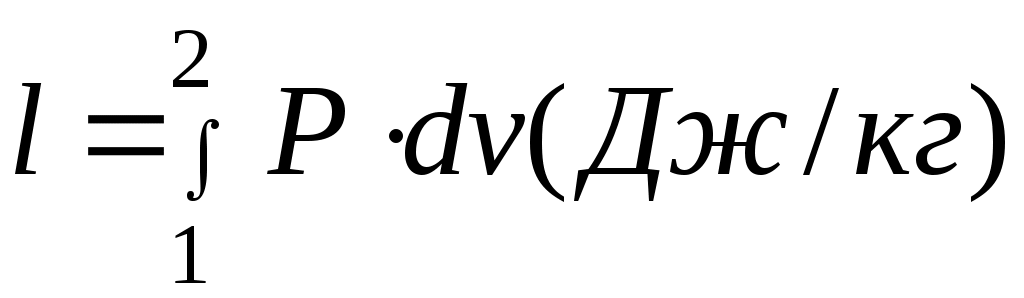 (2.3) (2.3)Қасиеттері: 1. 2. 3. 4. 3. Жұмыс 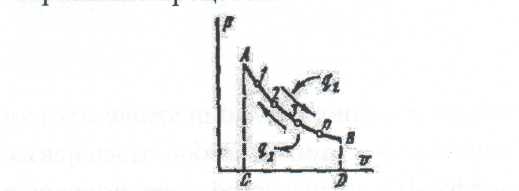 Сурет 2.2 – Қайтымды және қайтымсыз процесстер А-В газдың кеңею процессін қарастырайық.Бұл процессте қандайда бір масштабта АВСД ауданмен берілген жұмыстың кеңеюі алынды. Жұмыс денесін бастапқы күйге (нүкте. А) келтіру үшін, В нүктесінен қайтымды процесс- сығылу процессін жүргізу қажет.Егер сығылу процессіндегі шығындалған жұмыс тура процесстегі кеңею жұмысына тең болса, онда тура процесстегі барлық нүктелер кері процесстермен сәйкес келеді. Жұмыс денесінде немесе қоршаған ортада тура және кері бағытта жүреті мұндай процесстер қайтымды деп аталады. Тепе-теңсіздік күйде өтеті әр бір термодинамикалық процесс термодинамиканың қайтымсыз процессі деп аталады. Кеңею кезінде газ максималды жұмыс жасайды: 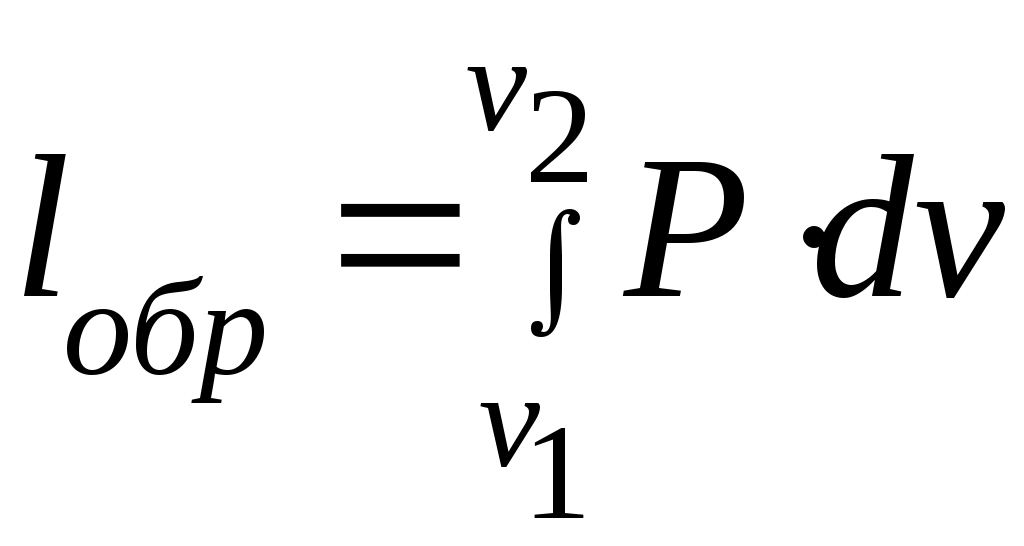 мұндағы Р – ішкі орта қысымына тең жұмыс денесінің қысымы. Газдың кеңеюі кезідеа Қайтымды процесстер ғана графикалық болуы мүмкін, өйткені бұл диаграммадағы әр нүкте дененің тепе-теңдік күйін сипаттайды. Үйкелумен және жылу берумен сипатталатын процесстер қайтымсыз болып табылады. Бірақ көптеген қайтымсыз процесстердің қайтымды процесстерден айырмашылығы аз және тәжірибеде қайтымды процесстерді қайтымсыз процесстерге ауыстыру номограмма, диаграмма және т.б. көмегімен жүргізіледі. Жылу сыйымдылығы. Дененің жылу сыйымдылығы деп дені 1 градусқа қыздыру үшін қажетті жылу мөлшерін айтады. Жылу сыйымдылығының 5 түрінажыратады: 1. Нақты жылу сыйымдылығы – дене күйінің азғантай өзгерісі кезінде денеге хабарланатын жылу мөлшерінің 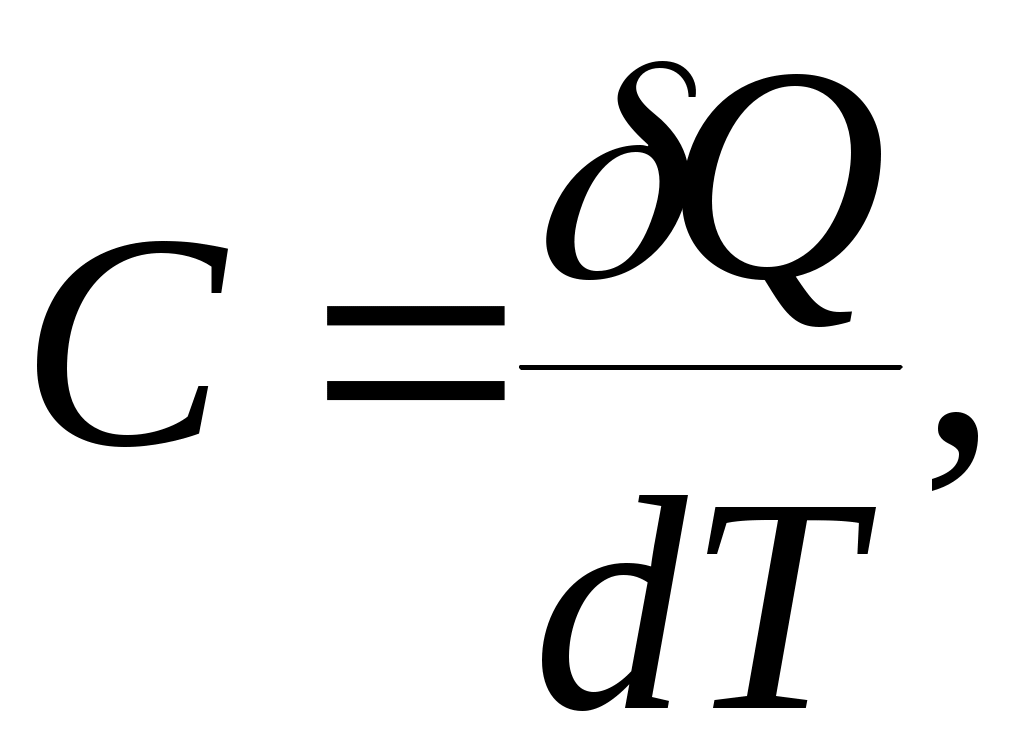 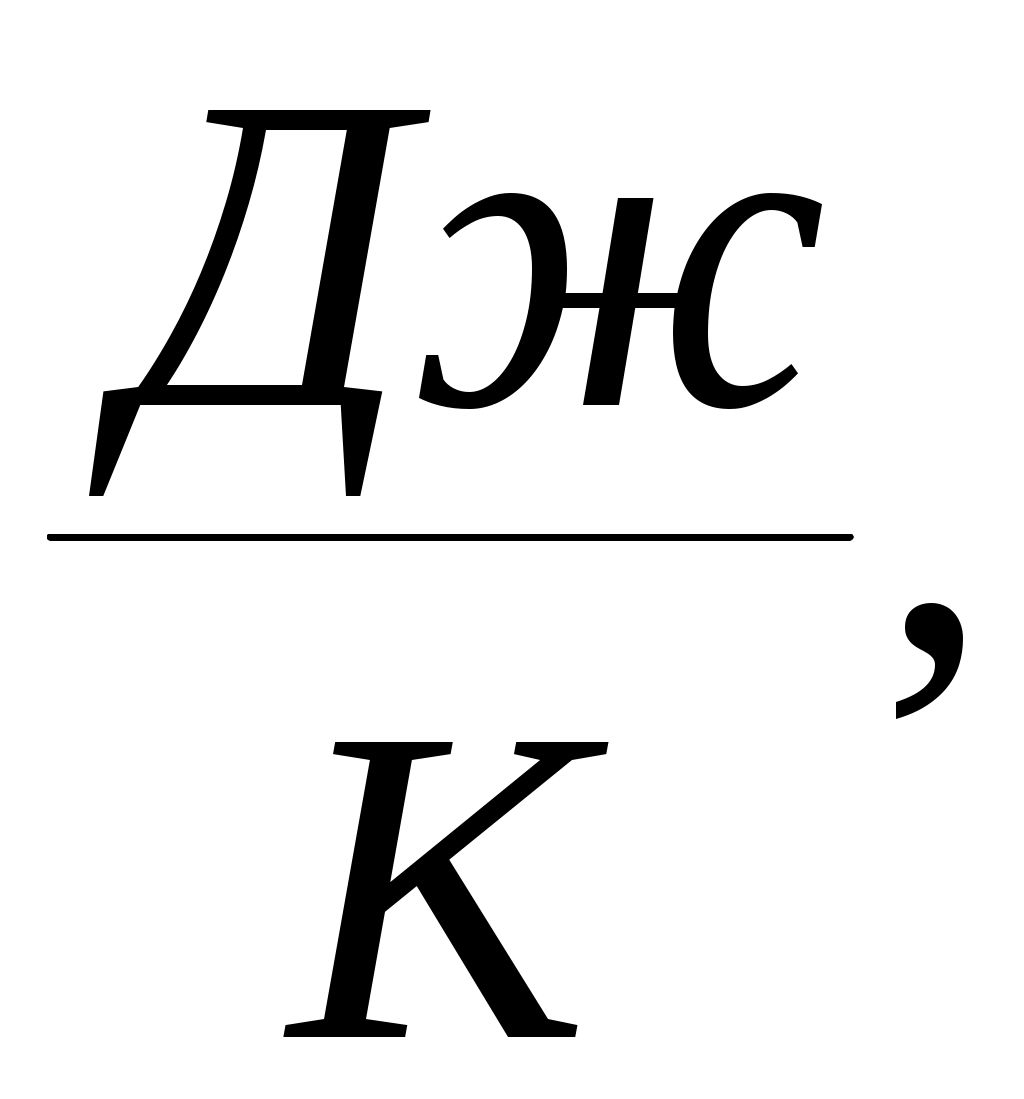 (2.4) (2.4)2. Меншіктіжылу сыйымдылығы деп – заттың бірлік санына қатысты жылу сыйымдылығын айтады: 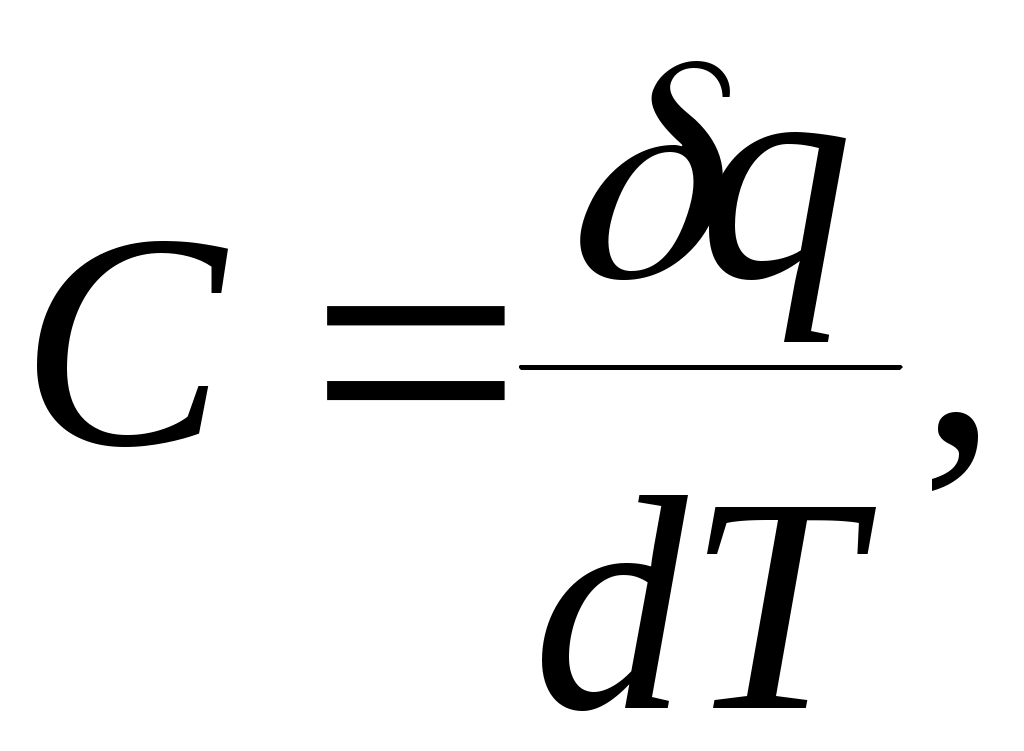 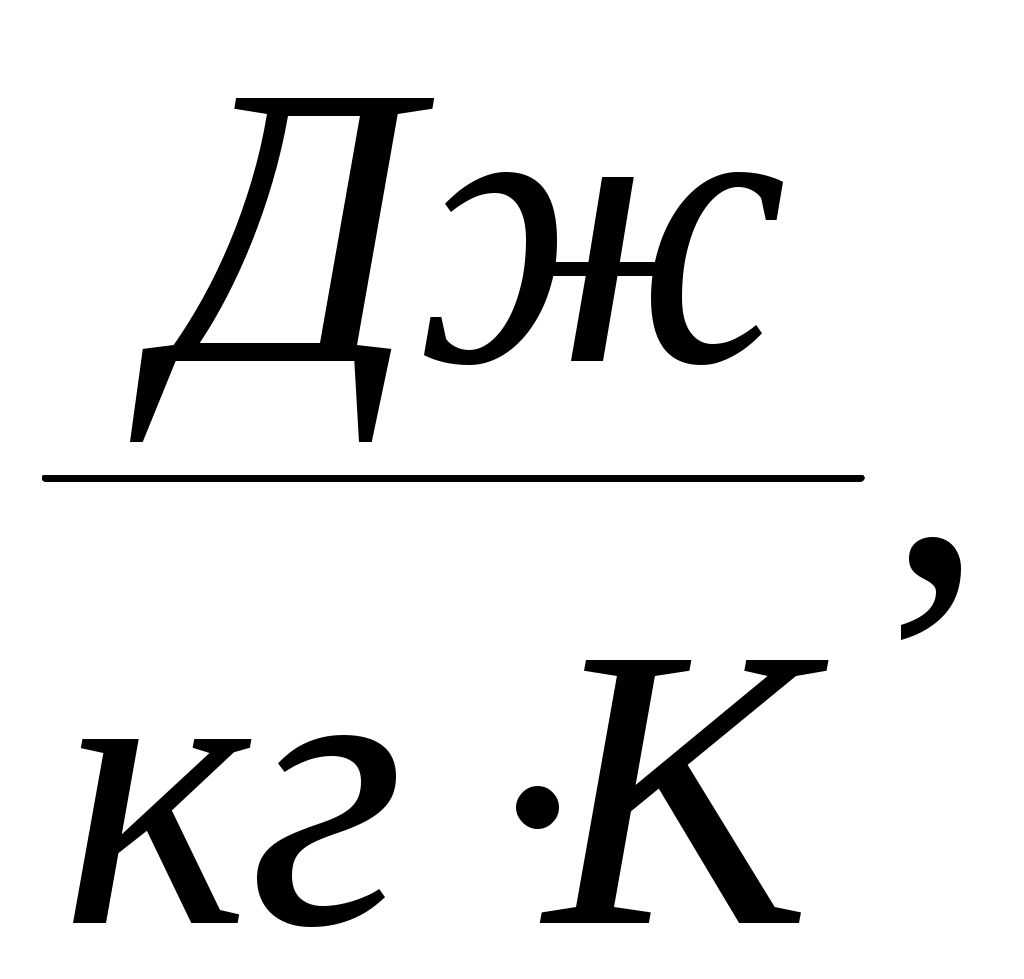 (2.5) (2.5)мұндағы 3. Бір кило моль зат мөлшеріне қатысты жылу сыйымдылығын молярлы жылу сыйымдылығы деп атайды: 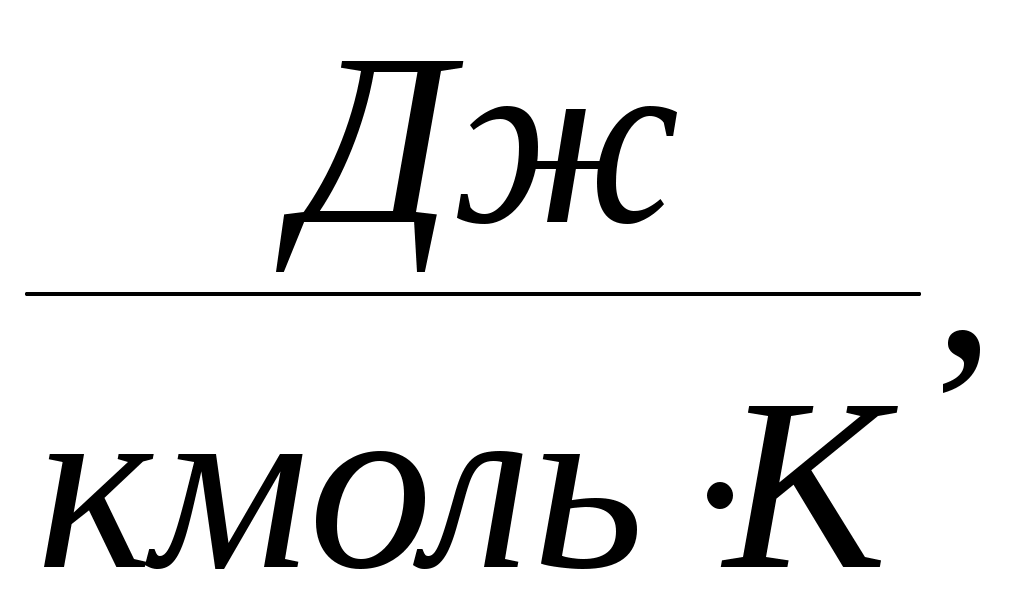 (2.6) (2.6)мұндағы 4.Қалыпты жағдайда 1м3 көлемді газға қатысты жылу сыйымдылығын көлемдік жылу сыйымдылғы деп атайды (:қалыпты жағдайда Р = 101325 Па, t = 0°С): 5. Берілген процесстің орташа жылу сыйымдылығы - Жылу сыйымдылығының қасиеттері: 1. Жылу сыйымдылығы жіберілген немесе алынған жылу кезіндегі термодинамика сипаттамасына тәуелді. 2. Жіберілген немесе алынған жылусыз (адиабаталық процесс) жылу сыйымдылығы 0 тең. 3. Термодинамикалық процесстер үшін, тұрақты көлем кезінде жылу сыйымдылығы мұндағы Кесте 2.1 – Тұрақты қысымкезіндегі молдік жылу сыйымдылығы
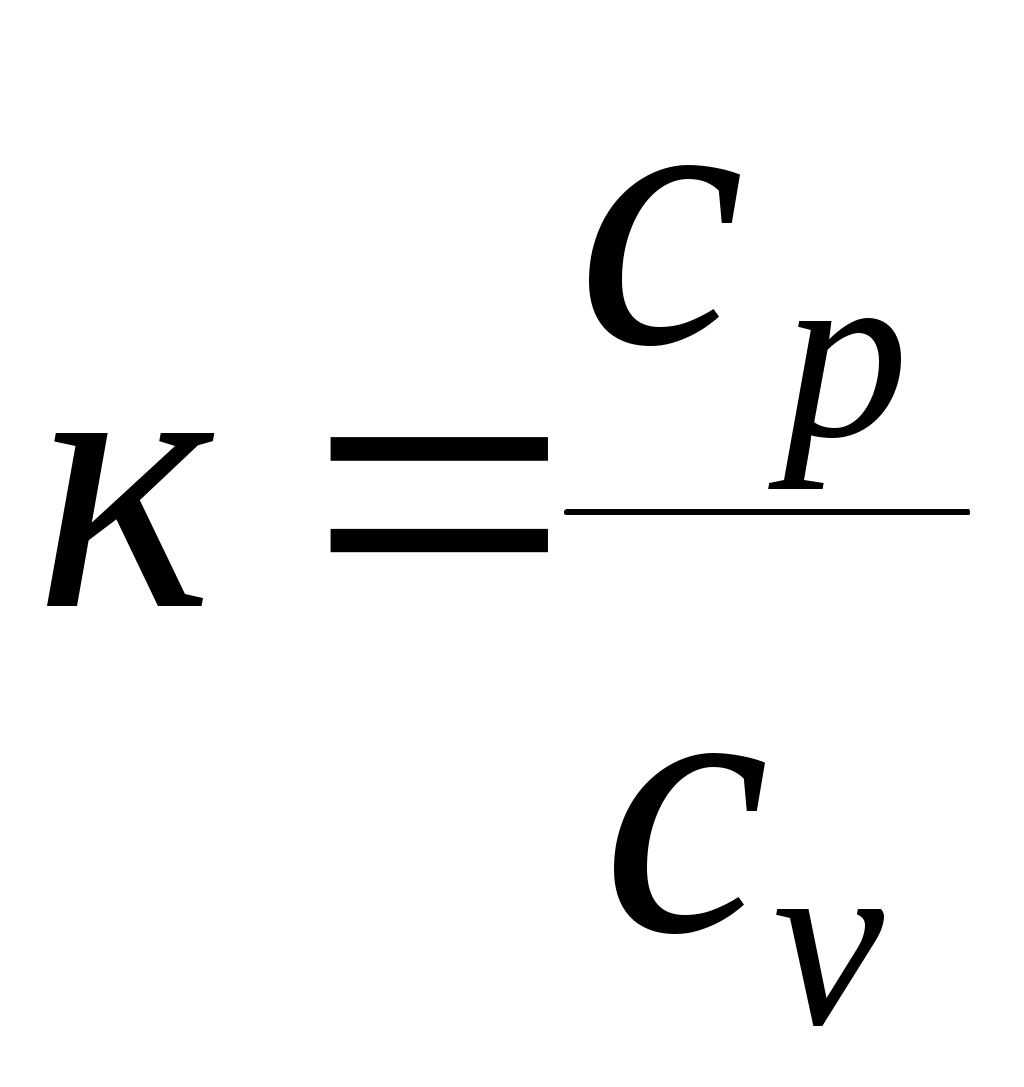 (2.10) (2.10)к заттағы атомдар санына тәуелді. ккейбір мәндері 2.2 кестеде берілген. Кесте 2.2 – Адиабата көрсеткішінің кейбір мәндері (Пуассон коэффициент)
5. Термодинамиканың бірінші заңының аналитикалық теңдеуі 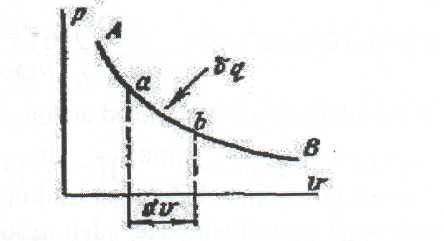 Сурет 2.3 – Термодинамиканыңбірінші заңы немесе | ||||||||||||||||||||||
