Дрістер тезистері
 Скачать 2.07 Mb. Скачать 2.07 Mb.
|
|
Әдебиеттер: 2, бет. 51-57; 5, бет. 11-18; 7, бет.45-62. Бақылау сұрақтар: 1. Жұмыс ұғымына анықтама бер. 2. Жұмыс қандай параметрлерге тәуелді? 3. Жұмыстың негізгі қасиеттерін ата. 4. Қайтымды процесстің қайтымсыз процесстен айырмашылығы? 5. Жылу сыйымдылығы дегеніміз не? 6. Жылу сыйымдылығының негізгі түрлерін ата. 7. Термодинамиканың бірінші заңына сәйкес жылу нее тең? Тақырып 3: Идеал газдарадың термодинамикалық процестері. Мақсаты: газдардың идеалды процестерін үйрену, әр процестегі параметрлер күйін анықтау. Жоспар: 1. Процестерді зерттеудің жалпы сұрақтары 2. Изохоралық процесс 3. Изобаралық процесс 4. Изотермиялық процесс 5. Адиабаталық процесс 6. Политропты процесс 1 Процесстерді зерттеудің жалпы сұрақтары. Термединамиканың бірінші заңы жылу мөлшері, газдың сыртқы жұмысы және ішкі энергия өзгерісі арасында байланыс орнатады. Жіберілген немесе алынған жылу процеске байланысты. Теориялық зерттеулерде, сонымен қатар техникадағы тәжірибелік жұмыстарда қолданылатын негізгі процесстер мыналар: изохоралық - тұрақты көлемде жүретін процесс,изобаралық – тұрақты қысымда жүретін процесс, изотермиялық – тұрақты температурада жүретін процесс, адиабаталық – сыртқы ортамен жылу алмасу жүрмеген кездегі процесс. Сонымен қатар, белгілі бір шарттарда негізгі процесстер үшін ортақ процесстер – политропты процесстер бар. Зерттеудің жалпы әдестері барлық процесстерге бекітілген, олар мыналарға негізделген: 1. P-V- және T-Sдиаграммаларында процесстің қисық теңдеуі шығарылады; 2. Процесстің басында және соңында жұмыс денесінің негізгі параметрлері арасында байланыс орнатады; 3. Меншікті газдың барлық процесстеріне арналған формула бойынша ішкі энергия өзгерісін анықтау 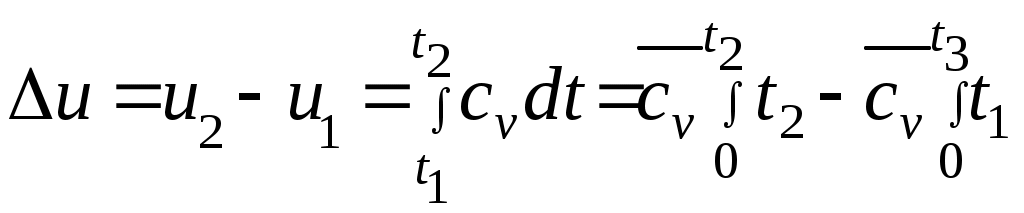 немесе тұрақты жылу сыйымдылығы кезінде: Жұмыс және газ көлемінің өзгерісі негізгі формула бойынша анықталады: 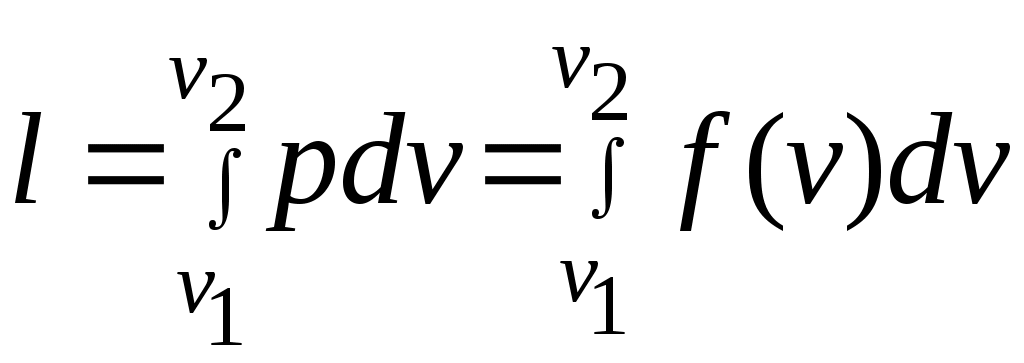 Меншікті жылу мөлшері мына формуламен анықталады: 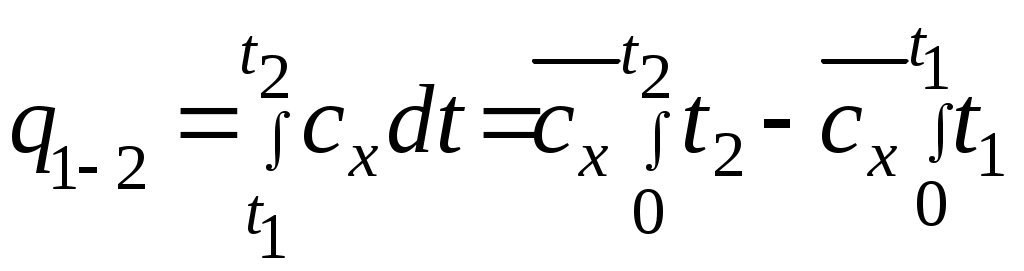 Идеал газдардың барлық процесстеріне арналған формула бойынша меншікті энтольпия өзгерісі мына формуламен анықталады: 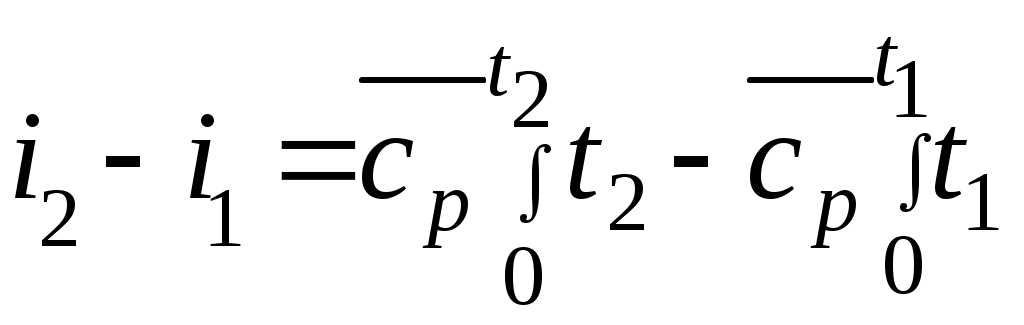 немесе тұрақты жылу сыйымдылығы үшін: Идеал газдардың меншікті энтольпия өзгерісі мына формуламен анықталады: Қарастырылған процесстер қайтымды болып табылады. 2 Изохоралық процесс. Тұрақты көлемде жүретін процесс изахоралық деп аталады (dv = 0, немесе v = const). 3.1 суретте изахоралық процесстің графигі берілген.  Сурет 3.1 - P-V диаграммадағы изахоралық процесс бейнеленген. Идеал газдың күй теңдеуінен Тұрақты көлем кезінде газ қысымы абсолютті температураға тура пропорционалды өзгереді: 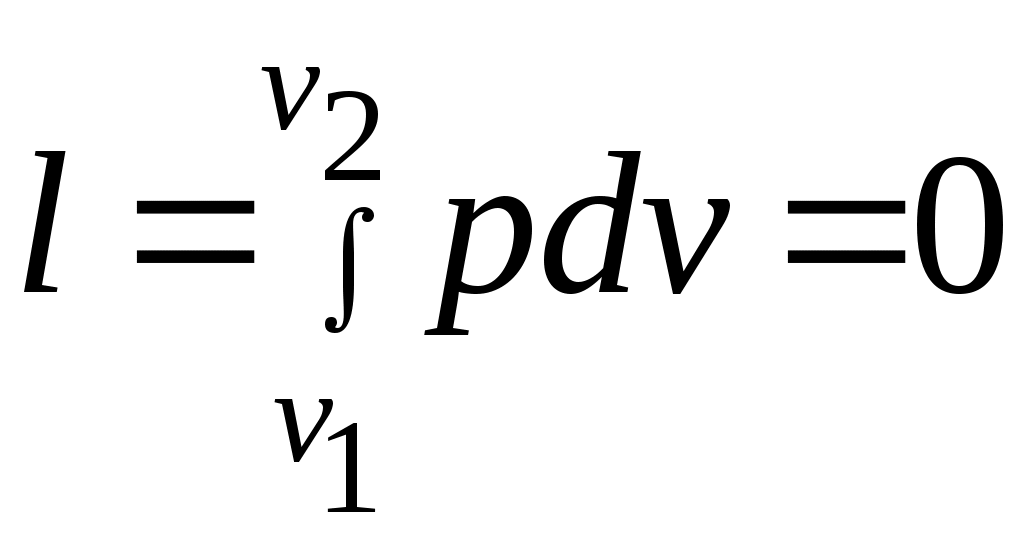 Меншікті сыртқы жұмыс 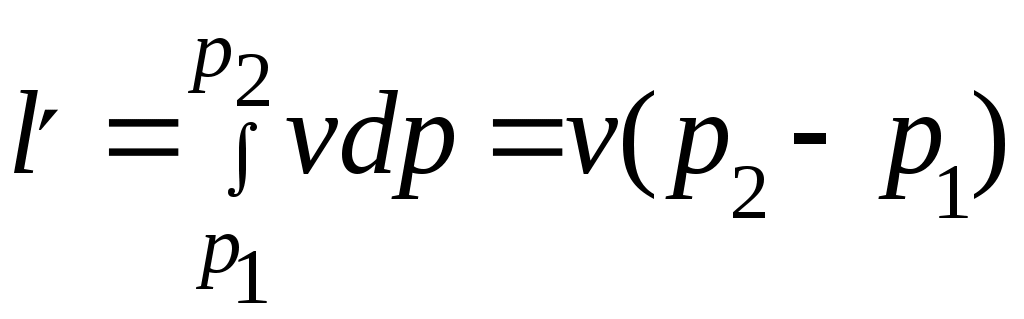 Термодинамиканың бірінші заңының негізгі формуласы (2.12) Жылу сыйымдылығы тұрақты кезінде жылу мөлшері 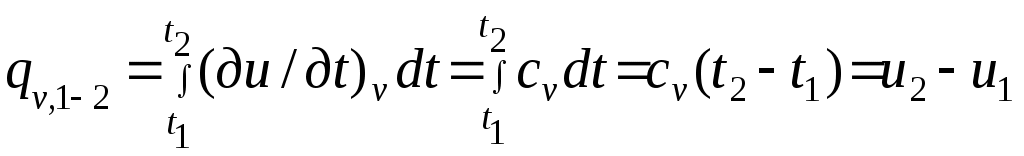 Жылу сыйымдылығы ауыспалы кезінде 1-2 процессте 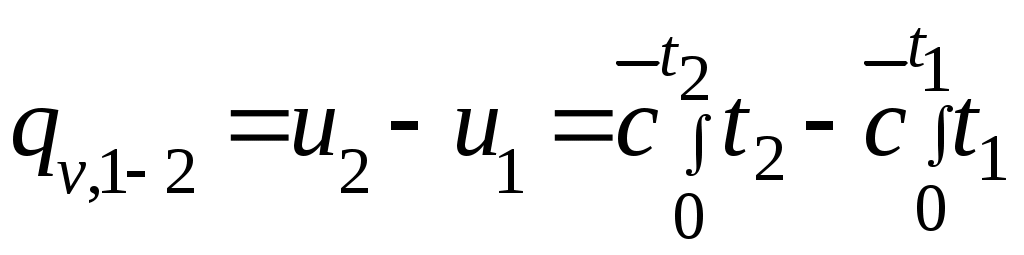 (3.2) (3.2)Қайтымды изохоралық процессте меншікті энтольпия өзгерісі мына теңдіктен анықталады: 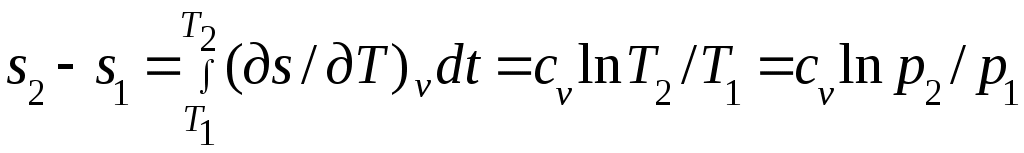 (3.3) (3.3)2 – нүктедегі жанама аналитикалық изометрия ережесі бойынша мынаған тең: Әр түрлі көлемді изохоралар, бір температурада бұрыштық коэффициенті бірдей, эквидистантты қисықтар болып табылады. Әр түрлі көлемдер үшін құрылған изохоралар 3 Изобаралық процесс. Тұрақты қысым кезінде жүретін процесс изобаралық деп аталады (dp = 0, немесе р = const). Процесс қисығы изобара деп аталады. 2 суретте процесс графигі бейнеленген. Идеал газ күйінің теңдеуінен изобаралық процесс үшін Бұл қатынас Гей-Люссак заңы деп аталады. 2 процесс үшін 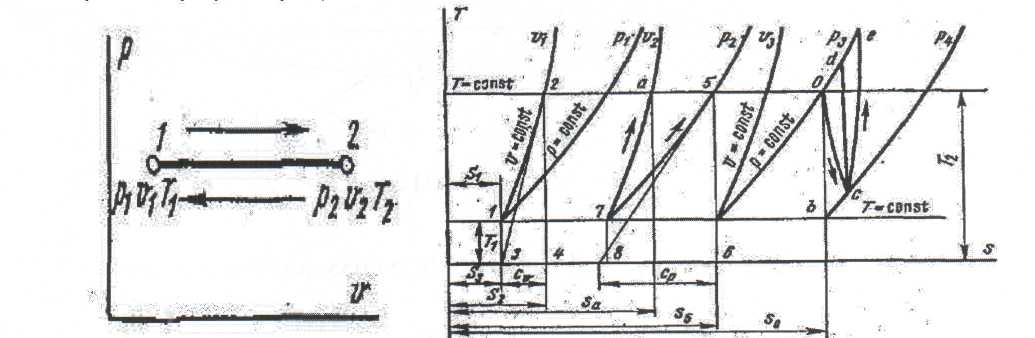 Сурет 3.2 - P-V және T-S диаграммаларындағы изобаралық процесс. Бір мөлшерлі газдардаң көлемі изобаралық процессте абсолютті температураға тура пропорционалды өзгереді. Газ кеңейген кезде оның температурасы өседі, ал сығылған кезде төмендейді. Осыдан көлемнің өзгерген меншікті жұмысы мына теңдеумен өрнектеледі: 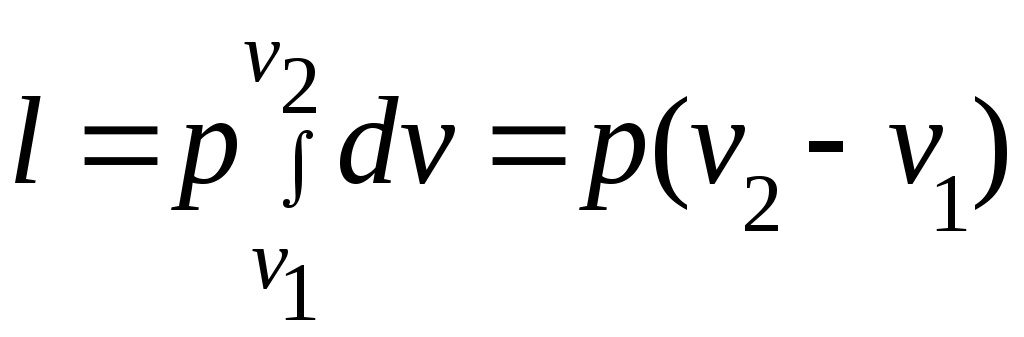 (3.5) (3.5)немесе Меншікті сыртқы жұмыс 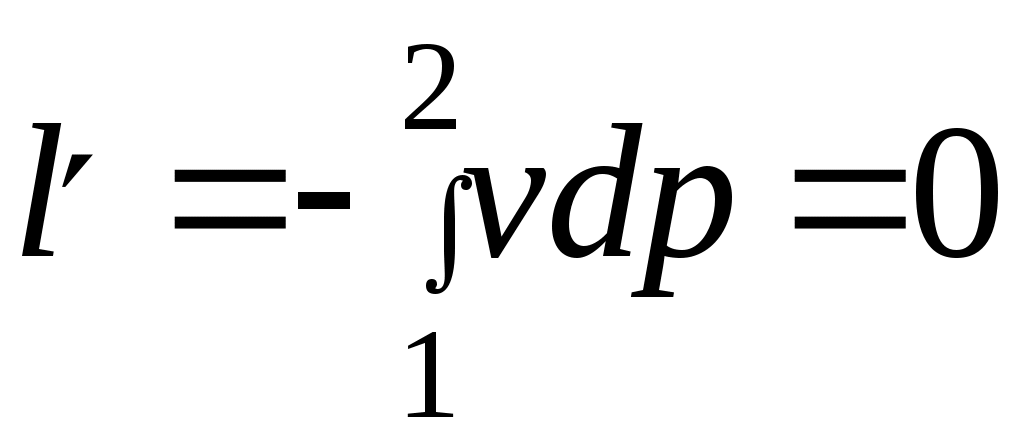 Меншікті ішкі энергияның өзгерісі Осыдан, тұрақты жылу сыйымдылығы кезіндегі изобаралық процессте денеге хабар беретін меншікті жылу мөлшері мынаған тең 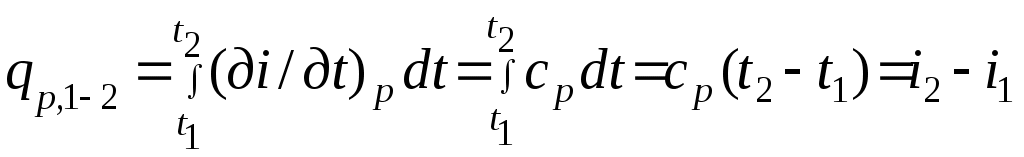 (3.7) (3.7)ауыспалы жылу сыйымдылығы кезінде 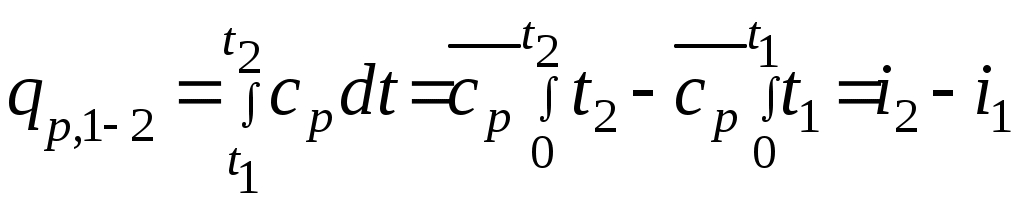 (3.8) (3.8)Тұрақты жылу сыйымдылығы кезіндегі қайтымды изобаралық процесс үшін меншікті энтропия өзгерісі мына теңдеуден анықталады: бірақ 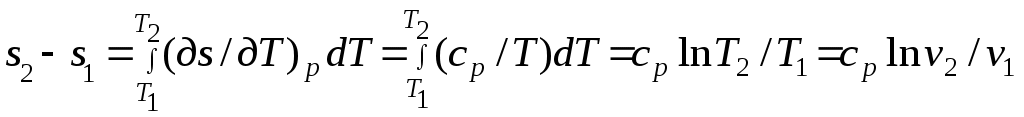 (3.9) (3.9)Ts- диаграммасындағы изобара 7-5 қисығымен бейнеленген (сурет 3.2). 7-5 қисығының жанамасы оның әр нүктесінде нақты жылу сыйымдылығының мәнін Бір температурада бұрыштық коэффициенті бірдей барлық изобаралар эквидистантты қисықтар болып табылады. Изобаралар арасындағы арақашықтық қысымға және газ табиғатына байланысты екенін соңғы теңдеуден көруге болады.Газ қысымы неғұрлым үлкен болса, изобара соғұрлым координат өсіне жақынырақ орналасады. 4 Изотермиялық процесс Тұрақты температура кезінде жүретін процессті изотермиялық деп атайды 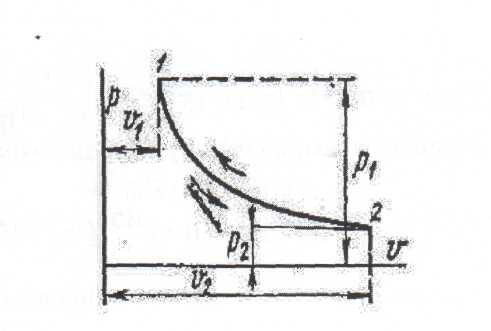 Сурет 3.3 - P-V және T-S диаграммаларындағыизотермиялық процесс Идеал газдардың изотермиялық процессі үшін немесе Тұрақты температура кезінде газ көлемі оның қысымына пропорционалды өзгереді ( Бойль-Мариотта заңы ). P-V диаграммасында изотермиялық процесс теңбүйірлі гиперболоид түрінде беріледі. 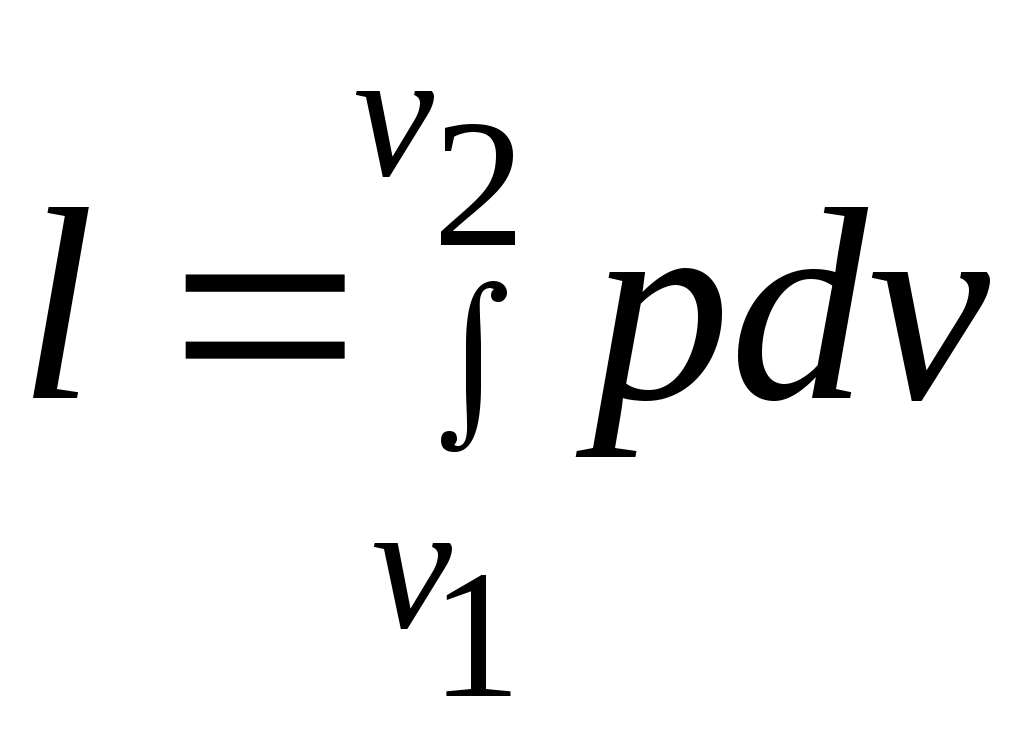 , ,изотермиялық теңдеуден 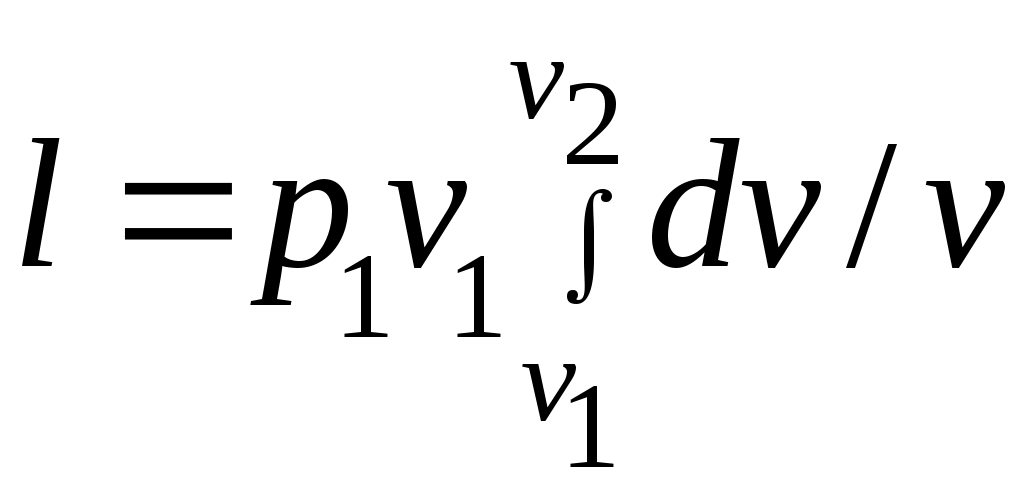 Соңғы теңдеуді интегралдау арқылы мынаны аламыз (3.11) теңдеуінен идеал газдың меншікті жұмысын және сыртқы меншікті жылу мөлшерін анықтайды. Ондық логарифмге ауыссақ, ондаам 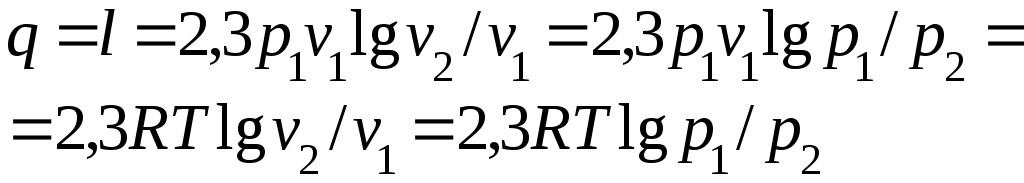 (3.12) (3.12)Меншікті жұмыс 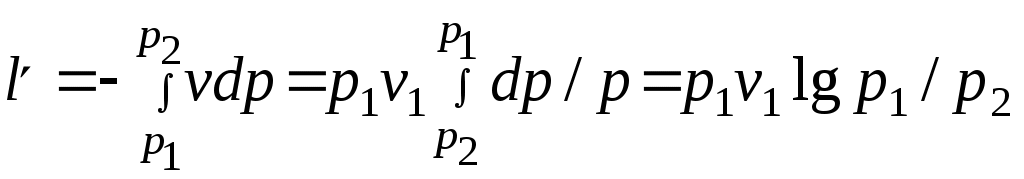 (3.13) (3.13)яғни идеал газдың изотермиялық процессінде Идеал газдың энтальпиясы және ішкі энергиясы өзгермейді, яғни Изотермиялық процесстегі меншікті жылу мөлшері Т абсолютті температурада меншікті энтропия өзгерісіне тең 5 Адиабаталық процесс Жылу берусіз жүретін процесс, яғни жұмыс денесінің қоршаған ортамен жылу алмасусыз жүретін процесс адиабаталық деп аталады.Адиабаталық процессті алу үшін қажетті шарт: Термодинамиканың бірінші теңдеуінен Бірінші теңдеуді екіншісіне бөлсек, онда 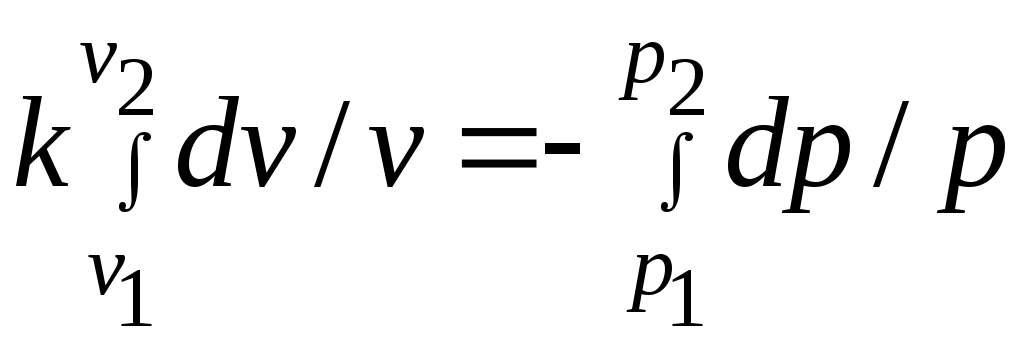 және және осыдан адиабата теңдеуі Адиабаталық процесстегі газ қысымы мен көлемінің Адиабата теңдеуінен Егер бұл парамертлер қатынасын процесстің күй теңдеуіне 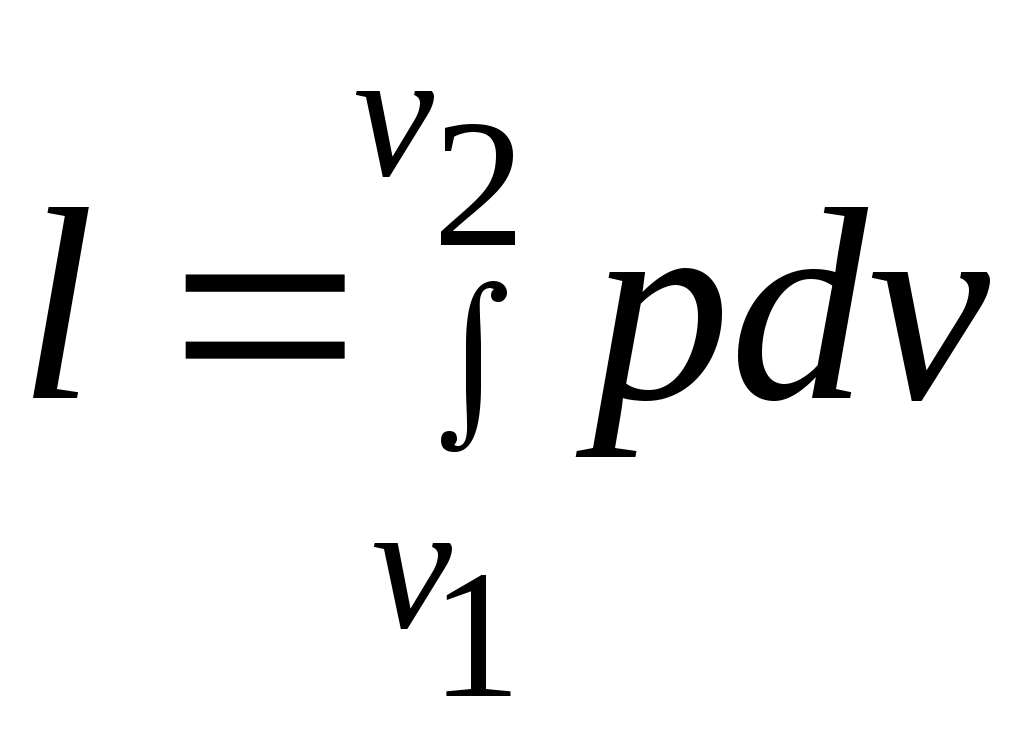 меншікті жұмыс көлемінің өзгерісі адиабаталық процессте, меншікті жұмыс көлемінің өзгерісі адиабаталық процессте, 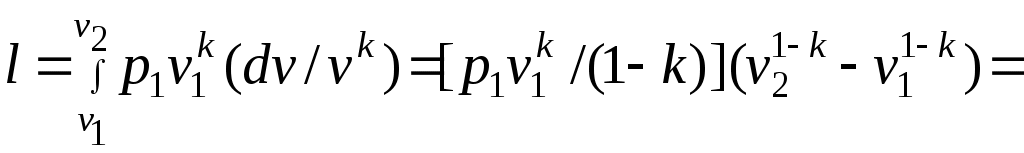 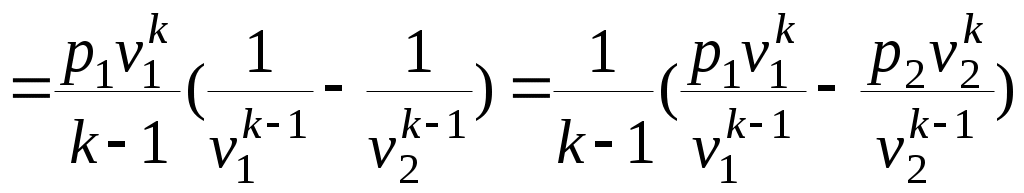 Осыдан (3.16) өрнегінен келесі формулаларды алуға болады: Температуралар қатынасын клем мен қысымның қатынасымен ауыстырамыз: 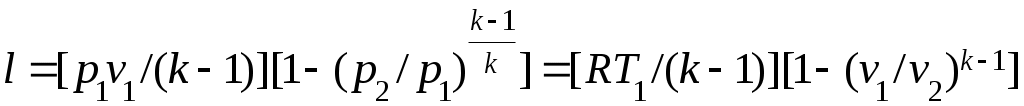 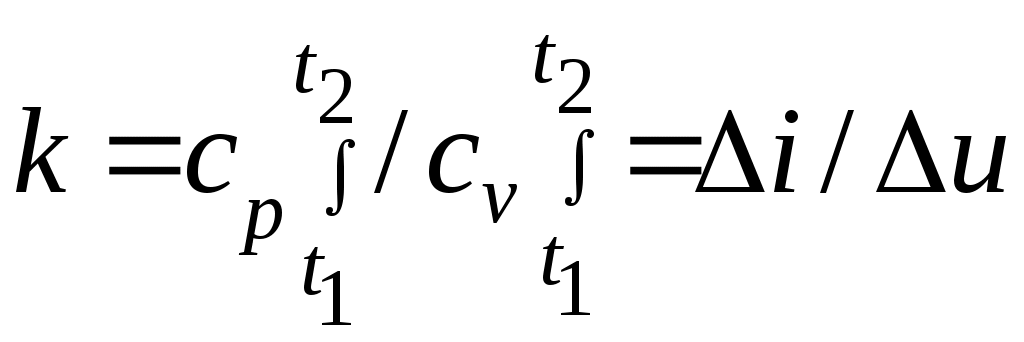 . .(2.11) және (2.12) термодинамиканың бірінші заңының теңдеуі адиабаталық процесс үшін Осыдан Бұл қатынастан мынаны алуға болады Алынған теңдеу адиабаталық (изоэнтроптық) процесстің дифференциалды теңдеуі. Бұл теңдеуде Термодинамиканың бірінші заңына сәйкес меншікті жылу көлемінің өзгерісі 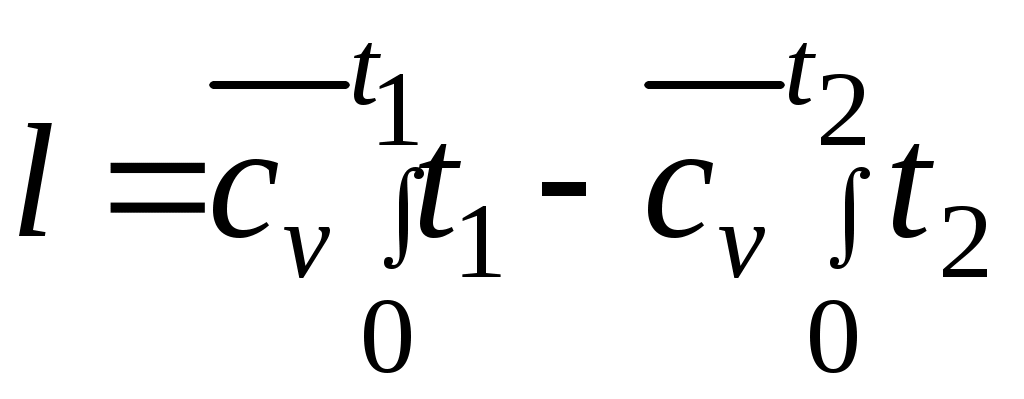 . .Егер газ кеңейсе, онда ішкі энергия және температура азаяды, ал егер газ сығылса, онда ішкі энергия және температура ұлғаяды. Адиабаталық процесстегі сыртқы жұмысты табайық: 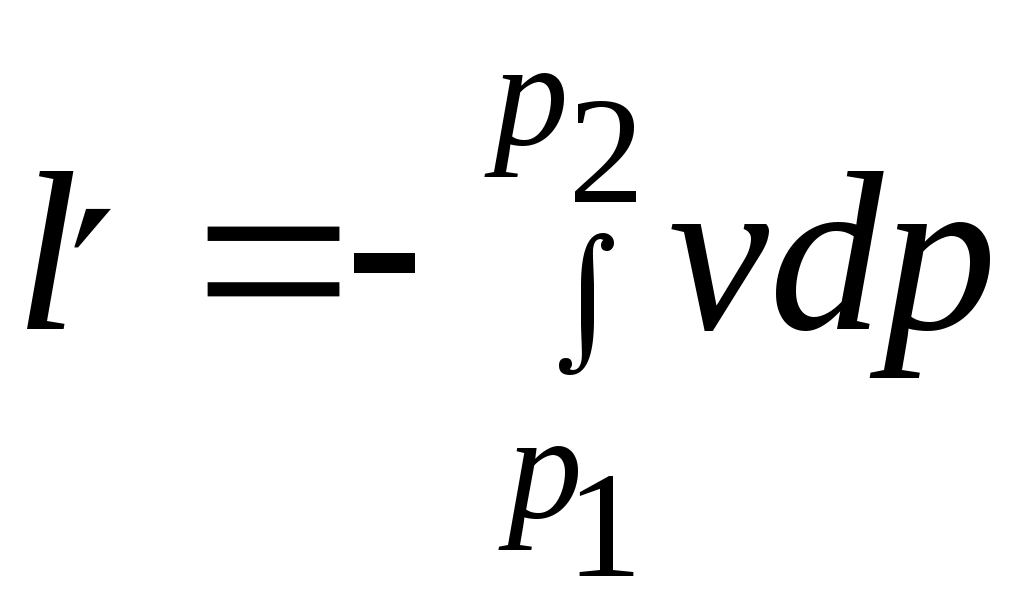 . .Адиабата теңдеуінен (3.15) Осыдан, және 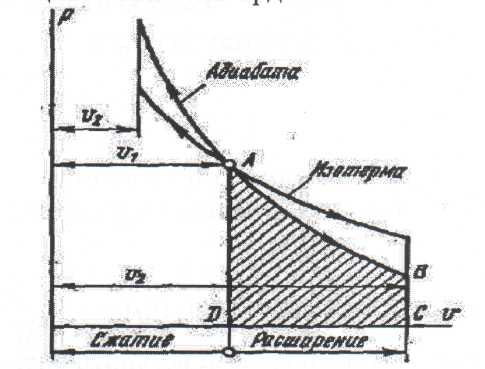 Сурет 3.4 - Адиабата және изотерманың P-V диаграммасы Қайтымды процесс үшін Қайтымсыдз адиабаталық процессті Ts — диаграммада көрсетуге болады. Қайтымсыз процесстерге термодинамиканың бірінші заңын (2.11) қолдана отырып, және 6 Политропты процесс Жылу сыйымдылығы тұрақты кезінде жүретін процесс политропты деп аталады. Политропты процесстің меншікті жылу сыйымдылығы Политропты процесстегі меншікті жылу мөлшері Политропты процесстің теңдеуі термодинамиканың бірінші заңының теңдеуінен шығады: Бұл теңдеуден Алынған теңдеуді процесстің бастапқы және ақырғы шегінде интегралдаймыз немесе Алынған теңдеу политропты процесс теңдеуі деп аталады. Политропты процесстің меншікті жылу сыйымдылығы мына формуладан анықтаймыз: Егер (3.21) теңдеуге әр процесс үшін Изохоралық процесс Изобаралық процесс Изотермиялық процесс Адиабаталық процесс Политропты процесстегі меншікті жұмыстың теңдеуі: немесе Полтропты процессте газдың меншікті ішкі энергия өзгерісі және меншікті жылу мөлшері мына формуламен анықталады: Политропты процесстің сыртқы жұмысы аналогиялық жағынан адиабаталық процесске тең 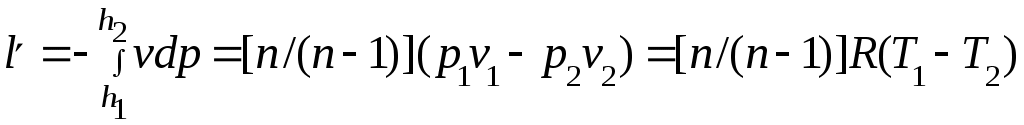 (3.25) (3.25)Меншікті энтальпия өзгерісі Кез келген политропты процессте 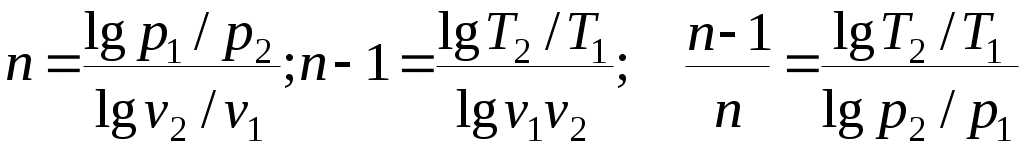 (3.27) (3.27)Полтропты процессті логарифмдік координатта Бұл теңдеу Политропты процессте газдың меншікті энтропия өзгерісі мына формуламен анықталады: немесе күйдің соңғы өзгерісі: 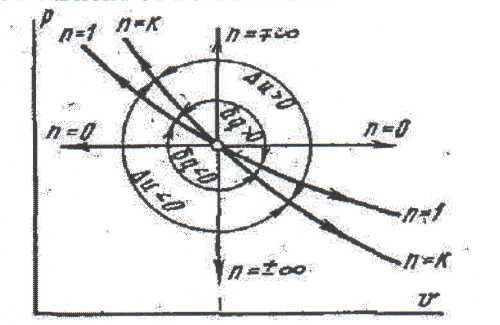 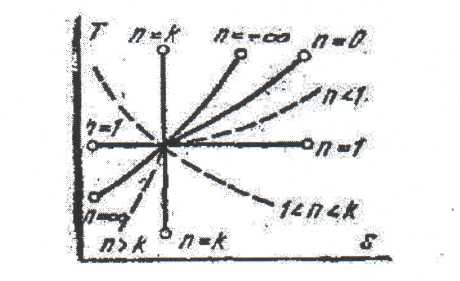 Сурет 3.5 - P-V және T-S политроп диаграммасы 3.5 суретте Политропты процессте газдық меншікті ішкі энергиясы қалай өзгеретінін қарастырайық. Изотермиялық процессте n=1 тең болған жағдайда газдың меншікті ішкі энергиясы өзгермейді (u2=u1) Изобаралық процессте n=0 тең болғанда меншікті ішкі энергияұлғаяды. Жылу берумен жүретін изохоралық процессте Политропты процессте жылу мөлшері қалай өзгеретінін қарастырайық (3.9). Адибаталық процесстее жыу берілмейді және алынбайды. Изотермиялық процессте (n=1),изобаралық процессте (n=0) кеңейеді және изохоралық процессте 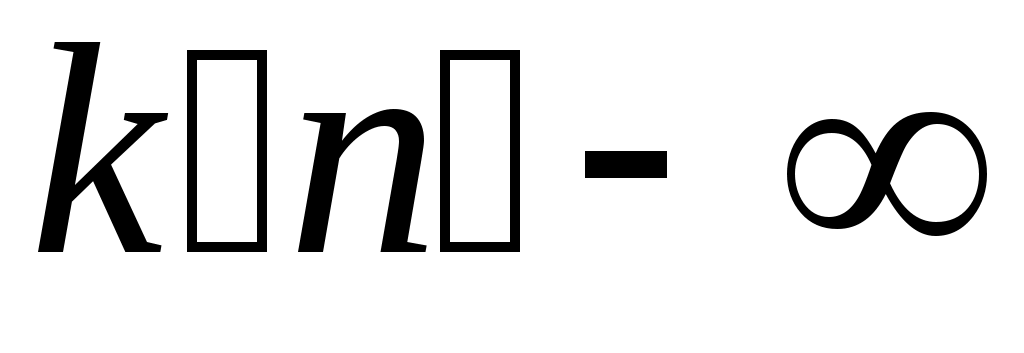 шегінде, алсығылу процесстері шегінде, алсығылу процесстеріАдиабатаның және изотерманың арасында орналасқан процесстердің жылу сыйымдылығы теріс мәнді, өйткені 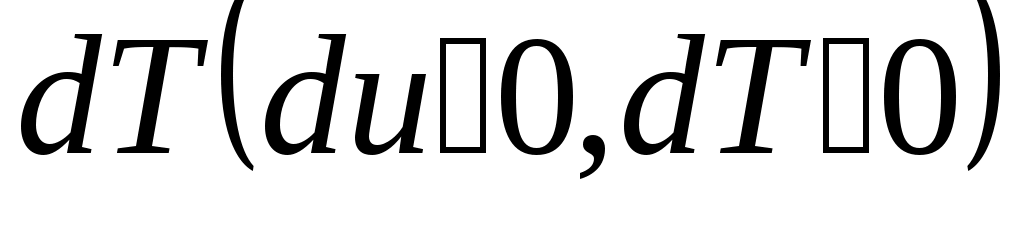 және және Бұл процесстерде жылу беру кезінде температура төмендейді, ал жылу алынған кезде ұлғаятынын тәжірибеден қөруге болады.. |
