Лекция - Транспорт веществ через биологические мембраны.. Транспорт веществ через мембраны
 Скачать 1.27 Mb. Скачать 1.27 Mb.
|
|
Лекция 2. ТРАНСПОРТ ВЕЩЕСТВ ЧЕРЕЗ МЕМБРАНЫ Введение Биологические структуры относятся к открытым термодинамическим системам, постоянно обменивающимся в течение жизни с окружающей средой не только энергией, но и веществом. Роль биологических мембран – сопряжение и регуляция потоков энергии, вызывающих и сопровождающих процесс транспорта. Поэтому транспорт веществ через биологические мембраны – необходимое условие для существования жизни. Нарушение мембранного транспорта ведет к возникновению различного типа клеточных дисфункций и патологий. Классификация видов транспорта Различают несколько классификаций видов транспорта: 1. Относительно затрат энергии в процессе переноса веществ транспорт подразделяется на активный и пассивный. Активный транспорт осуществляется с затратой энергии (за счёт гидролиза АТФ) и против градиента концентрации (иногда данный вид транспорта называют первично-активным). Если же перенос веществ обеспечивает энергия, обусловленная градиентом других ионов, такой транспорт называют сопряженным (иногда используется термин вторично-активный транспорт). Пассивный транспорт осуществляется без затраты энергии, протекает самопроизвольно и по градиенту концентрации. Градиент в процессе пассивного транспорта снижается). 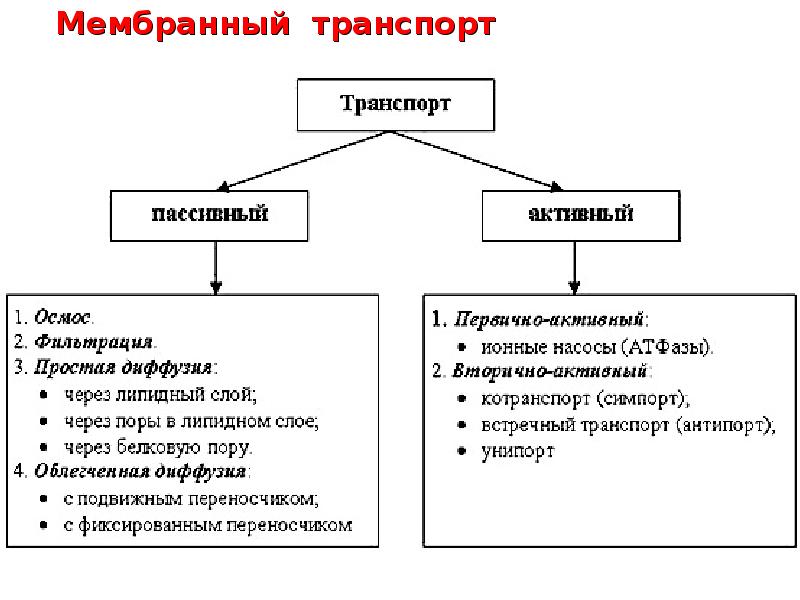 2. Относительно сопряженности переноса веществ через мембрану выделяют: Унипорт – перенос данного вещества (иона) не зависит от наличия и переноса других веществ и котранспорт – перенос данного вещества (иона) зависит от наличия и переноса других веществ. В этом случае скорость суммарного процесса контролируется наличием и доступностью для систем переноса обоих партнеров транспортного процесса (рис.). Котранспорт относительно направления подразделяют на симпорт и антипорт. При симпорте осуществляется однонаправленный и одновременный транспорт, а при антипорте – одновременный, но разнонаправленный перенос веществ.  3. Специфические механизмы переноса веществ, связанные с нарушением структурной целостности мембраны: эндоцитоз и экзоцитоз – важнейшие процессы жизнедеятельности клетки, механизмы высвобождения медиатора в синаптическую щель, фагоцитоз лейкоцитов и др.   Методы изучения транспорта 1. Осмотический – изменение объёма клетки при транспорте воды. 2. Химический (цитохимический) – проникновение красителей, постановка цветных реакций. 3. Биохимический – функция ферментов – участников транспорта. 4. Изотопных меток: углерода (С14), натрия (Na22), рубидия (Rb86) и др. 5. Спектро- и флуорометрический – изменение параметров поглощения и флуоресценции специфических веществ-меток, меняющих свои характеристики после взаимодействия с внутриклеточными структурами. 6. Опосредованные методы – измерение рН, вольтамперных характеристик. Пассивный транспорт и его виды Пассивный транспорт – это перенос веществ из мест с большим значением электрохимического потенциала к местам с его меньшим значением. Пассивный транспорт идет с уменьшением энергии Гиббса, и поэтому этот процесс может идти самопроизвольно без затраты энергии. Подчиняется закону Фика: dm/ dc=-D*S*/ dx Скорость переноса вещества зависит от градиента концентрации (dc/dx), площади (S) и коэффициента (D) диффузии. Диффузия – самопроизвольное перемещение вещества из мест с большей концентрацией в места с меньшей концентрацией вещества вследствие хаотического теплового движения молекул. Подразделяется на: 1. Простую диффузию. 2. Облегченную диффузию. Простая диффузия отличается отсутствием специальных систем для переноса веществ. Подчиняется правилам Овертона: скорость проникновения через мембрану прямо пропорциональна липотропности вещества и обратно пропорциональна его размерам. Позднее Колландер из уравнения Фика вывел более удобно выражение для расчета потока (J) поступления веществ в клетку: J=P(c1- c2) где с1 и с2 – разность концентраций, Р – коэффициент проницаемости мембрвны для данного вещества. Облегченную диффузию отличает наличие специфических структур, осуществляющих перенос вещества через мембрану. Наличие переносчиков изменяет кинетику транспорта, и она становится сходной с уравнениями ферментативного катализа, только в роли фермента выступает переносчик, а в роли субстрата – переносимое вещество (S): Js= Jmax[S]/ KT+ S где КT – константа транспорта соответствует константе Михаэлиса и равна концентрации S при Js=Jmax/2. Например, валиномицин – переносчик ионов калия. Молекула валиномицина имеет форму манжетки, устланной внутри полярными группами, а снаружи – неполярными. Молекулы валиномицина, оказавшиеся у поверхности мембраны, могут захватывать из окружающего раствора ионы калия. Диффундируя в мембране, молекулы переносят калий через мембрану, и некоторые из них отдают ионы в раствор по другую сторону мембраны. Таким образом и происходит перенос иона калия через мембрану валиномицинном. 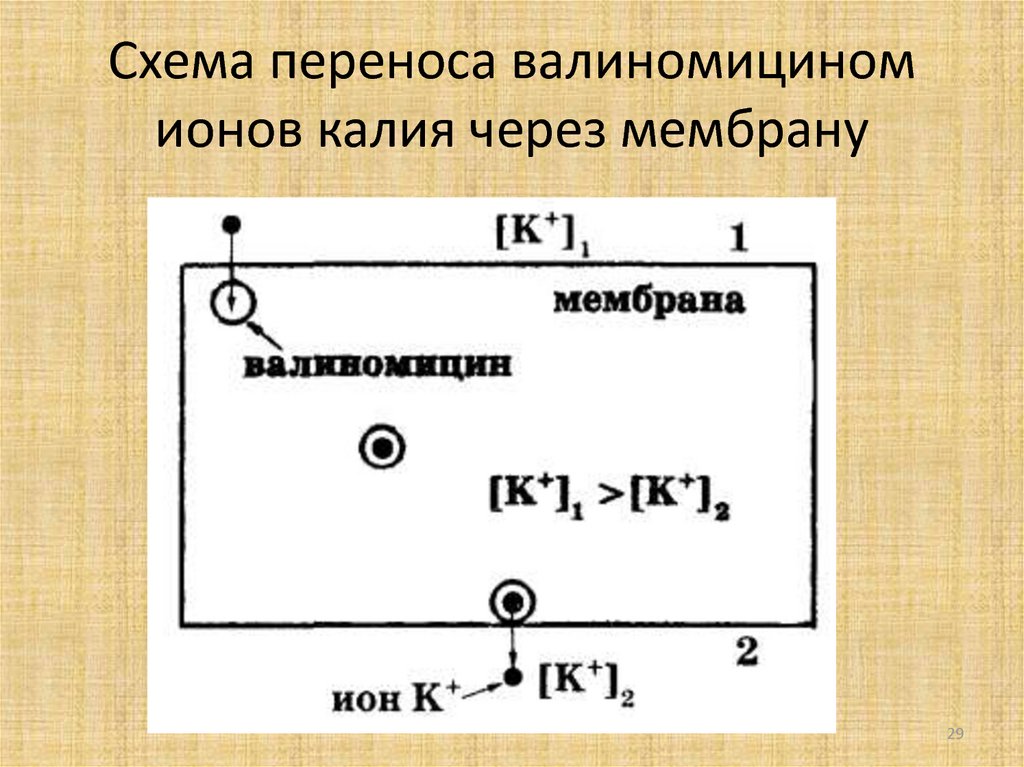 Облегченная диффузия, таим образом, происходит от мест с большей концентрацией пернссимого вещества к местам с меньшей концентрацией. Представители систем облегченной диффузии ионов (симпорт, антипорт) с участием специфических переносчиков: антипорт – котранспорт Na+/Cl--обмен Na+/Na+-обмен Na+/H+ – обмен Na+/Ca2+-обмен Cl-/HCO3--обмен Cl-/ Cl--обмен симпорт – котранспорт K+/Cl— и Na+,K+,2Cl- Унипорт Ионофоры – небольшие гидрофобные молекулы, которые растворяются в липидном слое мембран и увеличивают проницаемость мембран для ионов. Большинство ионофоров синтезируется бактериями (в качестве оружия против своих конкурентов), некоторые являются антибиотиками. Широко используются в клеточной биологии. Ионофоры делятся на: 1. Подвижные переносчики. Имеют кольцеобразную структуру, и контактируют с липидным слоем: наружная часть – гидрофобная; внутренняя часть – гидрофильная содержит карбоксильные атомы кислорода. 2. Каналообразующие. Состоят из линейных полипептидов, которые имеют гидрофобные боковые цепи. Две таких молекулы образуют канал.  Ионные каналы (унипорт) классифицируют: А) по типу ионов: натриевые, калиевые, кальциевые и хлорные каналы; Б) по способу регуляции: 1) потенциал-чувствительные 2) хемочувствительные (рецептор-управляемые) 3) внутриклеточными веществами (ионами, ФАВ). Натриевые и калиевые каналы Размеры ионных каналов меньше одного нанометра (0,2-0,4 нм). Эти структуры обеспечивают важнейшие электрофизиологические свойства клеток и тканей, обеспечивая прохождение в 1 с 106-109 ионов, регулируются мембранным потенциалом и БАВ. Через ионные каналы Na+ и K+ следуют совместно с одной молекулой воды – гидратной оболочкой, хотя в растворе у иона таких оболочек может быть несколько (до 10). Таким образом, при прохождении через ионный канал происходит дегидратация катиона, на что требуется энергия. Роль этой энергии выполняет градиент ионов, так как ионный транспорт относится к пассивному виду переноса веществ через мембрану. В процессе переноса катионов должны выполняться два основных условия (фактора): 1. Стерический – совпадение размеров катиона и гидратной оболочки с размерами канала. 2. Энергетический – взаимодействие катиона с карбоксильными (отрицательно заряженными группировками самого канала). Кальциевые каналы Кальциевые каналы делятся на потенциал-зависимые и рецепторуправляемые. В нормальных условиях внутри клетки [Ca2+]in = 10–7 - 10–6 M. Через кальциевый канал проникают только двухвалентные катионы в соответствии с рядом: pKBa2+ > pKSr2+ > pKCa2+ > pKCo2+ > pKNi2+ > pKCd2+. Селективный фильтр кальциевого канала содержит карбоксильную группу. Все двухвалентные катионы, которые связываются с этой группой слабее, чем кальций, проникают лучше (Ba+ и Sr+). Катионы, которые связываются с этой группой сильнее, чем кальций, являются блокторами кальциевых каналов (Co2+,Ni2+,Cd2+). Регуляторный центр кальциевого канала располагается у внешнего устья. В бескальциевом растворе (с добавлением хелаторов Са2+ ЭГТА, ЭДТА) происходит модификация кальциевых каналов: они сохраняют потенциалзависимость, но изменяют свою селективность и становятся селективными для натрия. Процесс инактивации кальциевых каналов более сложный, чем натриевых каналов. У натриевых каналов происходит инактивация вследствие деполяризации мембраны, у кальциевых инактивация зависит от силы кальциевого тока. Чем выше ICa, тем быстрее инактивация, которая развивается в результате увеличения внутриклеточной концентрации ионов кальция [Ca2+]in до 10–6 М. Проводимость кальциевых каналов подвержена также метаболической регуляции – она зависит от содержания в цитоплазме циклического АМФ. Кальциевые каналы подразделяют на: медленные: - порог активации – 30 мВ - двухфазная инактивация - блокирование производными 1,4-дигидропиридина быстрые: - порог активации – 70–60 мВ - быстрая инактивация - отсутствие чувствительности к 1,4-дигидропиридинам. Фильтрация – движение молекул воды и растворенных в ней веществ через клеточную мембрану в направлении, противоположном действию осмотического давления. Этот процесс становится возможным, если раствор в клетке находится под давлением, которое выше осмотического. Так, например, сердце нагнетает кровь в сосуды под определенным давлением. В тончайших капиллярах это давление возрастает и становится достаточным, чтобы заставить воду и растворенные в крови вещества выйти из капилляров в межклеточное пространство. Образуется так называемая тканевая жидкость, она играет большую роль в доставке питательных веществ в клетки и удалении из них конечных продуктов обмена веществ. После выполнения своих функций тканевая жидкость в виде лимфы возвращается в кровяное русло по лимфатическим сосудам. Фильтрация играет важную роль и в функционировании почек. В капиллярах почек кровь находится под большим давлением, что вызывает фильтрацию воды и растворенных в ней веществ из кровеносных сосудов в тончайшие почечные канальцы. Затем часть воды и необходимые организму вещества снова всасываются и поступают в общий кровоток, а оставшаяся часть образует мочу и выводится из организма. Осмос – особый вид диффузии воды через полупроницаемую мембрану в область более высокой концентрации растворенного вещества. В результате такого движения внутри клетки создается значительное давление, которое называют осмотическим. Это давление может даже разрушить клетку. Вот один из примеров проявления осмотической реакции. Если эритроциты поместить в чистую воду, то под действием осмоса вода будет быстрее проникать в них, чем выходить. Такая среда называется гипотонической, и в нашем случае, по мере проникновения воды эритроцит будет набухать и “лопаться”. Другая ситуация – изотоническая среда. Если поместить эритроциты в воду, содержащую 0,87% поваренной соли, то осмотического давления не создается. Это объясняется тем, что при равной концентрации раствора внутри и снаружи клетки вода движется одинаково в обоих направлениях. Наконец, среда считается гипертонической, когда концентрация растворенных в ней веществ выше, чем в клетке. Клетка (эритроцит) в такой среде начинает терять воду, съеживается и гибнет. Все эти особенности осмоса приходится учитывать при введении лекарственных веществ. Как правило, лекарства, предназначенные для инъекций, приготавливаются на изотоническом растворе. Это предотвращает набухание или сморщивание клеток крови при введении лекарства. Капли в нос также готовят на изотоническом растворе, чтобы избежать набухания или обезвоживания клеток слизистой оболочки носа. Вы, наверное, помните, как неприятно, когда в нос при купании попадает вода. Объяснение простое: пресная вода (гипотонический раствор) вызывает набухание клеток слизистой оболочки носовой полости, а морская вода (гипертонический раствор) – сморщивание. Осмосом объясняются и некоторые эффекты лекарств, например, слабительное действие английской соли (магния сульфат) и других солевых слабительных. Дело в том, что в просвете кишечника они образуют гипертоническую среду. Вода под влиянием осмоса выходит из клеток кишечного эпителия, межклеточного пространства и крови в просвет кишечника, растягивает стенки кишечника, разжижает его содержимое и ускоряет опорожнение. Активный транспорт Перенос иона в процессе активного транспорта осуществляется транспортными АТФ-фазами, энергозависимой лимитирующей стадией которого является гидролиз АТФ. Так происходит первично-активный транспорта.  Если же перенос веществ обеспечивает энергия, обусловленная градиентом ионов, созданным в ходе первично-активного транспорта, то это вторично-активный транспорт. С его помощью осуществляется перенос сахаров и аминокислот за счет энергии, обусловленной градиентом ионов, чаще натрия, созданного первично-активным транспортом. 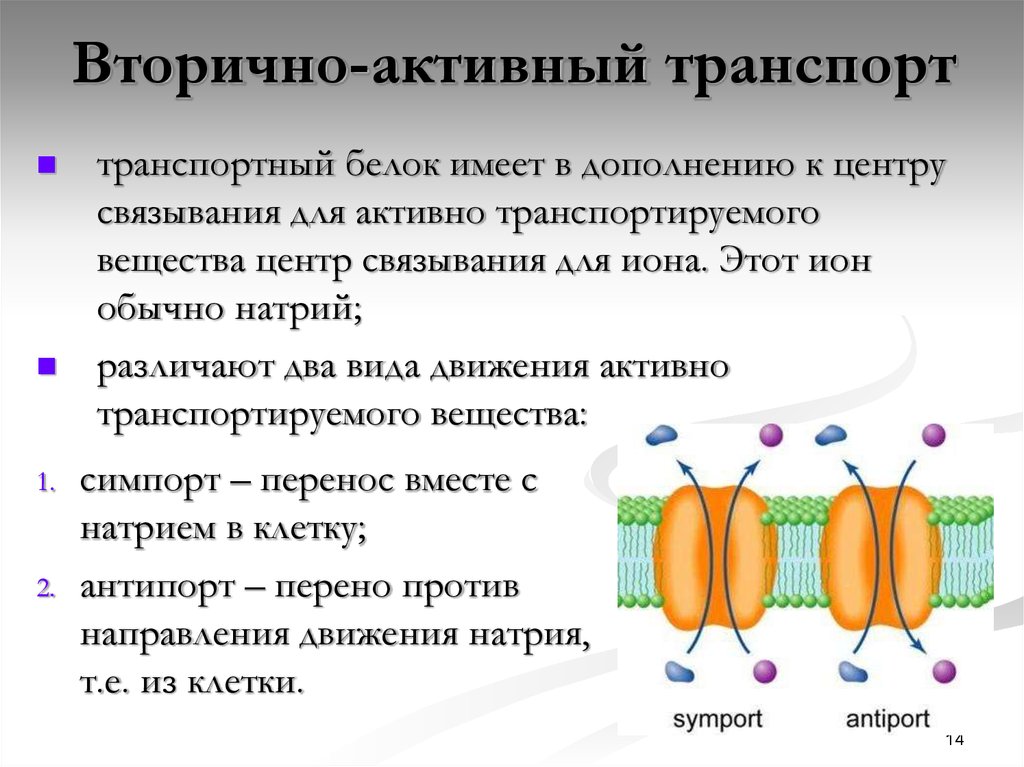 Функциональное значение активного транспорта определяется тем, что он осуществляет неравномерное распределение ионов между клеткой и средой – для большинства тканей концентрация внутриклеточного калия больше, чем внеклеточного, а концентрация внутриклеточного натрия меньше, чем внеклеточного. Поддержание постоянного ионного состава клетки обеспечивает ионный гомеостаз, необходимый для осуществления жизненно важных градиентзатратных процессов. Транспортные АТФ-азы прокариотических и эукаритических клеток делятся на 3 типа: P-тип, V-тип, F-тип. АТФ-азы P-типа являются примером осуществления обязательной стадии фосфорилирования и дефосфорилирования, сопряженной со структурными переходами белков, то есть образования ковалентного фосфорилированного промежуточного продукта (фосфомедиата). К АТФ-зам цитоплазматической мембраны этого типа относятся: Na,+K+– АТФ-аза Ca2+–АТФ-аза H+– АТФ-аза плазматическая мембрана эукариот. Внутриклеточные АТФ-азы P–типа: Ca2+ – АТФ-аза эндо-(сарко) плазматического ретикулума эукариот. К+ – АТФ-аза наружных мембран прокариот. Устроены довольно просто, действуют как насос. АТФ-азы V-типа находятся в мембранах в вакуолях дрожжей, в лизосомах, эндосомах, секреторных гранулах животных клеток (Н+–АТФ-азы). АТФ-азы F-типа находятся в мембранах бактерий, в хлоропластах, митохондриях. Образованы: 1. Водорастворимой частью – F1, которая состоит из нескольких субъединиц и обладает каталитической активностью. 2. Гидрофобная часть F0, участвующей в транслокации водорода. Особенностью АТФ-азы F-типа является способность синтезировать АТФ за счет переноса протонов по градиенту концентрации. Липидные поры: стабильность и проницаемость мембран. Бимолекулярный слой фосфолипидов составляет основу любой клеточной мембраны. Непрерывность его определяет барьерные и механические свойства клетки. В процессе жизнедеятельности непрерывность бислоя может нарушаться с образованием структурных дефектов типа сквозных гидрофильных пор. Вполне естественно ожидать при этом изменения всех функций клеточной мембраны, включая проницаемость и стабильность. Ранее эти проблемы обсуждались раздельно, однако создание модели липидной поры позволяет рассмотреть их с единых позиций. Важен тот факт, что липидные поры помимо проницаемости оказались причастными к стрессовым воздействиям внешних сил на уровне клеточных мембран. Фосфолипиды, составляющие основу клеточных мембран, относятся к жидким кристаллам. Как в любом реальном кристалле, в пленке из фосфолипидов могут быть дефекты, в месте которых и развиваются основные события структурных перестроек. Виды дефектов многообразны, но наиболее естественным для бислоя является дефект типа сквозной гидрофильной поры. Эти поры и будут предметом дальнейшего рассмотрения. 1. Липидные поры и стабильность мембран Очевидное внешнее сходство любой шаровидной клетки с мыльным пузырем оказывается на самом деле более глубоким. В том и другом случае речь идет о важной роли пограничной бимолекулярной липидной пленки, свойства которой определяют стабильность и проницаемость частиц. Различие заключается лишь в том, что мыльная пленка образуется на границе раздела с воздухом, а липидный бислой - в воде. Неудивительно поэтому, что чисто липидные везикулы - липосомы - широко используются с целью моделирования мембранных свойств живой клетки. В настоящее время выяснено, что механическая прочность живой клетки наряду с липидным бислоем обеспечивается системой белковых микротрубочек и сетью мембранных белков. Однако это не умаляет роли самих липидных пор и связанного с ними механизма дестабилизации мембран, особенно в тех случаях, когда система микротрубочек отсутствует или не развита. Известна нестабильность мыльного пузыря, причиной которой может стать любая пылинка. Началом дестабилизации являются прокол стенки пузыря и образование поры. В липидной бимолекулярной пленке клеточной мембраны поры появляются, если исключить чисто механические повреждения в результате тепловых флуктуаций поверхности бислоя, электрического пробоя, замораживания пленки, действия поверхностно-активных веществ, осмотического давления, перекисного окисления липидов и др. Один из наиболее типичных и хорошо изученных примеров дестабилизации биологических мембран - гемолиз эритроцитов. Это явление включает на начальном этапе набухание клеток в гипотонической среде в результате действия сил осмотического давления. Во время набухания клетки мембрана растягивается, что обусловливает рост мембранного натяжения. При определенном пороговом уровне натяжения появляются гидрофильные липидные поры. Размеры пор достаточны для выхода молекул гемоглобина и низкомолекулярных веществ. Выход веществ сопровождается, в свою очередь, снижением разности осмотического давления, при этом натяжение мембраны уменьшается и поры залечиваются. Белки цитоскелета позволяют эритроциту сохранить форму, при этом образуется так называемая тень эритроцита. Тень сохраняет осмотическую активность и таким образом процесс дестабилизации приобретает циклический характер. Полного механического разрушения клетки, подобного мыльному пузырю, в этом случае не происходит. При отсутствии цитоскелета или его недостаточного развития механическая прочность клетки целиком определяется судьбой липидных пор. Если пора имеет размер меньше критического, то она залечивается. В противном случае неограниченный рост поры приводит к разрушению мембраны. 2. Модель критической поры Рассмотрим модель липидной поры. Будем считать, что боковая поверхность поры имеет форму кругового цилиндра. Более того, предположим, что боковая поверхность цилиндра изогнута и имеет радиус кривизны h /2. Радиус поры равен r. Как видно, липидный бислой в целом является плоским, а пора имеет два радиуса кривизны h /2 и r. Из физики известно, что искривление поверхности на границе раздела липид-вода сопровождается появлением добавочного давления, называемого лапласовым и равного ∆Р=2σ1/r где σ1 - межфазное натяжение внутри поры, r - радиус кривизны. В рассматриваемой модели таких радиусов два (h /2 и r) и, следовательно, два давления. Одно из них P (h /2) способствует расширению, а другое P (r) - сжатию поры. Дальнейшая судьба поры зависит от соотношения этих двух давлений. Если P (h /2) > > P (r), пора будет расширяться, а если P (h /2) < P (r), то пора будет затекать. Рассмотрим энергетику поры. Как установлено выше, на границы поры действуют две противоположные силы, одна из которых - краевое линейное натяжение периметра поры - способствует росту поры, а вторая сила - поверхностное натяжение бислоя - вызывает сжатие поры. Краевая энергия поры пропорциональна первой степени радиуса и увеличивает суммарную энергию, энергия поверхностного натяжения пропорциональна квадрату радиуса и снижает суммарную энергию. В результате суммарная энергия E (r) равна: E (r) = 2prg - pr2s, (1) где первый член определяется энергией кромки поры с линейным натяжением g, а второй - энергией поверхностного натяжения s. В точке равновесия и уравнение превращается в тождество: 0 = 2pg - 2psr *, откуда можно определить критический радиус поры r *: r*=g/s Высота энергетического барьера после подстановки r * в уравнение (1) будет равна E*=πg/s С учетом неустойчивости равновесия можно утверждать, что появление пор с r > r * будет сопровождаться разрывом мембраны в результате неограниченного роста поры. Напротив, при r < r * пора будет затекать и стабильность мембраны сохранится. Таков количественный критерий стабильности липидной бислойной мембраны. 3. Электрический пробой мембран Биологические мембраны находятся под действием электрического поля большой напряженности, создаваемого диффузией ионов через мембрану и электрогенными ионными насосами. Поскольку разность потенциалов между цитоплазмой и внеклеточной средой достигает порядка 0,1 В, а толщина мембраны не превышает 10 нм, то напряженность поля равна 107 В/м. Интересно, что мембрана является более совершенным электрическим изолятором, чем многие жидкие изоляторы, применяемые в технике. В некоторых случаях мембранный потенциал в живой клетке может быть выше и достигать 0,2 В (пресноводные водоросли, бактерии, энергизованные митохондрии). В возбудимых нервных и мышечных клетках происходит кратковременная реполяризация мембраны с ростом амплитуды потенциала. Однако пробой клеточной мембраны собственным мембранным потенциалом маловероятен. В то же время рост мембранного потенциала в результате воздействия внешним электрическим полем может достигать величины, превышающей пороговую для электрического пробоя. При этом появляются структурные дефекты типа сквозных липидных пор. Разработанная методика электрического пробоя клеточных мембран получила название электропорации и широко применяется в биотехнологии. Стабильность бислойных мембран определяется вероятностью появления пор критического радиуса. Очевидно, что любой фактор, снижающий высоту энергетического барьера, будет увеличивать эту вероятность. К таким факторам следует отнести снижение краевой энергии поры g, рост поверхностного натяжения и рост мембранного потенциала. Как видно, рост пробойного напряжения до 1 В сопровождается смещением критического радиуса к значениям, меньшим 0,5 нм, что близко радиусам природных ионных каналов клеточной мембраны. Отсюда следует, что электрический пробой сопровождается появлением широкого спектра липидных пор различного радиуса, включая радиусы ионселективных белковых каналов. В настоящее время метод воздействия внешним электрическим полем является одним из основных в современной биотехнологии. Известно его применение с целью увеличения пористости мембран (электропорация), введения ДНК (электротрансфекция), освобождения клеток от крупных молекул (электропермеабилизация), слияния клеток (электрослияние).  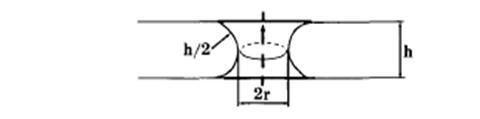 Строение гидрофильной липидной поры  |
