Навигация по странице:Учебник Химия,Оспанова. - Алматы: Атамұра, 2018 Тема урокаПорядок действий Ход занятия Изучите Фосфор и его соединения ФосфорБелый фосфорСвойства соединений фосфора Элементы 14 (IV) группы, кремний и его соединения, области применения, значение1s 2 2s 2 2p 6 3s 2 3p 2 Химический состав организма человека. Макроэлементы, микроэлементы и их значенияОвощи – 25%Молоко, мясо, рыба, яйца, йогурт, сыр, орехи – 15%Выполни СОР : Задания по суммативному оцениванию за раздел 9.3В «Химические элементы в организме человека» 1.4.Соотнесите функции тяжелого металла к его химическому элементу
|
23.02 химия ДО. Учебник Химия,Оспанова. Алматы Атамра, 2018 Тема урока
План изучения темы
Предмет
|
химия
|
Учебник
|
Химия,Оспанова. - Алматы: Атамұра, 2018
|
Тема урока
|
Фосфор и его соединения. Кремний и его соединения. Химический состав организма человека. Макроэлементы, микроэлементы и их значения. Загрязнение окружающей среды тяжелыми металлами. СОР
|
Цели обучения
|
|
Порядок действий
|
Ход занятия
|
Изучите
|
Прочитайте параграф учебника: 40-48
Просмотрите видео материал: https://www.youtube.com/watch?v=SL-f7haEK0o
https://www.youtube.com/watch?v=8siy69QeEfk
https://www.youtube.com/watch?v=npdIUNmde-U
https://www.youtube.com/watch?v=451OLs39QEQ
|
Изучи данную информацию
|
Фосфор и его соединения
Фосфор – неметалл. Открыт в 1669 г. Хеннигом Брандом (Германия), получившим светящееся в темноте вещество. Изначально назван «холодный огонь», позже – «фосфор» (от греческого «phosphоros» – светоносный). Элементарный фосфор существует в нескольких аллотропных формах. Наиболее распространенными и важными являются белый, черный и красный фосфор.
Белый фосфор внешне похож на очищенный воск или парафин, легко режется ножом, деформируется от небольших усилий, ядовит.
Желтый фосфор – это плохо очищенная форма белого фосфора. Является еще более ядовитым, неприятно пахнет чесноком. Возгорается и горит ярким светящимся зеленым пламенем, не растворяется в воде.
Черный фосфор получен из белого фосфора. Черный фосфор – это черное вещество с металлическим блеском, жирное на ощупь, напоминает графит, не растворяется в воде и органических растворителях, проводит электрический ток и имеет свойства полупроводника.
Красный фосфор получен из белого фосфора. Имеет красно-бурый цвет, не летуч, не растворяется в воде, не ядовит. Используется в производстве спичек.
Из-за высокой реакционной способности фосфор образует множество различных соединений: бинарные соединения: оксиды, фосфиды, летучие водородные соединения, сульфиды, нитриды.
Например: P2O5, PCl3, P2S3, PH3;
сложные вещества: соли всех типов (средние, кислые, основные, двойные, комплексные), кислоты.
Например: H3PO4, Na3PO4, H4P2O6, Ca(H2PO4)2, (NH4)2HPO4;
кислородсодержащие органические соединения: белки, фосфолипиды, АТФ, ДНК, РНК.
Качественная реакция на фосфат-ион: ион серебра и фосфат-ион образуют фосфат серебра, осадок желтого цвета. Ag+ + Cl – ⟶ AgCl(тв).
Свойства соединений фосфора
Оксид фосфора (V)
Обычно формула оксида фосфора (V) записывается в виде P2O5, на самом деле его состав сложнее – P4O10. Оксид фосфора (V) образуется в результате горения фосфора в избытке воздуха: 4P + 5O2 = 2P2O5
Оксид фосфора (V) – белое рыхлое гигроскопичное вещество. Поэтому его следует хранить в герметичной таре.
Оксид фосфора (V) химически подобен другим кислотным оксидам. Образует различные фосфорные кислоты в реакции с водой в зависимости от температуры.
P2O5 + H2O =
|
2HPO3 без нагревания
метафосфорная кислота
|
P2O5 + 3H2O =
|
2H3PO4 при нагревании
ортофосфорная кислота
|
Фосфор и его соединения имеют важное биологическое значение, применяются в медицине и для получения разной продукции в промышленности.
Например: в производстве спичек, взрывчатых соединений, зажигательных бомб, смазочных материалов;
-в качестве поглотителя газов, а также при изготовлении ламп накаливания;
-для защиты металлов от коррозии;
-в качестве удобрений почвы в сельском хозяйстве;
-в химических синтезах при производстве разных веществ.
Кроме того, фосфор – это еще жизненно важный элемент, который в живых организмах участвует в процессах образования зубной эмали и костей, в реакциях анаболизма и катаболизма, а также является основой в синтезе ДНК и РНК.
Элементы 14 (IV) группы, кремний и его соединения, области применения, значение
В 14 группу (IVA) Периодической таблицы входят химические элементы: углерод, кремний, германий, олово и свинец. На внешнем уровне атомов элементов содержатся 4 электрона, электронная формула – ns2np2.
Кремний находится в третьем периоде, заряд ядра +14. Электронно-графическая формула атома кремния: 1s 2 2s 2 2p 6 3s 2 3p 2
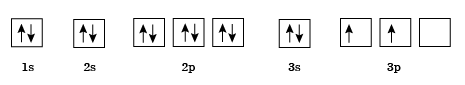
Степени окисления кремния в соединениях –4, +2, +4.
Получение
В промышленности: SiO2 + 2C = Si + 2CO
В лаборатории: SiO2 + 2Mg = Si + 2MgO
Существует два аллотропных видоизменения кремния: кристаллический – темно-серого цвета, с металлическим блеском, твердый, тугоплавкий, полупроводник и аморфный кремний – порошок серого цвета.
Кремний является химически инертным элементом, становится активным при нагревании.
Кремний как восстановитель реагирует с неметаллами:
Si + 2Cl2 = SiCl4
Si + O2 = SiO2
Si 0 + C 0 = Si +4C –4
Si 0 – 4e – = Si +4 – восстановитель
C 0 + 4e – = C –4 – окислитель
Кремний как окислитель реагирует с металлами:
Si + 2Mg = Mg2Si
Si 0 + 4e – = Si –4 – окислитель
Mg 0 – 2e – = Mg +2 – восстановитель
Кремний растворяется в концентрированных растворах щелочей:
Si + 2NaOH + H2O = Na2SiO3 + 2H2
Кремний – полупроводник, поэтому он широко используется в радиотехнике, электротехнике, фотоэлементах.
Сплавы железа с высоким содержанием кремния являются кислотостойкими; сплав железа, содержащий 4% кремния, используется для изготовления электрических трансформаторов.
Оксид кремния (SiO2) или кремнезем – это природный полимер, составная часть многих горных пород, твердое, тугоплавкое вещество.
В кристаллической решетке атом кремния соединен ковалентными связями с четырьмя атомами кислорода, каждый из которых, в свою очередь, соединен с двумя атомами кремния, образуя гигантскую ковалентную структуру.
Кварц – кристаллический кремнезем. Разновидностью кварца является песок.
иоксид кремния – кислотный оксид, не растворим в воде, взаимодействует со щелочами с образованием силикатов:
SiO2 + Na2O = Na2SiO3
SiO2 + 2KOH = K2SiO3 + H2O
При нагревании диоксида кремния с карбонатами, выделяется диоксид углерода:
SiO2 + CaCO3 = CaSiO3 + CO2
Диоксид кремния реагирует только с плавиковой кислотой:
SiO2 + 4HF → SiF4 + 2H2O
Песок применяется для производства стекла, керамики, бетона, кирпича.
Кремниевая кислота H2SiO3 – двухосновная слабая кислота. Ее нельзя получить взаимодействием диоксида кремния с водой. Она образуется при действии сильных кислот на растворимые соли кремниевой кислоты в виде студенистого осадка:
Na2SiO3 + 2HCl = 2NaCl + H2SiO3
Водородное соединение кремния – силан (SiH4) токсичный газ с неприятным запахом. Кремний с водородом непосредственно не реагирует:
Mg2Si + 4HCl = 2MgCl2 + SiH4
Карбид кремния – карборунд (SiC) – алмазоподобной структуры, очень твердый, используют в лазерах, из него изготавливают точильные камни, шлифовальные круги.
Химический состав организма человека. Макроэлементы, микроэлементы и их значения
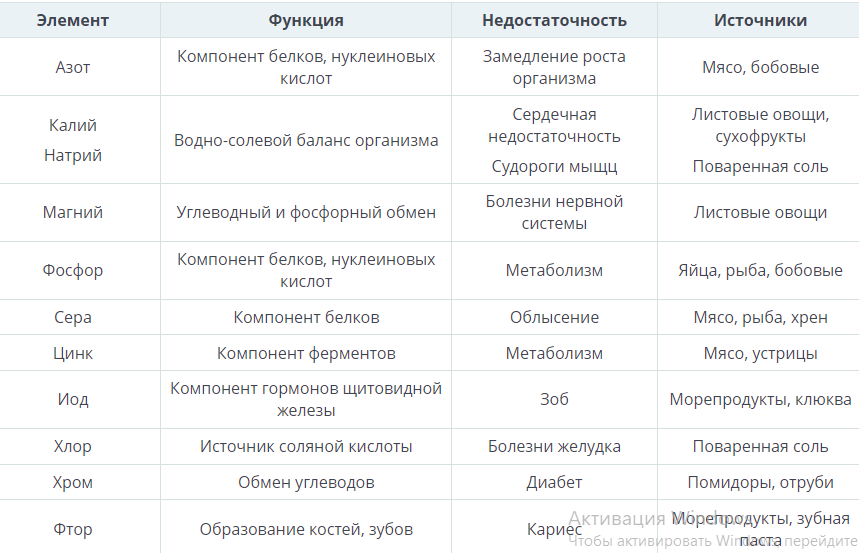
Макро и микроэлементы образуют органические и минеральные вещества организма. На долю макроэлементов приходится 99,99% массы тела. Углерод, водород, кислород и азот составляют 96%. Это органогенные элементы, из которых преимущественно построены органические вещества: белки, углеводы, жиры, нуклеиновые кислоты, и которые поддерживают гомеостаз – постоянный ионный и кислотно-щелочной состав. 3,99% веса тела составляют остальные макроэлементы: натрий, калий, магний, кальций, железо, фосфор, сера, хлор. Микроэлементы содержатся в низких концентрациях: йод, цинк, хром, фтор, однако они влияют на обмен веществ, рост, размножение, кроветворение. Минеральные вещества также необходимы для построения структур живых тканей, для биохимических и физиологических процессов. Дефицит того или иного элемента вызывает определенные заболевания.
При сбалансированном питании обеспечивается правильное соотношение питательных веществ: белков, жиров, углеводов, минералов и витаминов. В среднем, подросток должен в сутки употреблять пищу, содержащую 1200-2000 калорий. При несоблюдении правильного рациона питания человек быстро утомляется и легко подвергается различным заболеваниям.
Исходя из соотношения белков, жиров и углеводов при сбалансированном питании (1 :1 :4) строится пирамида питания.

Всего в пирамиде 5 групп продуктов.
В соответствии с количеством, необходимым для сбалансированного питания, эти группы распределены на уровнях пирамиды. В основании – продукты, необходимые в самых больших количествах, на вершине – самая малочисленная группа.
Зерновые – 30%: хлеб, рис, макароны, хлопья, овсянка, гречка, пшено, перловка, мюсли. Это основные источники сложных углеводов, витаминов группы B и клетчатки, обеспечивают организм энергией и железом.
Овощи – 25%: твой ежедневный рацион должен включать 3-5 овощей, они поставляют организму витамины, минеральные вещества и клетчатку.
Фрукты – 20%: 2-4 фрукта в день обеспечивают углеводами, витаминами и пектиновыми веществами, помогающими пищеварению.
Молоко, мясо, рыба, яйца, йогурт, сыр, орехи – 15%: являются важным компонентом рациона, так как обеспечивают нас белком, кальцием, многими витаминами, помогают увеличить плотность костей, предохраняя от переломов и остеопороза.
Жиры, сладости – 10%: обеспечивают нас витаминами и энергией.
Источники загрязнения окружающей среды тяжелыми металлами, воздействие их на организм
Тяжелым металлам относятся химические элементы, которые характеризуются биологической активностью и токсичностью и широко используются в различных сферах хозяйственной деятельности.
Они поступают в окружающую среду с промышленными сточными водами, с дымом и пылью промышленных предприятий, а также с бытовыми стоками. В организм человека попадают с водой, воздухом, выхлопными газами, табачным дымом, средствами бытовой химии. Ионы тяжелых металлов образуют прочные органические соединения, хорошая растворимость этих комплексов способствует их миграции в природных водах.
Катионы свинца, ртути, кадмия образуют прочные ковалентные связи с серой, находящейся в составе некоторых аминокислот. Вследствие этого ферменты, содержащие эти аминокислоты в своем составе, теряют биологическую активность, что приводит к нарушению обмена веществ.
Тяжелые металлы могут накапливаться в организме и вызывать различные заболевания
Ртуть
Источниками загрязнения ртутью являются стоки промышленных вод, атмосферная пыль, которая образуется при выветривании пород, содержащих ртуть и при сжигании угля на электростанциях, люминесцентные лампы и измерительные приборы.
Многие морские и пресноводные организмы накапливают соединения ртути в концентрациях, превышающих содержание ее в воде. Соединения ртути высокотоксичны для человека. Отравление органическими соединениями ртути вызывает болезнь Минаматы, которая была впервые обнаружена в Японии в 1956 году.
Ртуть поражает центральную нервную систему. У больных наблюдаются онемение и слабость в ногах и руках, звон в ушах, потеря зрения и слуха.
Свинец
Источниками загрязнения свинцом являются его добыча и выплавка, переработка вторсырья, свинцово-кислотные аккумуляторы, свинцовые краски, витражи, хрустальная посуда, боеприпасы, ювелирные изделия и пестициды, простые батарейки. В организм человека свинец попадает как с пищей и водой, так и из воздуха. Свинец оказывает негативное воздействие на зрение человека, ухудшает память, провоцирует развитие заболеваний нервной системы. Заменяет кальций в костях, является постоянным источником отравления. Снижает содержание гемоглобина в крови на 50%, вызывая свинцовую анемию.
Кадмий
Попадает в природные воды в результате смыва почв, выветривания полиметаллических и медных руд и со сточными водами рудообогатительных, металлургических и химических производств, табачным дымом. Кадмий в норме присутствует в организме человека в микроскопических количествах. При накоплении организмом соединений кадмия поражается нервная система, нарушается фосфорно-кальциевый обмен. Хроническое отравление приводит к анемии и разрушению костей, к болезни итай-итай, которая вызывает деформации скелета, утиную походку, сильное поражение почек.
|
Выполни СОР : Задания по суммативному оцениванию за раздел 9.3В «Химические элементы в организме человека»
1. становите соответствие между аллотропными модификациями фосфора и их физическими свойствами.
Аллотропнные модификации
|
Физические свойства
|
А.белый фосфор
|
1.Кристаллическое вещество
|
Б.красный фосфор
|
2.Порошкообразное вещество
|
3.Твердый
|
4.Не имеет запаха
|
5. Чесночный запах
|
6 В темноте светится
|
|
7 .Не светится
|
|
8. Небольшая твердость
|
2. а.) По количественному содержанию в организме, элементы классифицируются на макро- и микроэлементы. Элементы: водород,углерод,кобальт,магний,натрий,стронций,азот,йод,кислород, бром.
Макроэлементы:
Микроэлементы:
б.) Во время прохождения медицинского обследования у учащегося 9-го класса выяснилась нехватка в его организме таких элементов как: железо, фосфор, магний и йод. Рекомендуйте рацион питания вашему сверстнику для восполнения данных элементов в организме.
Железо: Фосфор: _ Магний: Йод:_
с.) Определите, к каким возможным заболеваниям может привести нехватка магния и йода в организме.
Магний:
Йод: _
3. Вещества в организме представлены группами соединений.
Укажите в таблице их функции в организме человека и не менее двух источников:
|
Функциив организме
|
Источники(пищевыепродукты)
|
Жиры
|
|
|
Белки
|
|
|
Углеводы
|
|
|
4.Соотнесите функции тяжелого металла к его химическому элементу:
1
|
Pb
|
A) Рак легких, анемия, кожные болезни.
|
2
|
Ве
|
B) Нарушение процессов кроветворения, повреждение печени и почек.
|
3
|
Cd
|
C) Дерматит, язвы, воспаление слизистых оболочек.
|
4
|
Аs
|
D) Злокачественные новообразования, острые респираторные заболевания
|
|
|
|
|
 Скачать 215.93 Kb.
Скачать 215.93 Kb.

