Механизм химического взаимодействия при горении
Теоретические расчеты показывают, что для протекания тримолеку- лярной реакции
2Н2 О2 2Н2О
с заметной скоростью необходимо разогреть реакционную смесь до очень высокой температуры (более 5000 К). Объясняется это, во-первых, боль- шой величиной энергетического барьера и, во-вторых, тем, что тройные соударения происходят достаточно редко. Еще более энергетически труд- ной является тримолекулярная реакция горения метана
СН4 2О2 СО2 2Н2О ,
так как для разрыва только одной связи С–Н в молекуле метана необходи- мо 435 кДж/моль энергии (см. табл. 1.2). Молекулярные реакции более тя- желых углеводородов (С2Н6, С3Н8 и т. д.) вообще маловероятны, но не из-за высокого энергетического барьера, а в силу того, что для их протекания требуется одновременное соударение более трех возбужденных молекул.
В действительности же большинство реакций горения имеют энергию активации 80–160 кДж/моль и поэтому происходят с высокой скоростью при относительно низких температурах (
1000–2000 К). Это означает, что реакция устремляется по какому-то другому, более легкому, пути. На этом пути взаимодействие горючего и окислителя происходит через ряд проме- жуточных стадий с участием не целых молекул, а их составных частей: атомов и радикалов. Этот процесс более длинный, но энергетически более выгодный. Атомы и радикалы образуются при разрыве в молекуле какой- либо химической связи и поэтому имеют неспаренные электроны, благодаря которым являются высокореакционноспособными (активными) частицами. Эти частицы легко вступают в реакции с молекулами, так как энергетиче- ский барьер у таких реакций низкий, т. е. низкая энергия активации.
Вообще в статическом хаосе молекулярных столкновений осуществ- ляются одновременно все варианты столкновений молекул с молекулами,
молекул с активными частицами, но главную роль играют те столкнове- ния, при которых энергия активации меньше. В качестве примера ниже рассмотрен механизм, по которому происходит окисление водорода.
При соударении двух возбужденных молекул, имеющих достаточную энергию для разрыва химических связей, происходит образование двух ак- тивных частиц – гидроксильных радикалов
H2 + O2 2O H . (1.10)
Точкой сверху указывают наличие неспаренного электрона в радикале, благо- даря которому эта частица является активной (высокореакционноспособной). Отметим, что радикалы, как и атомы, в целом нейтральны, т. е. не имеют элек- трического заряда. Количество электронов и протонов у них одинаково.
Количество образующихся радикалов в реагирующей системе обычно ма- ло, поэтому они находятся в основном в окружении молекул. Образовавшийся гидроксильный радикал легко вступает в реакцию с молекулой водорода:
О H H2
.
H 2O + Н
. (1.11)
В результате этой реакции образуются конечный продукт – вода и новая активная частица – атом водорода, который, в свою очередь, легко вступа- ет в реакцию с молекулой кислорода
. ..
Н О2 ОH O.
(1.12)
Атом кислорода имеет два неспаренных электрона, его называют биради-калом(двойным радикалом), он вступает в реакцию с молекулой водорода
О Н2 О H Н
. (1.13)
Образующиеся новые гидроксильные радикалы (ОН) будут опять ре- агировать с молекулой водорода (реакция (1.11)), а атомы водорода – с мо- лекулой кислорода (реакция (1.12)), и это будет многократно повторяться. Возникает цепочка превращений, в результате которых образуется боль- шое количество молекул продукта Н 2О (по реакции (1.12)). Таким образом, затратив один раз большое количество энергии в реак- ции (1.10) для образования активных частиц – начальных центров реакции, можно в дальнейшем получить не одну, а много молекул Н 2О, так как все последующие реакции атомов и радикалов с молекулами протекают легко без больших затрат энергии. Такие реакции называются радикально-цепными. Цепочка превращений прекратится, если встретятся две актив- ные частицы. В результате их соударения образуется молекула: . .
или
Н Н H2
. .
(1.14)
Н ОН H2О . (1.15)
В реакциях (1.14) и (1.15) происходит гибель активных частиц, и цепочка превращений на этом обрывается.
Итак, механизм химических превращений при окислении водорода в целом выглядит так:
0) Н2 О2
2О H
Зарождение цепи
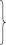 1) О H Н2 Н2О Н Н
О
O2 О H О Н2 О H НРазвитие цепи
Н
Н H 2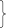 Обрыв цепи
Реакции развития цепей (1), (2) и (3), в которых происходит взаимо- действие активных частиц с молекулами, могут многократно повторяться. Число этих повторений носит название длины цепи. Обычно для радикаль- но-цепных реакций длина цепи составляет от 10 до 103, а иногда может до- стигать значений 104. Это означает, что на один акт химического взаимо- действия по реакции (1.10) в реакциях развития цепей может образоваться до 104 молекул продукта. В этом заключается энергетическая выгода такого пути реакции. Радикально-цепной механизм химической реакции горения облегчает ее протекание. Отметим, что уменьшение энергии активации не влияет на тепловой эффект химической реакции (см. рис. 1.1), который определяется только начальным и конечным положением системы.
Построим схему превращения активных частиц в реакциях развития цепей. Гидроксильный радикал ОН, реагируя с молекулой водорода по ре- акции (1), дает атом водорода и молекулу продукта (Н2О). В результате ре- акции атома водорода с молекулой кислорода (реакция (2)) появляются две активные частицы ОН и О. При реакции атома кислорода с молекулой во- дорода образуются также две активные частицы ОН и Н. Эти химические превращения продолжают повторяться.
При химических взаимодействиях атома водорода с молекулой кислорода и атома кислорода с молекулой водорода (реакции (2) и (3)) число актив- ных частиц увеличивается – такое увеличение числа активных частиц в ходе реакций развития цепи называют разветвлением цепей.
Разветвление цепей обусловлено участием в химических превращениях бирадикала, каким является атом кислорода, поэтому во всех реакциях окисления и горения имеет место это явление.
|
ȮН
|
ȮН
|
Ḣ
|
Ö
|
ȮН Ḣ
Ö
|
ȮН
|
Ḣ
|
|
Ḣ
|
ȮН
|
|
|
Ö
|
 За исследования и объяснения механизма реакции окисления водоро- да ученым Н. Н. Семенову (СССР), С. М. Хиншельвуду (Великобритания) в 1956 г. была присуждена Нобелевская премия. За исследования и объяснения механизма реакции окисления водоро- да ученым Н. Н. Семенову (СССР), С. М. Хиншельвуду (Великобритания) в 1956 г. была присуждена Нобелевская премия.
Радикально-цепными являются все реакции горения. Даже более про- стая реакция горения водорода в хлоре
H2 Cl2 2HCl
также протекает с участием активных частиц. Механизм этой реакции был установлен в начале ХХ века немецкими учеными М. Боденштейном и В. Нернстом.
Образование активных частиц в системе Н2 + Cl2 происходит в основ- ном при распаде молекулы хлора (стадия 0), так как в ней химическая связь менее прочная (см. табл. 1.2). Далее следуют реакции активных частиц с молекулами Н2 и Cl2 (стадии 1, 2), а обрываются цепи при встрече двух активных частиц (стадии 3–5):
Cl2
2C l Зарождение цепи C l Н2 НCl H Развитие цепи Н C l HCl Обрыв цепи
С l C l Cl2
 Цепи в этой реакции не разветвлены (стадии 1 и 2), их длина может достигать значений 10 3–10 4.
 Ċl Ċl Ḣ ĊlḢ Ċl Ḣ …
Подобный механизм реакции горения имеет место и при горении углеводородов (СН4, С2Н6 и др.) в хлоре.
Вследствие разветвления цепей горение веществ в кислороде проис- ходит с большей скоростью, чем в хлоре.
Несмотря на то что радикально-цепные реакции многостадийны, они, как и простые реакции, могут быть описаны уравнением Аррениуса. Например, скорость химической реакции W водорода с кислородом при горении, для которого брутто-уравнение можно записать в виде
H2 0,5O2 H2O ,
будет равна
W dCH2O
kCnCm
expE.
dτ 0 H2 O2
RT
В этом уравнении величины: предэкспоненциальный множитель k0, по- рядки реакции по компонентам nи mи значение энергии активации являют- ся эффективными, т. е. отвечающими всему процессу в целом. Они могут меняться при изменении условий протекания реакции. Обычно их устанав- ливают экспериментально при изучении кинетики химической реакции. В случае необходимости для более точного описания происходящего хи- мического процесса пользуются детальным анализом механизма реакции с рассмотрением отдельных стадий процесса. Знание величины скорости химической реакции позволяет рассчиты- вать скорость тепловыделения при ее протекании как произведение скоро- сти химической реакции на величину ее теплового эффекта. Для химиче- ских реакций горения чаще пользуются не понятием теплового эффекта, а низшей теплотой сгорания, которая по величине равна тепловому эф- фекту химической реакции. Поэтому при горении скорость тепловыделе-
ния q+,
Дж м3 с
, выражают произведением
q+= WQн, (1.16)
где W, моль ; а Q, Дж .
м3 с н моль
|
 Скачать 178.42 Kb.
Скачать 178.42 Kb. За исследования и объяснения механизма реакции окисления водоро- да ученым Н. Н. Семенову (СССР), С. М. Хиншельвуду (Великобритания) в 1956 г. была присуждена Нобелевская премия.
За исследования и объяснения механизма реакции окисления водоро- да ученым Н. Н. Семенову (СССР), С. М. Хиншельвуду (Великобритания) в 1956 г. была присуждена Нобелевская премия. Цепи в этой реакции не разветвлены (стадии 1 и 2), их длина может достигать значений 103–104.
Цепи в этой реакции не разветвлены (стадии 1 и 2), их длина может достигать значений 103–104.