теория горения и взрыва. Учебника для высших образовательных учреждений мчс россии Москва 2015 удк 614. 841. 41 Ббк 38. 96
 Скачать 178.42 Kb. Скачать 178.42 Kb.
|
Основные сведения о кинетике химических реакцийНаука, изучающая протекание химических реакций, их скорости и механизмы, называется химическойкинетикой. Химическая кинетика находится на стыке двух больших областей знаний – физической химии и химической физики. Знания о кинетике химических реакций горения помогают не только понять происходящие в зоне горения процессы, но и осознанно управлять ими. Любая химическая реакция, в том числе и реакция горения, происхо- дит с разрывом химических связей в молекулах исходных реагирующих веществ и с образованием новых химических связей в продуктах реакции. Для разрыва химической связи необходимо затратить определенное коли- чество энергии, а при образовании этой же химической связи такое же количество энергии выделяется. Численные значения энергии некоторых химических связей приведены в табл. 1.2. Таблица 1.2 Энергия разрыва химической связи в молекулах
Для того чтобы произошла химическая реакция между водородом и кислородом с образованием воды 2Н2 + О2 2Н2О , необходимо затратить энергию для разрыва химических связей в двух мо- лекулах водорода и в одной молекуле кислорода. НН НН Н Н     + О = О О + О + О = О О + ОН Н При образовании четырех новых связей ОН в молекулах воды энер- гия выделится. В экзотермических реакциях количество энергии, выде- лившейся при образовании химических связей, больше, чем затраченной на разрыв. Разница между ними составляет величину теплового эффекта химической реакции: Евыдел Езатр = Q. Воспользовавшись табл. 1.2, определим тепловой эффект химической реакции горения водорода: 4EOH 2EH2 EO2 4 460,2 2 432,2 497,7кДж Q св св св H n 2 241,42 моль , где Есв – энергия химической связи, кДж/моль; H 2 n – число молей водорода, участвующих в химической реакции. Такое количество теплоты выделится, если прореагирует один моль водорода. Энергетическая схема протекания химической реакции представлена на рис. 1.1. Для того чтобы исходные реагенты превратились в продукты реак- ции, им необходимо преодолеть энергетический барьер (энергия активации). Величина энергетического барьера Есоответствует тому количеству энергии, которое необходимо молекулам исходных веществ для того, чтобы вступить в химическую реакцию. Эта энергия называется энергиейактивациихимиче-скойреакции. Для реакции окисления водорода, если она будет происходить по тому формальному механизму, который был рассмотрен (сначала разрыв химических связей в молекулах водорода и кислорода, а затем образование химических связей в молекулах воды), энергия активации Епо величине бу- дет равна энергии, необходимой для разрыва химических связей в молекулах водорода и кислорода, и это никак не меньше 400 кДж/моль (см. табл. 1.2). Однако для большинства реакций горения, в том числе и реакции горения водорода, значения энергии активации составляют всего 80–160 кДж/моль. Объясняется это особым механизмом реакций горения. Энергия 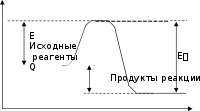 Направление химической реакции Направление химической реакции Рис. 1.1. Энергетическая схема химической реакции: Е, Е – энергия системы в начальном и конечном состояниях Тепловой эффект химической реакции Qне зависит от величины энергии активации Е, т. е. от того, по какому механизму происходит реак- ция, а зависит только от начального и конечного состояния системы (см. рис. 1.1). На этом основан метод расчета теплового эффекта по разнице теплот образования продуктов реакции и исходных веществ. Тепловой эффект химической реакции определяет количество теплоты, выделяющейся при горении. Тепловой эффект, рассчитанный для реакции горения с образованием продуктов полного окисления, называют низшейтеплотойсгораниявеществаQн. Для возникновения и распространения процесса горения решающее значение имеет не величина теплового эффекта, а скорость тепловыделе- ния, которая в первую очередь зависит от скорости химической реакции. Скорость химической реакции определяется количеством вещества, вступающего в реакцию в единицу времени в единице объема. Ее измеряют либо по убыли концентрации исходных веществ, либо по увеличению кон- центрации продуктов реакции. Например, скорость реакции окисления водорода, моль/(м3с): или W dCH 2 dτ (1.1) H где C 2 и CH O W dCH 2 O , (1.2) dτ 2 – концентрации водорода и воды в моль/м3. Производная dC / dτ H 2 будет отрицательной, так как в ходе реакции концентрация водорода уменьшается, поэтому перед ней ставят знак минус. Поскольку химическаяреакцияпроисходитпристолкновенияхмоле- кул реагирующих веществ, а число столкновений пропорционально кон- центрации молекул в единице объема, то скорость химической реакции пропорциональна концентрациям реагирующих веществ. Для мономолеку- лярной реакции типа АВ А+ В (распад молекулы АВ) скорость химической реакции W= kСАВ, (1.3) где k– константа скорости химической реакции. Такую реакцию еще называют реакцией первого порядка, так как по- казатель степени, с которым концентрация вещества входит в уравнение для скорости реакций, равен единице. Примером реакции первого порядка является распад ацетилена: С2 Н2 2Ств + Н 2 . Для бимолекулярной реакции типа А+ В С+ Д скорость химической реакции пропорциональна концентрациям компонен- тов Аи В W = kСАСВ. (1.4) Поскольку концентрация вещества А в степени единица и концен- трация вещества В также в степени единица, суммарный порядок реакции равен двум, поэтому такую реакцию называют реакцией второго порядка. Примером реакции второго порядка является реакция, происходящая при столкновении молекул водорода и хлора: H2 Cl2 2HCl.Тримолекулярные реакции типа А+ В + В С + D или А+ А + В С + D, C скорость которых определяется уравнениями B или W kCA 2 (1.5) A W kC2CB , (1.6) называют реакциями третьего порядка (сумма показателей степени кон- центраций реагентов равна трем). Реакция третьего порядка имеет место при соударении двух молекул водорода и молекулы кислорода 2Н2 О2 Н2О. Реакции более высоких порядков в природе не встречаются, так как вероятность одновременного столкновения четырех и более частиц (моле- кул, атомов, радикалов) практически равна нулю. Наиболее распростра- ненными являются реакции второго порядка. Химическая реакция происходит не при каждом соударении молекул. Для того чтобы произошло химическое взаимодействие, молекулы должны иметь энергию больше, чем энергия активации химической реакции. Энергия молекул увеличивается с ростом температуры газовой среды. Однако не все молекулы имеют одинаковую энергию. Согласно законам стати- ческой физики доля активных молекул (имеющих энергию выше, чем энергия активации химической реакции) пропорциональна абсолютной температуре: Nакт N exp(E/ RT) , (1.7) где Nи Nакт – общее число молекул и число активных молекул, соответственно; Е– энергия активации химической реакции; R– универсальная газовая постоянная; Т– температура, К. В табл. 1.3 показано, как меняется доля активных молекул с увеличе- нием температуры газа в зависимости от величины энергии активации. Таблица 1.3 Доля молекул, энергия которых превышает энергию активации химической реакции
Чем выше температура, тем больше доля активных молекул, а это значит – больше число эффективных соударений. Поскольку скорость хи- мической реакции пропорциональна числу эффективных соударений, то ее зависимость от температуры среды будет выглядеть аналогично уравне- нию (1.7). В связи с этим константу скорости химической реакции можно представить в виде: k = k0 exp (–E/RT), (1.8) где k0 – предэкспоненциальный множитель. Тогда уравнение для скорости, например, реакции второго порядка примет следующий вид: W = k0САСВexp (–E/RT). (1.9) В таком виде уравнение для скорости химической реакции называют уравнениемАррениуса. Уравнением Аррениуса могут быть описаны не только реакции простых типов (мономолекулярные, бимолекулярные и тримолеку- лярные), но и более сложные реакции, проходящие через несколько про- межуточных стадий. | ||||||||||||||||||||||||||||||||||||||||||||||||
