Синдром портальной гипертензии у детей. УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ.. Синдром портальной гипертензии у детей. УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСО. Учебнометодическое пособие для студентов педиатрических факультетов, интернов, ординаторов и врачей педиатров. Синдром портальной гипертензии у детей
 Скачать 339.25 Kb. Скачать 339.25 Kb.
|
|
МиНИСТЕРСВО ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ РФ Кафедра ХИРУРГИЧЕСКИХ БОЛЕЗНЕЙ ДЕТСКОГО ВОЗРАСТА Учебно-методическое пособие для студентов педиатрических факультетов, интернов, ординаторов и врачей педиатров. Синдром портальной гипертензии у детей. Портальная гипертензия (ПГ) является одной из основных причин наиболее тяжелых кровотечений из верхних отделов желудочно-кишечного тракта. И хотя доля этого синдрома среди всех случаев кровотечения из желудочно-кишечного тракта (ЖКТ) составляет не более 4,5%, но тяжесть кровотечений и сложность лечения заболевания заставляет обратить на этот синдром пристальное внимание. Синдром портальной гипертензии объединяет большое количество нозологических единиц, для которых характерно повышение давления в системе воротной(портальной) вены. Основным симптомом заболевания общим для всех видов портальной гипертензии является кровотечение из варикозных вен пищевода и желудка, которое проявляется обильной рвотой по типу «кофейной» гущи» и меленой(типичные признаки кровотечения из верхних отделов ЖКТ). Кровотечения из варикозных вен могут проявляться в любом возрасте (в наших наблюдениях – возраст самого младшего ребенка с кровотечением при портальной гипертензии – 4 мес) и является манифестирующим симптомом заболевания у 63% больных. Интенсивность кровотечений обычно значительна и требует экстренной госпитализации ребенка и проведении интенсивной гемостатической терапии. Частота эпизодов кровотечений индивидуальна и не зависит от каких-либо факторов. Именно кровотечения и являются наиболее угрожающим жизни больного симптомом. Даже в середине 80-х годов по данным различных авторов летальность достигала 5- 7 %. У 50% детей с ПГ первые кровотечения появляются до достижения 4-летнего возраста, а у 18% - в первые 3 года после рождения. Вторым симптомом по частоте первичного проявления является спленомегалия и гиперспленизм. Увеличение селезенки при портальной гипертензии встречается практически всегда и может достигать значительных размеров. (Рис.1.) У 22% детей спленомегалия является первичным симптомом, на основании которого выявляется портальная гипертензия. Гиперспленизм или панцитопения носит вторичный характер и является следствием увеличения селезенки. Наиболее характерно значительное снижение количества тромбоцитов – в 3-4 раза ниже нормы. 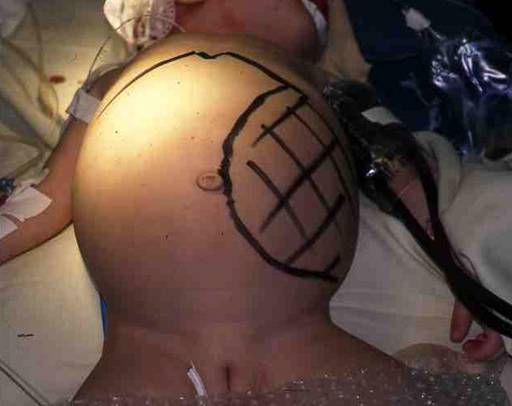 Рисунок 1. Спленомегалия у 4 месячного ребенка с портальной гипертензией. Асцит при портальной гипертензии встречается не часто. Он более свойственен детям с различными заболеваниями печени: цирроз, синдром Бадда–Киарри. Тем не менее, у небольшой части детей – 5-7% он является манифестирующим симптомом. Асцит развивается чаще в связи с нарушениями функций печени, но и повышение портального давления тоже играет патофизиологическую роль. Для того чтобы понять патофизиологию портальной гипертензии необходимо вернуться к нормальной анатомии воротной портальной системы. (Рис. 2) Воротная вена собирает кровь практически со всей брюшной полости: желудочно-кишечного тракта, селезенки, поджелудочной железы, желчного пузыря. Она образуется из слияния селезеночной (которая собирает кровь от селезенки и желудка, поджелудочной железы) и верхней брыжеечной вены (несущей кровь от желудка и тонкой кишки). Не менее крупным притоком воротной системы является нижняя брыжеечная вена, собирающая кровь от левой половины толстой и прямой кишки. В воротах печени кровь делится на правую и левую ветвь. 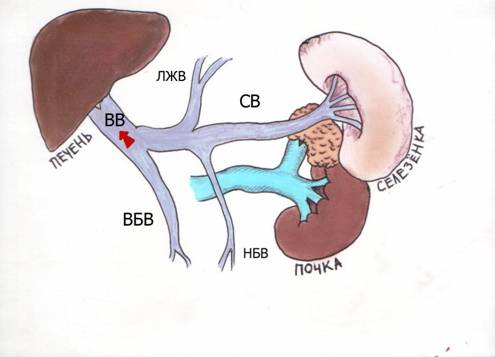 Рисунок 2. Схема строения портальной системы. ВВ – воротная вена, СВ – селезеночная вена, ВБВ – верхняя брыжеечная вена, ЛЖВ – левая желудочная вена, НБВ – нижняя брыжеечная вена. Кровоток по воротной вене у взрослого ребенка может достигать 1200 мл/мин. Воротная вена несет в себе до 65% всей крови притекающей к печени и 72% кислорода, получаемой печенью с притекающей кровью. Нормальное давление в воротной вене – 7 мм.рт.ст. Кровоток по воротной вене во многом определяет функциональное состояние печени. Помимо кислорода кровь несет из кишечника питательные вещества (для обеспечения синтетической функции печени), токсические продукты метаболизма (дезинтоксицирующиеся в печени), гормоны из поджелудочной железы и т.д. При возникновении препятствия на пути оттока крови из воротной системы развивается синдром портальной гипертензии – повышение венозного давления в висцеральных сосудах. Не менее важным патофизилогическим механизмом, приводящим к повышению давлению в системе воротной вены, является гипердинамический кардиальный синдром. Гипердинамический кардиальный синдром развивается в ответ на возрастание сопротивления в сосудах брюшной полости, увеличивая приток крови к висцеральным органам. Таким образом, формируется замкнутый патофизиологический механизм поддержания высокого давления в системе воротной вены. В связи с развитыми путями коллатерального кровотока происходит перестройка портальной гемодинамики при этом кровь по естественным портосистемным коллатералям начинает сбрасываться из бассейна воротной вены с высоким давлением в бассейн нижней или верхней полой вены с низким давлением (Рис.3) При этом наиболее значимым путем коллатерального перетока крови является венозная система пищевода и желудка. Кровь из воротной системы начинает под большим давлением сбрасываться по интрамуральным и подслизистым сплетениям желудка и пищевода, которые не выдерживают такого давления и сначала расширяются, образуя варикозные вены, а затем может происходить разрыв варикозных стволов. Это и является причиной тяжелых кровотечений при портальной гипертензии. С другой стороны высокое давление в воротной системе приводит к нарушению оттока, а часто ретроградному кровотоку по селезеночной вене. Это приводит к увеличению селезенки и как следствие, к развитию гиперспленизма. В этом случае короткие вены желудка и забрюшинные коллатерали селезенки обеспечивают переток крови из воротной системы. Сосудистые сплетения прямой кишки играют минимально значимую роль в формировании коллатерального кровообращения, поэтому ректальные кровотечения при портальной гипертензии являются казуистическим.  Рисунок 3. Схема портального кровотока при внепеченочной портальной гипертензии. ВБВ – верхняя брыжеечная вена, ЛЖВ – левая желудочная вена, НБВ – нижняя брыжеечная вена. Основной физиологической структурой печени является печеночная долька. Именно в структуре печеночной дольке терминальные ветви воротной вены впадают в синусоиды, являющиеся основным физиологическим звеном внутрипеченочной гемодинамики. Исходя из анатомического и физиологического строения печени, выделяют различные формы портальной гипертензии. 1) Надпеченочная (постсинусоидальная) форма портальной гипертензии – обструкция печеночных вен 2) Внутрипеченочная (синусоидальная) форма портальной гипертензии 3) Внепеченочная (пресинусоидальная) форма портальной гипертензии Надпеченочная форма портальной гипертензии наиболее редкая форма заболевания в детском возрасте (не более 0,8% всех случаев портальной гипертензии). В основе синдрома лежит обструкция печеночных вен на любом уровне, начиная от выносящей дольковой вены до впадения нижней полой вены в правое предсердие. Эту форму портальной гипертензии называют синдромом Бадда-Киари. Синдром Бадда-Киари развивается у больных с системной красной волчанкой, идиопатическом гранулематозном васкулите с преимущественным поражением венул, при различных видах недостаточности собственных антикоагулянтов. Синдром Бадда-Киари может развиться как следствие тяжелых автотравм (тупая травма живота), при веноокклюзионной болезни, отравлении солями тяжелых металлов. Примерно у четверти больных причина обструкции печеночных вен остается не ясной. Клинические проявления этой формы портальной гипертензии зависят от быстроты развития обструкции и распространенности процесса в печеночных венах. При остром течении заболевания возможно развитие злокачественной печеночной недостаточности, энцефалопатии и быстрое наступление летального исхода. Хроническое течение встречается чаще. При этом симптоматика развивается в течении 1-6 мес. Наиболее характерно значительное увеличение печени, болезненные ощущения в ее проекции, развитие асцита. В дальнейшем увеличивается селезенка. В биохимическом анализе крови – отмечается гипопротеинемия, повышения трансаминаз и другие признаки, характерные для нарушения синтетической функции печени. Внутрипеченочная (синусоидальная) форма портальной гипертензии объединяет в себя заболевания, характеризующиеся поражением непосредственно печеночной паренхимы (печеночной дольки), что приводит к обструкции кровотока на уровне синусоидов. Основной причиной внутрипеченочной портальной гипертензии является цирроз печени. Эта форма заболевания составляет не более 23% всех случаев портальной гипертензии детского возраста. Эта цифра резко контрастирует с взрослыми больными, где цирроз печени является основной причиной кровотечений из варикозных вен пищевода и желудка (до 65%). В детском возрасте наиболее частой причиной является гепатит, в то время как у взрослых больных значимую причину развития цирроза составляет алкогольное и токсическое поражение печени. Кроме того развитие внутрипеченочной формы портальной гипертензии может вызывать первичный биллиарный цирроз, шистозомиаз (редкое в нашей стране паразитарное заболевание), некоторые виды болезней накопления, фокальная нодулярная гиперплазия, врожденный фиброз печени. Целью лекция не является описание клиники цирроза печени. Хотелось бы отметить, что для всей этой группы больных на передней план выходит клиника поражения печеночной паренхимы: характерные изменения в биохимии крови(гипопротеинемия, повышение трансаминаз, снижение протромбинового индекса и т.д.) Как следствие нарушения синтетической функции печени и формирующейся портальной гипертензии характерно развитие асцита. В течение 2 лет после выявления цирроза печени кровотечения из варикозных вен пищевода развиваются у 35% больных. Именно в этой группе больных отмечается высокий процент летальных исходов при кровотечениях (12-18%). Из специфических симптомов можно отметить «стигмы цирроза» - сосудистые звездочки, желтуха, коллатеральная венозная сеть около пупка (голова Медузы). Забегая вперед, хочется отметить, что единственным радикальным методом лечения портальной гипертензии при циррозе печени является трансплантация печени. Врожденный фиброз печени и фокальная нодулярная гиперплазия несколько выделяется из всей этой группы заболеваний, поскольку склеротические изменения в печени в первую очередь затрагивают строму, а не паренхиму печени. То есть нарушение функций печени менее значительно. Изменения в биохимическом анализе крови при врожденном фиброзе печени и фокальной нодулярной гиперплазия выражены в значительно меньшей степени, чем при циррозе печени. В связи с этим для профилактики кровотечений при врожденном фиброзе печени используют операции портосистемного шунтирования. Около 72% случаев портальной гипертензии у детей составляет внепеченочная (пресинусоидная) форма заболевания (Рис. 3). Возможна обструкция любого участка воротной вены. При этом соединительные вены – venae commitantes – увеличиваются и по ним под большим давлением кровь стремится попасть в печень. При этом эти вены приобретают вид кавернозного сосудистого образования – «портальная кавернома». Сама воротная вена превращается в фиброзный тяж и плохо дифференцируется среди множества измененных сосудов. Однако даже расширенных соединительных вен (портальной каверномы) недостаточно, чтобы обеспечить переток всей крови из воротной системы. Считается, что в печень попадает не более 15-20% долженствующего объема венозной крови. Спор о причине внепеченочной портальной гипертензии продолжается до сих пор. Причиной внепеченочной портальной гипертензии часто служит тромбоз воротной вены, развившийся вследствие омфалита, пупочного сепсиса, обезвоживания. Инфекция распространяется по пупочной вене на левую ветвь воротной вены, а затем и на ее ствол. Катетеризация пупочной вены у новорожденных и введение высоко концентрированных веществ в процессе лечения может привести так же к тромбозу воротной вены. С другой стороны существуют пороки развития сосудистой системы брюшной полости, которые проявляются в частности аномалией строения воротной вены, приводящей к нарушению кровотока по ней. Но примерно в 15% случаев причина портальной гипертензии остается невыясненной. У таких детей в анамнезе не было омфалита или пупочного сепсиса, и исследование анатомии сосудов брюшной полости не выявляет аномалии, за исключением непроходимости воротной вены. В этом случае можно говорить об идиопатической внепеченочной портальной гипертензии. Очень важно подчеркнуть, что при внепеченочной портальной гипертензии паренхима печени практически не страдает. Не смотря на снижение кровотока по воротной вене, функции печени не нарушены. Это связано с адаптационными механизмами, благодаря которым печень начинает получать больше крови по артериальному руслу. Кроме того, по сети коллатералей в воротах печени, как уже отмечалось, часть крови, оттекающая от органов брюшной полости, попадает в печень, несмотря на блок воротной вены. Безусловно, основным методом первичной диагностики при портальной гипертензии является фиброэзофагогастроскопия (ФЭГДС) и ультразвуковое исследование (УЗИ). При подозрении на синдром портальной гипертензии: эпизод желудочно-кишечного кровотечения, спленомегалия, асцит – именно эти исследование, которые можно выполнить даже амбулаторно, позволяют поставить диагноз. Верифицировать диагноз позволяет наличие варикозных вен в пищеводе и желудке при ФЭГДС. Кроме того, могут быть выявлены различные формы гастропатии: венозное полнокровие, гиперемия слизистой и т.д. Но наличие варикозных вен является обязательным симптомом. Если при эндоскопии варикозных вен не выявлено – диагноз портальной гипертензии сомнителен. Выделяют различные степени варикозных вен пищевода (1-4 степень) в зависимости от выраженности варикозных стволов, воспалительных изменений и риска кровотечения. (Рис. 4)  Рисунок 4. Эндоскопическая картина варикозных вен пищевода. Современная ультразвуковая диагностика позволяет не только оценить структуру и размеры печени, селезенки, но и оценить скорость и характер кровотока по сосудам воротной системы. При болезни Бадда-Киари УЗИ с допплерографией позволяет выявить непроходимость печеночных вен. При циррозе печени при УЗИ хорошо виден узловой характер изменений в печеночной паренхиме. «Портальная кавернома» - кавернозное расширение гепатопетальных коллатералей при портальной гипертензии - наглядно определяется при УЗИ.(Рис. 5) Взаимоотношение сосудов брюшной полости и характер кровотока по ним , выявляемые при УЗИ с допплерографии, очень важно для планирование возможностей оперативного вмешательства. 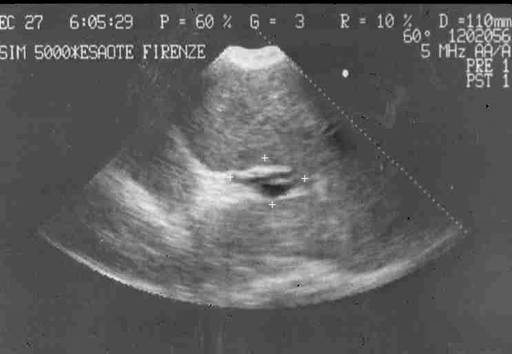 Рисунок 5. «Портальная кавернома» - конгломерат коллатералей в воротах печени на месте ствола воротной вены у ребенка с внепеченочной портальной гипертензии. Данные УЗИ. Наиболее демонстративным исследованием является ангиография. Современная ангиография с цифровой обработкой изображения (субтракционная дигитальная ангиография) позволяет абсолютно точно поставить диагноз, оценить состояние коллатерального кровотока, изучить анатомию висцеральных сосудов, оценить результаты оперативного вмешательства. Самый простой метод ангиографии – спленопортография, может быть выполнена без специального ангиографического оборудования. На рисунке 6 – спленопортография ребенка с внепеченочной формой портальной гипертензии – виден контраст введенный в селезенку, отсутствует контрастирование ствола селезеночной вены (за счет ретроградного кровотока), видны лишь забрюшинные коллатерали (1), по которым кровь оттекает от селезенки в систему нижней полой вены и коллатерали, по которым кровь сбрасывается на желудок и пищевод (2). 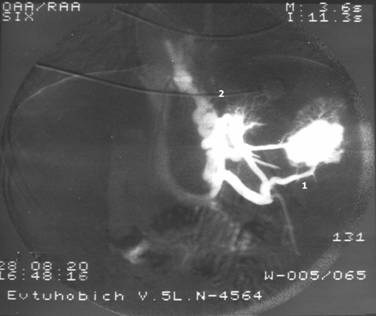 Рисунок 6. Спленопортография. Портальная гипертензия. Объяснения в тексте. 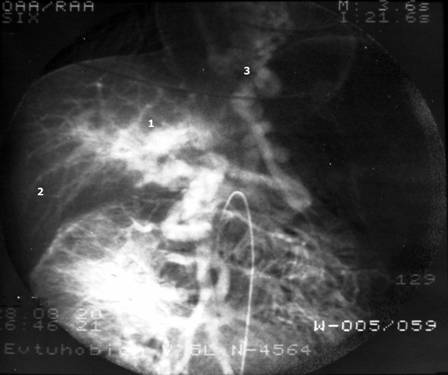 Рисунок 7. Мезентериография. Внепеченочная портальная гипертензия. Объяснения в тексте. Мезентеропортография – другой метод ангиографического исследования, наглядно демонстрирующий архитектоники сосудов брюшной полости. При этом по катетеру в верхнюю брыжеечную артерию вводится контрастное вещество. А затем проводится изучение венозной фазы распределения контраста. На Рис. 7 видна «портальная кавернома» в воротах печени (1), значительное обеднение контрастирования внутрипеченочных ветвей воротной вены (2), сброс венозной крови на расширенные коллатерали в стенке желудка и пищевода (3). На основании этого исследования можно достоверно поставить диагноз – внепеченочная портальная гипертензия. Радиоизотопное исследование позволяет количественно оценить портальную гемодинамику. Введенный в селезенку радиофармпрепарат – технеций - (радиоизотопная спленопортография) у здоровых детей адсорбируется в печени, а при различных формах портальной гипертензии большая часть препарата попадает в легкие через систему коллатерального кровотока, минуя печень. Таким образом, можно количественно оценить объем коллатерального сброса (Рис. 8) 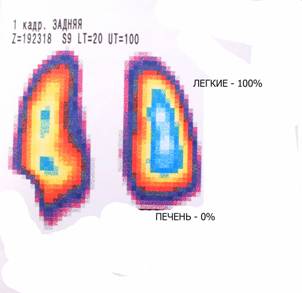 Рисунок 8. Радиоизотопная спленопортография. Типичное распределение радиофармпрепарата между легкими(100%) и печенью(0%) при портальной гипертензии. В последнее время дополнительные возможности диагностики появились с использованием высокоскоростного спирального компьютерного томографа и магнитно-резонансной томографии (МРТ). Основная цель лечения больных с портальной гипертензией – предотвращение кровотечений из варикозных вен пищевода и желудка (как наиболее опасного для жизни ребенка симптома). Как уже отмечалось, большинство детей поступают в клиники в связи с кровотечением из верхних отделов ЖКТ. Кровотечение обычно носят обильный характер, и состояние больного серьезно страдает. Основной задачей врача в этот момент является остановить кровотечение максимально возможными консервативными методами. Это связано, во-первых, с тем, что целесообразней выполнять операции по поводу портальной гипертензии в клиниках, обладающих опытом лечения этой сложной группы больных, а во-вторых, оперативное лечение целесообразнее выполнять в плановом порядке. Необходимо остановится на нескольких основных пунктах ведения детей, поступивших в лечебное учреждение на высоте кровотечения из варикозных вен пищевода и желудка. Ребенку полностью исключают кормление через рот, исключают питье. Строгий постельный режим. Назначается седативная терапия. Проводится массивная гемостатическая терапия с переливанием при необходимости компонентов крови. Основная особенность инфузионной терапии – ребенку назначают примерно 50% долженствующего объема инфузии с целью достижения гемоконцентрации и гемостаза. Если с помощью консервативной терапии не удается остановить кровотечение, используют зонд Блэкмора (Рис. 9). Раздутый баллон на конце зонда Блэкмора пережимает сосуды кардиальной зоны. Пищеводный баллон зонда Блэкмора у детей обычно не используют. Кроме того применения зонда Блэкмора у детей требует перевода ребенка на ИВЛ. При отсутствии зонда Блэкмора у маленьких детей возможно применение катетера Фолея с баллоном на конце. 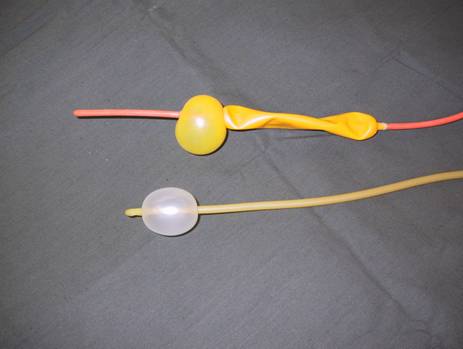 Рисунок 9. Зонд Блэкмора (вверху) и катетер Фолея (внизу). Если кровотечение остановить не удается, необходимо выполнить экстренную операцию. В ДГКБ №13 им. Филатова выполнено более 400 операций детям с портальной гипертензией. Из них лишь 20% оперированы по экстренным показаниям на высоте кровотечения. 54% операции выполнены по плановым показаниям: наличие эпизода кровотечения из варикозных вен в анамнезе. И у 26% операции выполнялись по профилактическим показаниям. К этой группе мы относили детей, не имевших кровотечения в анамнезе, но с диагностированной внепеченочной портальной гипертензией, риском кровотечения из варикозных вен пищевода при эндоскопии. Немаловажным фактором при выполнении операций по профилактическим показаниям являлось место проживание ребенка – то есть доступность в случае кровотечения квалифицированной помощи. Все основные методы лечения портальной гипертензии можно разделить на 3 группы:
Еще раз подчеркнем, что при поражении печеночной паренхимы – внутрипеченочная портальная гипертензия - единственным радикальным методом лечения является пересадка печени. Безусловно, это представленная классификация условна. Существуют и другие методы лечения портальной гипертензии. Так, например, медикаментозное лечение – у взрослых больных с циррозом печени описывают возможность применения препаратов снижающие висцеральное венозное давление (нитропруссид натрия, пропанол). Однако, этот метод не нашел применения в детской практике из-за низкой эффективности. Операции отчаяния – спленэктомия или лапаротомия с прошиванием варикозных вен желудка – не обеспечивают эффективный контроль над кровотечениями, но широко применяются в районных клиниках в качестве метода экстренной остановки кровотечения. Такие операции как оментогепатопексия в настоящее время представляют лишь исторический интерес. Эндоскопическое склерозирование - метод, заключающийся в том, что при эзофагоскопии производят введение склерозирующих веществ (спирт, фибровейн, тромбовар) в варикозные вены пищевода или перивазальное пространство. Другим вариантом этого метода является эндоскопическое лигирование (banding) – лигирование варикозных узлов с помощью растяжимых колец при эзофагоскопии. Методы привлекательны своей малой инвазивностью, относительной простотой и малым количеством осложнений. Эти методы широко применяются у взрослых больных с циррозом печени. У детей основной причиной нераспространенности этого метода является недостаточно высокий эффект контроля кровотечения. Рецидив кровотечений из варикозных вен после эндоскопического склерозирования или лигирования достигает 26%. Кроме того метод требует проведения повторных сеансов (до 8-10) для достижения клинически значимого результата. Мы наблюдали большую группу детей, которых мы оперировали по поводу рецидивных кровотечений из варикозных вен после многолетнего безуспешного лечения эндоскопическим склерозированием, проведенным не в нашей клинике. Операции деваскуляризации широкое распространение получили в Японии. Основным принципом операции является разобщение подслизистых и интрамуральных венозных сплетений пищевода и желудка от бассейна воротной вены с высоким венозным давлением. Наиболее эффективной является операция, разработанная японским хирургом Sugiura. (Рис. 10) С целью уменьшения притока венозной крови в систему воротной вены производят удаление селезенки (1). Затем производят деваскуляризацию желудка по большой и малой кривизне (2) и нижней трети пищевода (3), чтобы исключить возможность сброса крови из портальной системы на вены желудка и пищевода. При этом сохраняют параэзофагеальные коллатерали для возможности декомпрессии бассейна воротной вены (5). Для того, чтобы исключить переток крови на вены пищевода по интрамуральным коллатералям, производят пресечение пищевода (эзофаготомию) с последующим выполнением эзофаго-эзофаго анастомоза и фундопликацией по Нисану (4). Эта операция так же широко применяется у взрослых больных с циррозом печени. Она обеспечивает уровень рецидивных кровотечений не более 15-18%.  Рисунок 10. Операция деваскуляризации желудка и пищевода и спленэктомии (по Sugiura). Объяснения в тексте. В нашей стране наибольшее распространение получили операции портосистемного шунтирования (ПСШ), направленные на снижение давления в портальном бассейне. Операции портосистемного шунтирования были предложены одними из первых для лечения портальной гипертензии у взрослых больных. Основной принцип операций – создание искусственного сосудистого анастомоза, соединяющего бассейн портальной системы с высоким давлением и бассейн нижней полой вены с низким давлением. Первоначально эти операции получили широкое распространение, поскольку очень эффективно предотвращали кровотечения за счет значительного снижения давления в системе воротной вены. Однако, в последствии было отмечено развитие прогрессивное ухудшение состояния больных, связанных со специфическим поражением – портосистемной энцефалопатией (ПСЭ). ПСЭ – специфическое поражение нервной системы, вызванное попаданием продуктов метаболизма, всасывающихся из кишечника, в общее кровяное русло, минуя печень. При создании искусственного портосистемного шунта кровь из воротной системы в большом объеме сбрасывается в систему нижней полой вены. Токсические метаболиты, дезинтоксикация которых происходила в печень, при этом попадают в общее кровяное русло, проникают через гематоэнцефалический барьер и повреждают клетки головного мозга. При этом могут быть отмечены различные неврологические изменения вплоть до комы. Кроме того, в условиях цирроза печени при резком значительном снижении давления в системе воротной вены, происходит нарушение кровообращения печени и нарушение ее функций вплоть до развития тяжелой печеночной недостаточности. Поэтому эти операции выполнялись преимущественно у больных с сохраненной функцией печени. Однако, в детском возрасте, наибольшее количество пациентов с внепеченочной портальной гипертензией, при которых паренхима печени не страдает. Дискуссия о возможности развития ПСЭ у детей продолжается до сих пор. Применение операций портосистемного шунтирования в раннем детстве долгое время считалось ограниченным из-за высокой частоты тромбоза шунта, а также из-за вероятности развития портосистемной энцефалопатии после шунтирования. Однако именно эти операции на современном этапе представляются наиболее перспективными в хирургии внепеченочной портальной гипертензии. Среди операций портосистемного шунтирования одними из первых стали применяться операции, соединяющие нижнюю полую вену и воротную иди верхнебрыжеечную вену. Наиболее часто выполняются кавомезентериальный анастомоз и мезокавальный Н-шунт (Рис.11, 12). Эти операции относятся к так называемым «тотальным» шунтам. Поскольку большой объем сброса крови из воротной системы приводит к практически полному прекращению портальной перфузии печени. Тем не менее, в наших наблюдениях у 125 больных с «тотальными» шунтами ПСЭ развилась лишь в одном случае за 12 лет наблюдений.  Рисунок 11. Кавамезентериальный анастомоз. 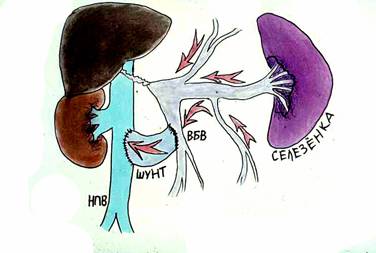 Рисунок 12. Портальная гемодинамика при мезокавальном Н-шунте. Более физиологичные операции на спленоренальной зоне. Создание различных сосудистых анастомозов между селезеночной веной с высоким давлением и левой почечной веной с низким давлением позволяют эффективно предотвращать кровотечения из варикозных вен, и в то же время в раннем послеоперационном периоде поддерживать относительно высокое давление в верхнебрыжеечной вене, что в свою очередь обеспечивает некоторую портальную перфузию печени. Операция центрального спленоренального анастомоза с удалением селезенки используется крайне редко (Рис. 13).  Рисунок 13. Центральный спленоренальный шунт. Наиболее типичными являются операция спленоренального анастомоза бок-в-бок (рис. 14) и дистального спленоренального анастомоза («селективный» шунт) (Рис.15). Надежность портосистемного шунтирования в предотвращении кровотечений при портальной гипертензии особенно важна для детей из отдаленных районов, с ограниченным уровнем медицинского обеспечения.  Рисунок 14. Спленоренальный анастомоз бок-в-бок. 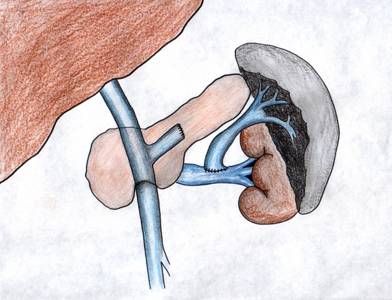 Рисунок 15.Дистальный спленоренальный анастомоз. В нашей клинике выполнено более 450 операций портосистемного шунтирования. Из них 280 – различные виды спленоренальных анастомозов. Средний возраст оперированных пациентов – 6,5 лет. Более 23% оперированы в возрасте до 3 лет. Самому младшему оперированному ребенку было 4 мес. В настоящее время возраст ребенка не является ограничивающим фактором. При современном уровне развития увеличительной техники и шовного материала можно выполнять сосудистые операции при диаметре сосудов менее 5 мм. За 12 лет наблюдений мы отметили из 465 операций лишь 18 случаев развития рецидивных кровотечений вследствие тромбоза шунта (3,8%), 5 больных погибло (1,3%) и выявлен лишь один случай ПСЭ. Таким образом, уровень интра – и постоперационной летальности, ближайших послеоперационных осложнений при современном развитии хирургии портальной гипертензии минимален. Наши исследования показывают, что операции портосистемного шунтирования у детей эффективно предотвращают кровотечения из варикозных вен пищевода, не приводят к нарушению функции печени и развитию выраженной портосистемной энцефалопатии. Оценить результаты оперативного вмешательства позволяют точные методы обследования ребенка. При ФЭГДС отмечается исчезновение или значительное уменьшение варикозных вен пищевода. По данным УЗИ можно оценить уменьшение размеров селезенки, кровоток по шунту. Наиболее показательно демонстрирует изменение портальной гемодинамики после операции ангиографические исследования. На слайде спленопортограмма ребенка после дистального спленоренального шунтирования. Хорошо контрастируется сосудистый анастомоз, по которому происходит сброс крови через левую почечную вену в нижнюю полую вену (Рис. 16).  Рисунок 16. Спленопортография Дистальный спленоренальный шунт Не смотря на столь оптимистичны результаты, безусловно, портосистемное шунтирование не является радикальным методом лечения, поскольку не устраняет основную причину портальной гипертензии – блок кровотока по воротной вене. Отдаленные наблюдения показали, что качество жизни ребенка после операции, к сожалению, нельзя назвать идеальным. Тем не менее, большинство наших больных, в целом, чувствовали себя хорошо или удовлетворительно. По прошествии 8-12 лет после операции обследованные пациенты (чаще, уже взрослые люди) вели активный образ жизни, учились в высших учебных заведениях, работали, создавали семьи. Таким образом, операции портосистемного шунтирования, даже выполненные в раннем возрасте, не приводят к инвалидизации пациентов. Между тем у 65% пациентов отмечается гастропатия, у 12% язвенная болезнь желудка или двенадцатиперстной кишки, у 44% гипердинамический кардиальный синдром, у 78% неспецифические неврологические жалобы (головная боль, утомляемость, эмоциональная лабильность, плохая успеваемость). Поэтому поиск новых методов лечения продолжался. В 1998 году бельгийский хирург Ville de Goye предложил новый способ лечения портальной гипертензии – мезопортальный анастомоз (или как он называется в иностранной литературе – Rex-shunt). Этот революционный способ радикальной коррекции внепеченочной портальной гипертензии основан на предположении о том, что при тромбозе воротной вены ее внутрипеченочные ветви, в первую очередь левая, остаются незатронутыми фибротическим процессом. В этом случае, возможно наложение обходного анастомоза между верхней брыжеечной веной и левой ветвью воротной вены, используя внутреннюю яремную вену в качестве аутовенозной вставки. Таким образом, восстанавливается нормальная физиология и анатомия портальной системы (Рис. 17) 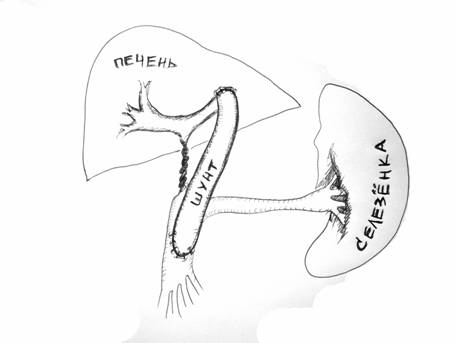 Рисунок 17. Схема операции мезопортального анастомоза (Rex-shunt) С 2002 года в нашей клинике оперировано 116 детей с внепеченочной портальной гипертензией. Из них у 36 детей выполнен мезопортальный анастомоз. Все операции проходили по следующей схеме. По ходу пупочной вены проводят выделение пупочной вены. После выделения левой ветви воротной вены просвет ее вскрывают для определения возможности выполнения анастомоза. У большой части пациентов все внутрипеченочные ветви воротной вены фиброзно изменены. В этом случае выполняют спленоренальное шунтирование. У 32% наших детей был выявлен хороший просвет левой ветви воротной вены с хорошим ретроградным кровотоком. В этом случае возможно выполнение «идеальной» коррегирующей операции. Для этого в корне брыжейки тонкой кишки выделяют верхнюю брыжеечную вену. Затем, используя внутреннюю яремную вену в качестве аутовенозной вставки, выполняют мезопортальный анастомоз. На рисунке (рис. 18) хорошо видно, как кровь под большим давлением проходит по шунту из бассейна воротной вены в печень. Таким образом, восстанавливается нормальная портальная перфузия печени. 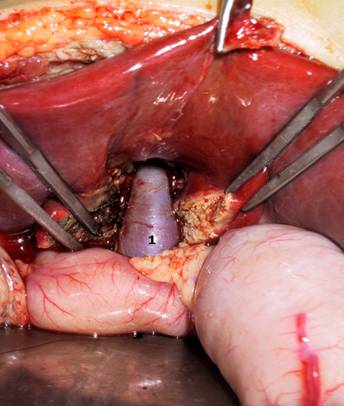 Рисунок 18. Мезопортальный анастомоз. 1 – аутовенозная вставка из внутренней яремной вены. Количество осложнений, течение раннего послеоперационного периода у детей после мезопортального анастомоза не отличается от стандартных операций. Однако, в отдаленные сроки, родители отмечают улучшение субъективного самочувствия ребенка, повышение устойчивости к нагрузкам, улучшение успеваемости и положительные изменения в эмоциональной сфере. Данные объективных методов исследования наглядно демонстрируют восстановление нормальной анатомии воротной системы (Рис.19). На рисунке мезентериография ребенка до и после операции мезокавального шунтирования. 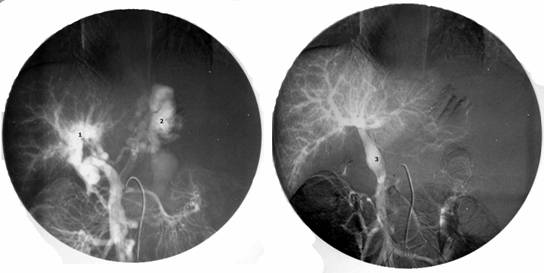 Рисунок 19. Мезентериография у ребенка с внепеченочной портальной гипертензией. До операции (слева) и после мезопортального анастомоза (справа). Объяснения в тексте. До операции – «портальная кавернома», значительное обеднение внутрипеченочных ветвей воротной вены, сброс венозной крови на варикозные вены желудка (2). После операции хорошо виден мезопортальный шунт, несущий кровь в печень из верхней брыжеечной вены (3), значительное улучшение портальной перфузии печени, отсутствие патологического шунтирования венозной крови. При радиоизотопной спленопортографии до операции 100% радиофармпрепарата шунтируются, минуя печень по портосистемным коллатералям, накапливаясь в легких. После мезокавального шунтирования большая часть препарата накапливается в печени. Таким образом, хотелось бы подвести итог.
|
