ФЕРМЕНТЫ. Учебное пособие введение
 Скачать 2.87 Mb. Скачать 2.87 Mb.
|
Свойства ферментовБудучи белками, ферменты обладают всеми их свойствами. Вместе с тем биокатализаторы характеризуются рядом специфических качеств, тоже вытекающих из их белковой природы. Сюда относятся термолабильность ферментов, зависимость их действия от значения рН среды (рис.7), специфичность и, наконец, подверженность влиянию активаторов и ингибиторов.
Рис. 7 Термолабильность ферментов объясняется тем, что температура, с одной стороны, воздействует на белковую часть фермента, приводя при слишком высоких значениях к денатурации белка и снижению каталитической функции, а с другой стороны, оказывает влияние на скорость реакции образования фермент-субстратного комплекса и на все последующие этапы преобразования субстрата, что ведет к усилению катализа. Зависимость каталитической активности фермента от температуры выражается типичной кривой. До некоторого значения температуры (в среднем до 5О°С) каталитическая активность растет, причем на каждые 10°С примерно в 2 раза повышается скорость преобразования субстрата. В то же время постепенно возрастает количество инактивированного фермента за счет денатурации его белковой части. При температуре выше 50°С денатурация ферментного белка резко усиливается и, хотя скорость реакций преобразования субстрата продолжает расти, активность фермента, выражающаяся количеством превращенного субстрата, падает. Температура, при которой каталитическая активность фермента максимальна, называется его температурным оптимумом. Температурный оптимум для различных ферментов неодинаков. В общем для ферментов животного происхождения он лежит между 40 и 50°С, а растительного - между 50 и 60°С. Однако есть ферменты с более высоким температурным оптимумом, например, у папаина (фермент растительного происхождения, ускоряющий гидролиз белка) оптимум находится при 8О°С. В то же время у каталазы (фермент, ускоряющий распад Н2О2 до Н2О и О2) оптимальная температура действия находится между 0 и 10°С, а при более высоких температурах происходит энергичное окисление фермента и его инактивация. Зависимость активности фермента от значения рН среды была установлена свыше 50 лет назад. Для каждого фермента существует оптимальное значение рН среды, при котором он проявляет максимальную активность. Большинство ферментов имеет максимальную активность в зоне рН поблизости от нейтральной точки. В резко кислой или резко щелочной среде хорошо работают лишь некоторые ферменты. Переход к большей или меньшей (по сравнению с оптимальной) концентрации водородных ионов сопровождается более или менее равномерным падением активности фермента. Влияние концентрации водородных ионов на каталитическую активность ферментов состоит в воздействии ее на активный центр. При разных значениях рН в реакционной среде активный центр может быть слабее или сильнее ионизирован, больше или меньше экранирован соседними с ним фрагментами полипептидной цепи белковой части фермента и т.п. Кроме того, рН среды влияет на степень ионизации субстрата, фермент-субстратного комплекса и продуктов реакции, оказывает большое влияние на состояние фермента, определяя соотношение в нем катионных и анионных центров, что сказывается на третичной структуре белковой молекулы. Последнее обстоятельство заслуживает особого внимания, так как определенная третичная структура белка-фермента необходима для образования фермент-субстратного комплекса. Специфичность - одно из наиболее выдающихся качеств ферментов – обсуждалась выше. ИНГИБИТОРЫ ФЕРМЕНТОВДействие ферментов можно полностью или частично подавить (ингибировать) определенными химическими веществами - ингибиторами (рис. 8). По характеру своего действия ингибиторы подразделяются на обратимые и необратимые. В основе такого деления лежит прочность соединения ингибитора с ферментом. 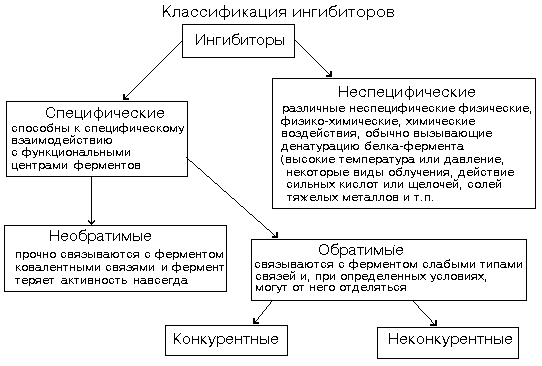 Рис. 8 Обратимые ингибиторы — это соединения, которые нековалентно взаимодействуют с ферментом и могут диссоциировать от фермента. Обратимое ингибирование может быть конкурентным. Конкурентный ингибитор конкурирует с субстратом за связывание в субстратсвязывающем участке активного центра и связывается с ферментом похожим способом, как и субстрат. Но конкурентный ингибитор, связанный с ферментом, не подвергается ферментативному превращению. Отличительная особенность конкурентного ингибирования состоит в том, что его можно ослабить или полностью устранить, повысив концентрацию субстрата. Многие лекарства являются конкурентными ингибиторами ферментов.
Пример. Сульфамидные препараты, используемые для лечения инфекционных болезней. Сульфаниламиды – это структурные аналоги парааминобензойной кислоты, из которой в клетке микроорганизма синтезируется кофермент (Н4 - фолат), участвующий в биосинтезе нуклеиновых оснований. Нарушение синтеза нуклеиновых кислот приводит к гибели микроорганизмов.
Обратимое ингибирование может быть неконкурентным в отношении субстрата; в этом случае ингибитор не конкурирует с субстратом за одно и то же место в ферменте. Неконкурентный ингибитор может связаться с ферментом и в присутствии, и в отсутствие субстрата, увеличение концентрации субстрата не препятствует связыванию ингибитора (рис.9). Неконкурентный ингибитор в действительности уменьшает количество активного фермента.
Рис.9 Связывание приводит к изменению конформации фермента и нарушению комплементарности к субстрату. Неконкурентные ингибиторы могут обратимо связываться как со свободным ферментом, так и с комплексом ES. Наиболее важными неконкурентными ингибиторами являются образующиеся в живой клетке промежуточные продукты метаболизма, способные обратимо связываться с определенными участками ферментов (аллостерические центры) и изменять их активность, что является одним из способов регуляции метаболизма. Необратимые ингибиторы — это соединения, которые могут специфически связывать определенные функционально важные группы активного центра, образуя ковалентные, прочные связи с ферментом. При этом они необратимо, часто ковалентно, связываются с ферментом или фермент - субстратным комплексом и необратимо изменяют нативную конформацию. В основе действия некоторых токсичных веществ лежит ингибирование активности ферментов, например, соединений мышьяка, Hg2+, Pb2+ Пример Диизопропилфторфосфат ингибирует ферменты, имеющие серин в активном центре. Таким ферментом является ацетилхолинэстераза, катализирующая следующую реакцию:
Реакция происходит каждый раз после проведения нервного импульса, прежде чем второй импульс будет передан через синапс. Диизопропилфторфосфат - одно из отравляющих веществ нервно-паралитического действия, так как приводит к утрате способности нейронов проводить нервные импульсы.
Пример. Терапевтическое действие аспирина как жаропонижающего и противовоспалительного средства объясняется тем, что аспирин ингибирует один из ферментов, катализирующий синтез простагландинов (ПГ). Простагландины - вещества, участвующие в развитии воспаления. Ингибирование обусловлено ковалентной модификацией одной из аминогрупп фермента - простагландинсинтетазы.
3. РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ Способность к регуляции делает ферменты важными участниками и своеобразными организаторами клеточных процессов в организме человека. Регуляция скорости ферментативных реакций в клетке — основной механизм не только контроля и координации метаболических путей, но и роста и развития клетки, а также ее ответа на изменение окружающей среды. Существует два основных способа контроля скорости ферментативных реакций: — Контроль количества фермента. Количество фермента в клетке определяется соотношением скоростей его синтеза и распада. Этот способ регуляция скорости ферментативной реакции является более медленным процессом (проявляется спустя несколько часов), чем регуляция активности фермента (практически мгновенный ответ). — Контроль активности фермента. Активность фермента может регулироваться путем взаимодействия с определенными веществами, изменяющими конформацию активного центра. Некоторые способы регуляции активности ферментов представлены на рисунке 10. Регуляция субстратом реакции Регуляция ферментативной активности, осуществляемая в центре присоединения субстрата, носит название изостерической. Одним из относительно простых способов регуляции активности ферментов является регуляция с помощью изменения концентрации субстратов реакции. Чем больше в распоряжении фермента имеется молекул веществ, превращения которых он осуществляет, тем выше (до определенных пределов) скорость процесса. При насыщении всех молекул фермента субстратом скорость реакции достигает максимального уровня. В дальнейшем скорость реакции может понизиться по мере исчерпания запасов субстрата и вновь возрасти при их восстановлении. Слишком большая концентрация субстрата также может понижать скорость ферментативной реакции. Этот феномен носит название субстратного торможения. В качестве примера субстратного торможения можно привести фермент, расщепляющий биологически активное вещество ацетилхолин - ацетилхолинэстеразу (АХЭ). К активному центру АХЭ субстрат (ацетилхолин) присоединяется двумя концами молекулы одновременно. При увеличении концентрации ацетилхолина с одной молекулой фермента могут одновременно реагировать две молекулы субстрата, но разными концами. В этом случае реакция, суть которой заключается в разрыве сложноэфирной связи в середине молекулы ацетилхолина (с образованием холина и уксусной кислоты), оказывается невозможной, и молекулы ацетилхолинэстеразы, нагруженные субстратом, оказываются тем не менее лишенными активности. Уменьшение концентрации ацетилхолина в среде приведет к диссоциации неактивного комплекса и снимет торможение. Этот механизм имеет важное физиологическое значение для регуляции концентрации ацетилхолина, который выполняет в нервной системе и мышцах роль медиатора, передающего возбуждение с одной клетки на другую. Аллостерическая регуляция. Фермент изменяет активность с помощью нековалентно связанного с ним эффектора. Связывание происходит в участке, пространственно удаленном от активного (каталитического) центра (allos - иной). Это связывание вызывает конформационные изменения в молекуле белка, приводящие к изменению определенной геометрии каталитического центра. Активность может увеличиться - это активация фермента, или уменьшиться - это ингибирование.
«Сообщение» о присоединении аллостерического активатора передается посредством конформационных изменений каталитической субъединице, которая становится комплементарной субстрату, и фермент «включается». При удалении активатора фермент вновь переходит в неактивную форму и «выключается». Аллостерическая регуляция является основным способом регуляции метаболических путей. Метаболические цепи Обычно ферментативные реакции в клетке организованы в метаболические цепи или циклы, где самая медленная стадия лимитирует скорость всей цепи, то есть последовательности реакций, объединяемых общими субстратами (рис.9). В таких цепях нередко наблюдается так называемая регуляция по типу обратной связи. Она служит для того, чтобы скорректировать работу цепи с потребностями клетки в конечном продукте. Принцип регуляции заключается в том, что ферменты, стоящие в начале цепи, ингибируются отдаленными метаболитами или конечными продуктами. Такая регуляция чаще всего происходит по аллостерическому типу, когда молекула регулятора связывается с ферментом в специальном регуляторном центре. Аллостерические ферменты часто выполняют ключевую роль в регуляции обмена веществ, поскольку обладают способностью определять количество важных метаболитов и изменять в соответствии с этим свою активность. В каждой метаболической цепи есть фермент, который задает скорость всей цепочке реакций. Он называется регуляторным ферментом. Ферменты, регулирующие скорость метаболических путей: - обычно действуют на ранних стадиях метаболических путей, в местах ключевых разветвлений метаболических путей; - катализируют в условиях клетки практически необратимые реакции, протекающие наиболее медленно (ключевые).
Химическая модификация молекул ферментов (рис.10) Химическая модификация белков осуществляется за счет присоединения к аминокислотным остаткам в молекуле белка определенных групп: фосфатной группы (при участии протеинкиназ), остатка жирной кислоты (с помощью ацилтрансфераз), углеводных компонентов (гликозил-трансферазы, гликозидазы). Белки, как правило, имеют лабильную структуру, упаковка которой сильно зависит от свойств химических групп, входящих в состав молекулы. Поэтому присоединение к молекуле белка дополнительных группировок существенно влияет на структуру, а следовательно, и на ферментативную активность молекулы. Такая регуляция носит приспособительный (адаптационный) характер. Пример. Регуляция активности ферментов путем фосфорилирования-дефосфорилирования. Фермент изменяет активность в результате ковалентной модификации.
В этом случае фосфатная группа - ОРО32- присоединяется к гидроксильным группам в остатках серина, треонина или тирозина. В зависимости от природы фермента фосфорилирование может его активировать или, наоборот, инактивировать. Реакция присоединения фосфатной группы и ее отщепление катализируют специальные ферменты - протеинкиназы и протеинфосфатазы. Фосфорилирование - распространенный способ изменить свойства некоторых клеточных белков. Так, при фосфорилировании компонентов цитоскелета (комплекса структурных белков, обеспечивающих поддержание прочности и функционирования клетки) изменяются прочность его взаимодействия с мембраной и форма клеток. Фосфорилирование белков - регуляторов сокращения активирует сократительную реакцию мышцы. Регуляция с помощью химической модификации белка приводит к долговременным последствиям: модифицированные молекулы сохраняют свои функции измененными до тех пор, пока специальные ферменты не отщепят модифицирующую белок химическую группу и не вернут его в исходное состояние. Регуляция путем белок-белковых взаимодействий (ассоциации-диссоциации субъединиц в олигомерном ферменте). (рис.10) Например, фермент протеинкиназа в неактивной форме построена как тетрамер R2C2 (R и С - разные субъединицы). Активная протеинкиназа представляет собой субъединицу С, для освобождения которой необходима диссоциация комплекса. Активация фермента происходит при участии цAMP, который способен присоединиться к субъединице R, после чего изменяется конформация, комплементарность субъединиц R и С и происходит диссоциация комплекса: R2C2 + 2cАМР 2С + 2(R -цАМР) Протеинкиназа фосфорилирует соответствующие ферменты, изменяет их активность и, следовательно, скорость метаболизма в клетке. Активация ферментов путем частичного протеолиза. Некоторые ферменты синтезируются первоначально неактивными и лишь после секреции из клетки переходят в активную форму. Неактивный предшественник называется проферментом. Активация профермента включает модификацию первичной структуры с одновременным изменением конформации. Например, трипсиноген, синтезированный в поджелудочной железе, затем в кишечнике превращается в трипсин путем удаления фрагмента с N-конца гексапептида. Расщепление определенных пептидных связей «запускает» новые взаимодействия R-групп по всей молекуле, приводя к новой конформации, в которой R-группы активного центра занимают оптимальное положение для катализа (рис.10). |