ФЕРМЕНТЫ. Учебное пособие введение
 Скачать 2.87 Mb. Скачать 2.87 Mb.
|
4. МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВПо образному выражению, нередко употребляемому в биохимической литературе, фермент подходит к субстрату, как ключ к замку. Это знаменитое правило было сформулировано Э. Фишером в 1894 г. исходя из того, что специфичность действия фермента предопределяется строгим соответствием геометрической структуры субстрата и активного центра фермента. В 50-е годы нашего столетия это статическое представление было заменено гипотезой Д. Кошланда об индуцированном соответствии субстрата и фермента. Сущность ее сводится к тому, что пространственное соответствие структуры субстрата и активного центра фермента создается в момент их взаимодействия друг с другом, что может быть выражено формулой “перчатка - рука”. При этом в субстрате уже деформируются некоторые валентные связи и он, таким образом, подготавливается к дальнейшему каталитическому видоизменению, а в молекуле фермента происходят конформационные перестройки.
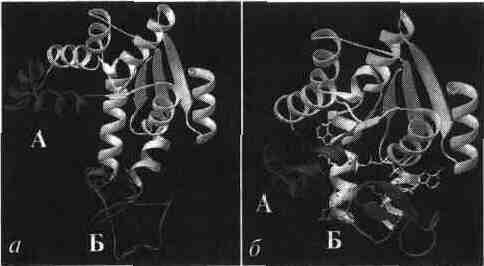
Рис. 5 Конформационные изменения в аденилаткиназе при связывании синтетического аналога субстратов. а — пространственная структура аденилаткиназы; б— аденилатциклаза, связанная с синтетическим аналогом субстратов. В настоящее время гипотеза Кошланда получила дальнейшее развитие в гипотезу топохимического соответствия. Сохраняя основные положения гипотезы взаимоиндуцированной настройки субстрата и фермента, она фиксирует внимание на том, что специфичность действия ферментов объясняется в первую очередь узнаванием той части субстрата, которая не изменяется при катализе. Между этой частью субстрата и субстратным центром фермента возникают многочисленные точечные гидрофобные взаимодействия и водородные связи. ОСНОВНЫЕ ЭТАПЫ ФЕРМЕНТАТИВНОГО КАТАЛИЗА Любая ферментативная реакция протекает через ряд промежуточных стадий. Различают три основных этапа ферментативного катализа: 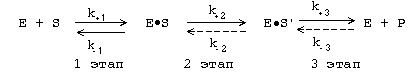 1 этап. ОРИЕНТИРОВАННАЯ СОРБЦИЯ СУБСТРАТА НА АКТИВНОМ ЦЕНТРЕ ФЕРМЕНТА С ОБРАЗОВАНИЕМ ОБРАТИМОГО E-S КОМПЛЕКСА (ФЕРМЕНТ-СУБСТРАТНОГО). На этом этапе происходит взаимодействие адсорбционного центра фермента с молекулой субстрата. При этом и субстрат подвергается конформационной перестройке. Все это происходит за счет возникновения слабых типов связей между субстратом и адсорбционным центром фермента. В результате этого молекула субстрата подается на каталитический центр в наиболее удобном для него положении. Этот этап является легко обратимым, потому что здесь участвуют только слабые типы связей. 2 этап. ХИМИЧЕСКИЕ ПРЕВРАЩЕНИЯ МОЛЕКУЛЫ СУБСТРАТА В СОСТАВЕ ФЕРМЕНТ-СУБСТРАТНОГО КОМПЛЕКСА С ОБРАЗОВАНИЕМ КОМПЛЕКСА ФЕРМЕНТА С ХИМИЧЕСКИ ПРЕОБРАЗОВАННЫМ СУБСТРАТОМ. На этом этапе разрываются одни ковалентные связи и возникают новые. Поэтому этот этап протекает значительно медленнее, чем 1-й и 3-й этапы. Именно скорость второго этапа определяет скорость всей ферментативной реакции в целом. 3 этап. ДЕСОРБЦИЯ ГОТОВОГО ПРОДУКТА ИЗ ЕГО КОМПЛЕКСА С ФЕРМЕНТОМ. В результате образования продукта, комплементарность снижается (или исчезает), а после диссоциации продукта фермент возвращается в исходное состояние. Он, как и 2-й этап, тоже необратим. Исключение - обратимые ферментативные реакции. В общем виде ход ферментативного катализа представлен ниже, где ES* — комплекс между ферментом и субстратом в переходном состоянии, ЕР - комплекс фермента и продукта: Е + S Е S ES* ЕР Е+Р. Энергетический профиль реакции представлен на рисунке 6. 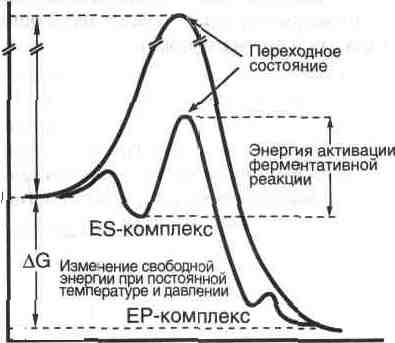 Рис. 6 Активность ферментов – способность в разной степени ускорять скорость реакции. Кинетика ферментативных реакций 1. ЗАВИСИМОСТЬ СКОРОСТИ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ ФЕРМЕНТА ([E]) при постоянной и довольно большой концентрации субстрата ([S]>>[E], [S]=const) имеет такой вид: 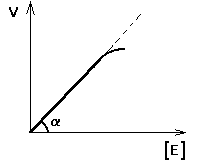 Отклонение от линейности графика при очень высокой концентрации фермента возникает из-за нехватки субстрата, поэтому снижается скорость поступления субстрата на активный центр фермента. Определять скорость ферментативной реакции надо только в том диапазоне концентраций фермента, в котором график линеен. Линейность этого графика позволяет выразить его одной цифрой - тангенс угла наклона к оси абсцисс. Этот тангенс представляет собой величину активности фермента. Именно работа (эффективность) каждого фермента количественно характеризуется величиной его активности, то есть величиной скорости ферментативной реакции в расчете на единицу количества фермента. Единицы активности могут быть различными: мкмоль S/мин.мг или мкмоль S/мин.мл сыворотки крови. МОЛЕКУЛЯРНАЯ АКТИВНОСТЬ - это количество молекул субстрата, которые превращаются одной молекулой фермента за одну минуту при 30оС и прочих оптимальных условиях. Преимущество этой единицы - в том, что можно сравнивать не только активность ферментов из разных источников, но и эффективность разных ферментов. Например, молекулярная активность фермента каталазы составляет 5*106, а карбоангидразы - 36*106. Из линейности графика следует, что по скорости реакции можно судить о количестве фермента. КАТАЛ - это количество фермента, которое обеспечивает превращение 1 моля субстрата за 1 секунду. ЮНИТ - это количество фермента, которое превращает 1 мкмоль субстрата за 1 минуту. 1 Юнит = 16,67 нкатал ЗАВИСИМОСТЬ СКОРОСТИ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ СУБСТРАТА ПРИ [E] = const и [S] >> [E]. Чем выше концентрация субстрата, тем выше скорость реакции. Эта зависимость гиперболическая. 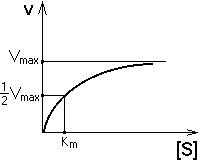 Предельное значение, к которому стремится гипербола - Vmax данной реакции - характеризует максимальную работоспособность фермента: Vmax=k+2.[E] Таким образом, Vmax - это предел, к которому стремится скорость реакции при бесконечном повышении концентрации субстрата. Км - это КОНСТАНТА МИХАЭЛИСА. Она численно равна той концентрации субстрата, при которой скорость реакции составляет половину от максимального значения. Эта кривая описывается уравнением Михаэлиса-Ментен: ФИЗИЧЕСКИЙ СМЫСЛ Км заключается в том, что она представляет собой константу равновесия между двумя реакциями, приводящими к распаду фермент-субстратного комплекса и той реакцией, которая ведет к образованию этого комплекса. 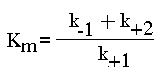 Поскольку значение k+2 всегда намного ниже, чем k-1, то 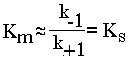 Ks - субстратная константа. Характеризует константу равновесия 1-го этапа ферментативной реакции. Следовательно, Км обычно тоже довольно близка к Кs. Следовательно, Км, как и Кs, характеризует сродство субстрата к данному ферменту. Но экспериментально определить k-1 и k+2 очень трудно, поэтому трудно определить и Кs. С помощью Км можно характеризовать сродство данного фермента к данному субстрату. Чем меньше Км, тем больше сродство фермента к данному субстрату, а значит тем больше равновесие первого этапа ферментативной реакции сдвинуто вправо - в сторону образования фермент-субстратного комплекса. Значит, будут созданы наилучшие условия для протекания и второго этапа ферментативного процесса. При таких условиях для достижения эффективного превращения субстрата требуется малая концентрация субстрата. Значит, и Vmax теоретически может быть достигнута при малых количествах субстрата. Если Км высока, то это означает, что сродство фермента к такому субстрату низкое и реакция при небольших концентрациях субстрата протекает неэффективно. |