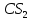Вариант
|
Уравнение реакции
|
Т1
|
Т2
|
Т3
|
Ра
|
42
|
2CS = C(s) + CS2
|
1600
|
2600
|
2500
|
0,5
|
Расчет 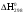 , , 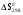 , СР (a, b, c) химической реакции по таблицам стандартных термодинамических величин: , СР (a, b, c) химической реакции по таблицам стандартных термодинамических величин:
|
H°(298)
|
S°(298)
|
a
|
b
|
c
|
CS
|
|
210,45
|
49,76
|
0,00204
|
|
CS2
|
116700
|
237,77
|
52,09
|
0,00669
|
|
C(s)
|
|
5,74
|
16,86
|
0,00477
|
|
Δa
|
Δb
|
Δc
|
ΔH°(298)
|
ΔS°(298)
|
1,55
|
0,00738
|
-693000
|
-442860
|
-177,39
|
Cp = Δa + Δb * T + Δc * T^(-2)
|
Cp(298)
|
-4,05
|
|
Результаты приближенного расчета термодинамических функций 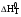 , , 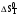 , , 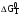 и ln(KP) в интервале температур Т1 Т2 при следующих приближениях: и ln(KP) в интервале температур Т1 Т2 при следующих приближениях:
T
|
Значение
|
T1
|
1600
|
T2
|
1700
|
T3
|
1800
|
T4
|
1900
|
T5
|
2000
|
T6
|
2100
|
T7
|
2200
|
T8
|
2300
|
T9
|
2400
|
T10
|
2500
|
T11
|
2600
|
а) При Ср=0
При Ср=0
|
H(T)
|
S(T)
|
G(T)=H(T)-TS(T)
|
Ln(Kp)=G(T)/(R*T)
|
-442850
|
-117,39
|
-159036
|
11,96
|
-141297
|
10,00
|
-123558
|
8,26
|
-105819
|
6,70
|
-88080
|
5,30
|
-70341
|
4,03
|
-52602
|
2,88
|
-34863
|
1,82
|
-17124
|
0,86
|
615
|
-0,03
|
18354
|
-0,85
|
б) При Ср=Ср(298)=const
При Ср=Ср(298)=const
|
H(T)=dH(298)+Cp*(T-298)
|
S(T)=dS(298)+Cp*ln(T/298)
|
G(T)=H(T)-TS(T)
|
Ln(Kp)=G(T)/(R*T)
|
-448139
|
-184,20
|
-153412
|
11,54
|
-448544
|
-184,45
|
-134979
|
9,55
|
-448950
|
-184,68
|
-116523
|
7,79
|
-449355
|
-184,90
|
-98043
|
6,21
|
-449761
|
-185,11
|
-79543
|
4,79
|
-450166
|
-185,31
|
-61022
|
3,50
|
-450572
|
-185,50
|
-42482
|
2,32
|
-450977
|
-185,68
|
-23923
|
1,25
|
-451382
|
-185,85
|
-5347
|
0,27
|
-451788
|
-186,01
|
13246
|
-0,64
|
-452193
|
-186,17
|
31856
|
-1,47
|
Результаты точных расчетов в интервале температур Т1 Т2:
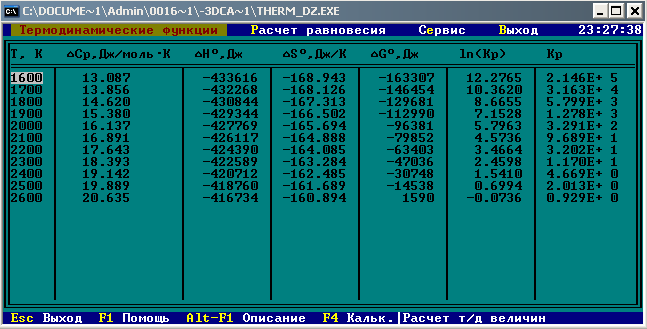
Графики температурной зависимости термодинамических функций СР, 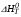 , , 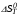 , , 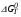 и ln KP для всех вариантов расчета: и ln KP для всех вариантов расчета:
Результаты расчета равновесных составов: числа молей, мольные доли, мольные и массовые проценты, при заданных Т3 и Р для случаев, когда реагируют стехиометрические смеси:
а) исходных веществ
-
Реакция
|
2CS
|
=C(s)
|
+ CS2
|
Кол-во молей до:
|
2
|
-
|
0
|
Кол-во молей после:
|
2-2z
|
-
|
z
|
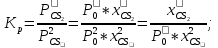
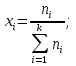
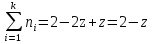
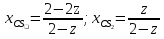
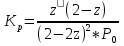
Z=0,5554
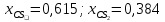
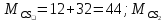 =12+32*2=76 =12+32*2=76
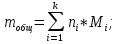
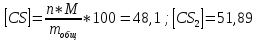
Равновесный состав:
|
SO2
|
O2
|
Количество молей
|
0,8892
|
0,5554
|
Мольная доля
|
0,615
|
0,384
|
Мольный процент
|
61,5%
|
38,4%
|
Массовый процент
|
48,1%
|
51,89%
|
б) всех веществ
-
Реакция
|
2CS
|
=C(s)
|
+ CS2
|
Кол-во молей до:
|
2
|
-
|
1
|
Кол-во молей после:
|
2-2z
|
-
|
1+z
|
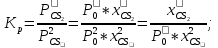
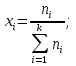
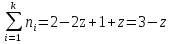
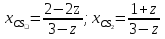
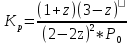
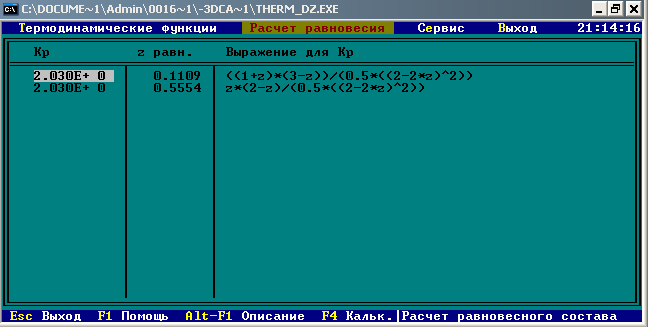
Z=0,1109
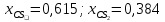
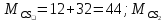 =12+32*2=76 =12+32*2=76
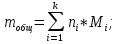
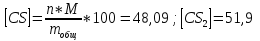
Равновесный состав:
|
CS
|
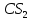
|
Количество молей
|
1,7782
|
1,1109
|
Мольная доля
|
0,615
|
0,384
|
Мольный процент
|
61,5%
|
38,4%
|
Массовый процент
|
48,09%
|
51,9%
|
Исследование вопроса о направление реакции при температуре Т3 и Р, если в исходный момент времени взято по одному молю каждого исходного вещества и по два моля продукта реакции:
Реакция
|
2CS
|
=C(s)
|
+ CS2
|
Кол-во молей до:
|
1
|
-
|
2
|
Nобщ=3
|
xi
|
1/3
|
-
|
2/3
|
Pi
|
P*1/3
|
-
|
P*2/3
|
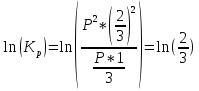
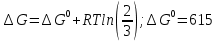
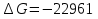
Так как 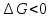 то реакция идет слева направо, в сторону получения продуктов реакции. то реакция идет слева направо, в сторону получения продуктов реакции.
Зависимость от Температуры:
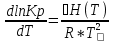
ΔH°=-442860
При увеличении Т равновесие двигается влево, выход реакции падает
Зависимость от давления:
Так как 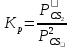 , Δn=-1, то при увеличении давления реакция сдвигается в сторону исходных веществ (влево). , Δn=-1, то при увеличении давления реакция сдвигается в сторону исходных веществ (влево).
8)
2CS = C(s) + CS2
1 -418760
Z X
Z=0,5554
X=0,5554*(-418760)=-232579
⧋H=-23257
b) 1 -418760
1-Z X
Z=0,1109
X=(1-0,1109)(-418760)=-372319
⧋H=-372319
9)
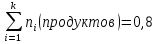
-
Реакция
|
2CS
|
=C(s)
|
+ CS2
|
Кол-во молей до:
|
2
|
-
|
0
|
Кол-во молей после:
|
2-2z
|
-
|
z
|
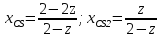
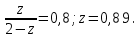
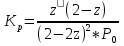
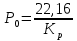
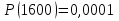 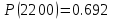
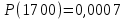 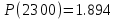
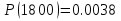 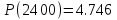
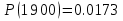 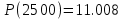
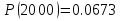 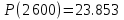
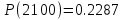
Домашняя работа по
Химической термодинамике
Выполнил: студент группы
МПП-11-1 / П4-11-2
Яловенко Дмитрий
|
 Скачать 93.34 Kb.
Скачать 93.34 Kb.
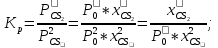
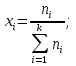
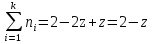
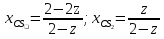
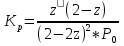
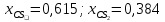
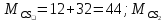 =12+32*2=76
=12+32*2=76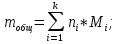
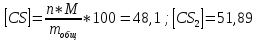
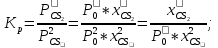
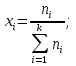
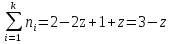
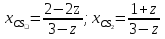
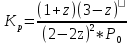
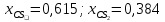
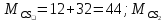 =12+32*2=76
=12+32*2=76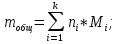
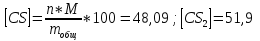

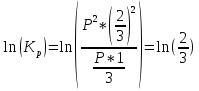
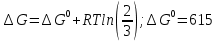
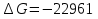
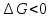 то реакция идет слева направо, в сторону получения продуктов реакции.
то реакция идет слева направо, в сторону получения продуктов реакции.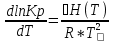
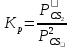 , Δn=-1, то при увеличении давления реакция сдвигается в сторону исходных веществ (влево).
, Δn=-1, то при увеличении давления реакция сдвигается в сторону исходных веществ (влево).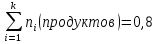
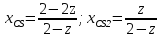
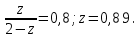
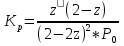
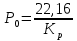
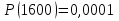
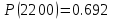
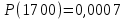
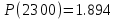
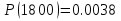
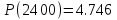
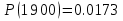
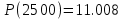
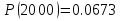
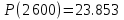
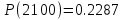

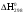 ,
, 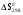 , СР (a, b, c) химической реакции по таблицам стандартных термодинамических величин:
, СР (a, b, c) химической реакции по таблицам стандартных термодинамических величин: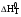 ,
, 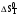 ,
, 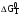 и ln(KP) в интервале температур Т1 Т2 при следующих приближениях:
и ln(KP) в интервале температур Т1 Т2 при следующих приближениях: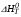 ,
, 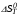 ,
, 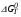 и ln KP для всех вариантов расчета:
и ln KP для всех вариантов расчета: