химия. Урок Воздух и его состав
 Скачать 17.85 Kb. Скачать 17.85 Kb.
|
|
8Урок «Воздух и его состав» Ход урока История открытия. В 1774 г. англ. учёный Джозеф Пристли открыл самый распространённый на Земле элемент- кислород. Пристли открыл важнейшие свойства кислорода. Загадка воздуха была на пороге открытия. Но Пристли был в плену у теории флогистона. Это была неверная теория химика Шталя (1659-1734),который считал, что существует воображаемое вещество флогистон, являющееся составной частью всех горючих тел. В процессе горения вещества теряют флогистон. При горении флогистон проявляется в виде огня. С помощью этой теории неверно объяснялся процесс горения веществ. В 1774-1777 г.г. франц. учёный Антуан Лоран Лавуазье провёл опыты, положившие начало опровержению теории флогистона. В одном из опытов Лавуазье поместил в герметически закрытый стеклянный сосуд олово и нагрел его с помощью большой линзы. Олово превратилось в порошок оксида, что сопровождалось увеличением массы, однако общий вес сосуда остался неизменным, и это означало, что никакой огонь извне внутрь не проникал, а к металлу присоединилась какая-то часть воздуха. Самый важный вклад Лавуазье в науку – опровержение господствовавшей многие десятилетия теории флогистона и создание теории горения, основанной на опытных данных. Кислородная теория горения стала стала толчком первой химической революции. А самое первоначальное открытие кислорода принадлежит китайскому учёному VIII| в. Мао – Хоа, который за 1000 лет до Лавуазье, установил, что в состав воздуха входит газ, поддерживающий горение и дыхание. Детальное изучение состава воздуха позволило прийти к выводу, что он представляет собой многокомпонентную смесь, состоящую из: Кислород – 21 % Азот – 78 % Благородные газы (Ar и др.) – 0,94 % В конце XIX века ученым удалось уточнить состав воздуха. Кроме азота и кислорода в состав входят: Благородные газы (инертные газы, редкие газы), хим. элементы VIII гр. периодич. системы: гелий (Не), неон (Ne), аргон (Аr), криптон (Кr), ксенон (Хе), радон (Rn). кислорода, в состав воздуха входят благородные (инертные) газы. Кроме того, в воздухе содержатся углекислый газ – оксид углерода(IV) и водяные пары, процентное содержание которых зависит от местных условий (например, морской воздух очень влажный). Углекислый газ, оксид углерода (IV) – 0,03 % Водяные пары – до 3 % Таким образом, воздух – это смесь газов. Физические свойства. Воздух – смесь газов, без запаха, без цвета, прозрачен, немного растворим в воде, имеет малую плотность. При нагревании воздух расширяется, при охлаждении – сжимается. Теплопроводен. Химические свойства. При горении простых и сложных веществ образуются оксиды. 4Р + 5O2 5Р2O5 2Mg + O2 2MgO S + O2 SO2 Количественно состав газовой смеси выражают с помощью объёмных долей компонента газовой смеси (обозначаются греческой буквой φ –«фи»). Объёмной долей компонента газовой смеси называют отношение объема данного газа к общему объёму смеси. 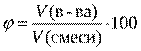 где, где,φ (газа) – объёмная доля газа в смеси. V (газа) – объём газа (л, мл, м3). V (смеси) – объём смеси (л, мл, м3). Объёмная доля компонента газовой смеси показывает, какую часть общего объёма смеси занимает данный компонент. Задачи. 1.При перегонке 100 л жидкого воздуха было получено 76 л азота, 23 л кислорода, 700 мл аргона и 180 мл углекислого газа. Найдите объёмную долю каждого компонента воздуха. 2.Вычислите объемную долю азота в смеси газов, содержащей 32 л азота, 48 л углекислого газа, 36 л гелия и 14 л водорода. (Ответ: 𝜑 (N2) = 24,6 %). 3.Вычислите объём углекислого газа, который можно получить из 650 м3 воздуха. (Ответ: 0,19 м3). 4.Учитывая, что объёмная доля аргона во воздухе 0,9% найдите объём воздуха, который необходим для получения 7 л аргона. (Ответ: 777,8 л). 5.Сосуд заполнили 25 мл кислорода и 125 мл азота. Вычислите объемные доли кислорода и азота в этой смеси. (Ответ: 𝜑 (O2) = 16,7%; 𝜑 (N2) = 83,3%). 6.Анализ атмосферы Венеры показал, что в 50 мл венерианского «воздуха» содержится 48,5 мл углекислого газа и 1,5 мл азота. Рассчитайте объемные доли газов в атмосфере планеты. (Ответ: 𝜑 (СО2) = 97%; 𝜑 (N2) = 3%). |
