Условное обозначение реакции
 Скачать 17.01 Kb. Скачать 17.01 Kb.
|
|
Каждому из студентов необходимо составить в экселе форму для расчета термодинамической вероятности протекания 1 химической реакции с учетом всех фазовых переходов и сопутствующих тепловых эффектов (максимум за выполнение – 5 баллов). Для реакции необходимо предусмотреть 5 реагентов и 10 продуктов реакции. Для каждого из реагентов и продуктов необходимо предусмотреть возможность претерпевания до 7 кристаллических фазовых переходов (изменение аллотропных форм), а также плавление и кипение со всеми сопутствующими тепловыми эффектами. Условное обозначение реакции: αA + βB + γC + δD + εE → ωZ + ψY + χX + φW + υV + τU + σT + ρS + πQ + ξP Формула для расчета энергии Гиббса реакции: ΔrGT = ΔrHT – T∙ΔrST Энтропия реакции: ΔrST = Σ νi∙ΔST(продукты) – Σ νi∙ΔST(реагенты), где νi – стехиометрические коэффициенты перед компонентом реакции Энтропия каждого из компонентов реакции: ΔST = ΔS298 + 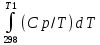 + Δф.п.1H/Тф.п.1 + + Δф.п.1H/Тф.п.1 + 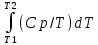 + Δф.п.2H/Тф.п.2 + + Δф.п.2H/Тф.п.2 + 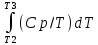 + Δф.п.3H/Т ф.п.3 + … + + Δф.п.3H/Т ф.п.3 + … + 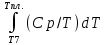 + Δпл.H/Тпл. + + Δпл.H/Тпл. + 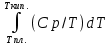 + Δкип.H/Ткип. + Δкип.H/Ткип.Энтальпия реакции: ΔrHT = Σ νi∙ΔfHT(продукты) – Σ νi∙ΔfHT(реагенты) Энтальпия каждого из компонентов реакции: ΔfHT = ΔfH298 + 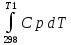 + Δф.п.1H + + Δф.п.1H + 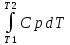 + Δф.п.2H + + Δф.п.2H + 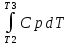 + Δф.п.3H + … + + Δф.п.3H + … + 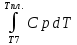 + Δпл.H + + Δпл.H + 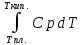 + Δкип.H + Δкип.HИспользовать уравнение изобарной теплоемкости в следующей форме: Cp = a + b∙10-3∙T + c∙105∙T-2 + d∙10-6∙T2 + e∙107∙T-3+ f∙10-9∙T3 + g∙10∙T-0.5 + h∙103∙T-1 + ln(T). Предусмотреть ввод всех необходимых данных (значение коэффициентов уравнения теплоемкости, стандартные значения энтальпий, энтропий, энтальпий фазового перехода) в компактной и удобной для восприятия и ввода форме. Размещение коэффициентов в уравнении химической реакции предусмотреть в отдельной, рядом стоящей с формулой вещества ячейке. В качестве выходных данных должна отображаться температура рассматриваемой реакции и значение энергии Гиббса при данной температуре. Количество рассматриваемых одновременно температур – не менее 10. |
