установка жидких газов. Вариант 3 28
 Скачать 48.81 Kb. Скачать 48.81 Kb.
|
|
Вариант 3 № 28 III. Определите концентрацию раствора (в соответствии с номером задачи) в указанных единицах по приведенным в таблице 3 данным (раствор «а» – стандартный, раствор «б» – исследуемый). Таблица 3
Решение: Сст(Sb2+) = m(Sb)/(V(р-ра)∙1000) = 2,56/(50∙1000) = 0,0000512 г/мл Сх(Sb2+) = (Сст(Sb2+)∙Ах∙lст)/(Аст∙lх) = (0,0000512∙0,127∙0,5)/(0,085∙2,5) = 1,53∙10-5 г/мл W(Sb2О3) = (Сх(Sb2+)∙V(р-ра)∙М(Sb2О3)∙100)/(m(навески)∙М(Sb)) = (1,53∙10-5∙100∙291,52∙100)/(0,5∙121,75) = 0,733 %. Ответ: W(Sb2О3) = . № 48 VI. Из навески стали массой 0,2 г после соответствующей обработки приготовили 100,0 мл раствора, содержащего MnO4‾ и Cr2O72–, и измерили его оптическую плотность при светофильтрах с λэфф = 533 нм и λэфф = 432 нм (А533, А432). В шесть мерных колб вместимостью 100,0 мл поместили 5,00; 8,00; 10,00 мл стандартного раствора перманганата [Т(Mn) = 0,0001090] или дихромата [Т(Cr) = 0,001210], разбавили водой до метки и фотометрировали при тех же условиях, при фотометрировании получены следующие данные – таблица 6. Таблица 6
Определите массовую долю (%) марганца и хрома в стали, если при фотометрировании исследуемого раствора получена оптическая плотность представленная (в соответствии с номером задачи) в таблице 7. Таблица 7
Решение: Строим калибровочный график для λ = 533 нм и рассчитываем концентрацию марганца в стали: 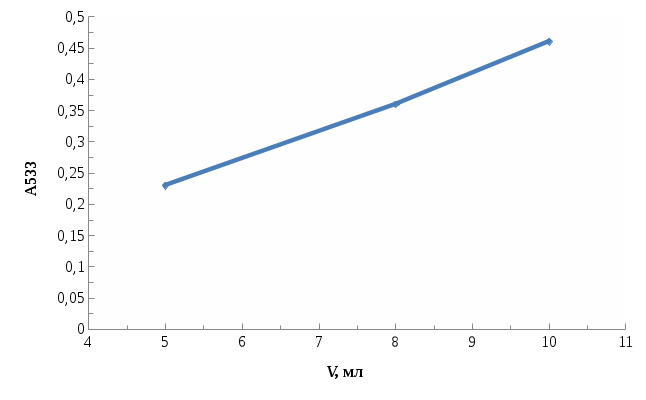  Согласно графика V1(р-ра) = 8,2 мл W(Mn) = (T(Mn)∙V1(р-ра)∙100)/m(стали) = (0,000109∙8,2∙100)/0,2 = 0,45 % Строим калибровочный график для λ = 432 нм и рассчитываем концентрацию хрома в стали:   Согласно графика V2(р-ра) = 9,2 мл W(Cr) = (T(Cr)∙V2(р-ра)∙100)/m(стали) = (0,00121∙9,2∙100)/0,2 = 5,57 % Ответ: W(Mn) = 0,45 %; W(Cr) = 5,57 %. № 56 IX. При определении NaCl в растворе гидроксида натрия приготовили серию стандартных растворов. Для этого V (мл) раствора NaCl (TNaCl= 0,1000 г/мл) перенесли в мерные колбы вместимостью 25,0 мл, добавили реактивы, необходимые для получения суспензии AgCl, измерили кажущиеся оптические плотности с помощью нефелометра и получили следующие данные – таблица 12. Таблица 12
Навеску анализируемого раствора массой 21,74 г нейтрализовали HNO3, перенесли в мерную колбу и приготовили 50,0 мл раствора, VA (мл) которого использовали для приготовления 25,0 мл суспензии AgCl. Определите массовую долю (%) NaClпо следующим данным – таблица 13 (в соответствии с номером задачи). Таблица 13
Решение: Строим калибровочный график и рассчитываем концентрацию NaCl:   Согласно графика V(р-ра) = 1,06 мл W(NaCl) = (T(NaCl)∙V(р-ра)∙V(колбы)∙100)/(m(стали)∙V(аликвоты)) = (0,1∙1,06∙50∙100)/(21,74∙5) = 4,88 % Ответ: W(NaCl) = 4,88 %. № 66 XII. Для определения содержания примеси свинца в металлическом алюминии навеску последней массой m г растворили, перенесли в мерную колбу объемом 50 мл и довели водой до метки. При снятии полярограммы полученного раствора высота волны оказалась равной hX. При полярографировании стандартных растворов свинца получили следующие результаты – таблица 18. Таблица 18
Постройте калибровочный график и определите процентное содержание свинца в анализируемом образце для следующих номеров задач – таблица 19. Таблица 19
Решение: Строим калибровочный график и рассчитываем концентрацию свинца: 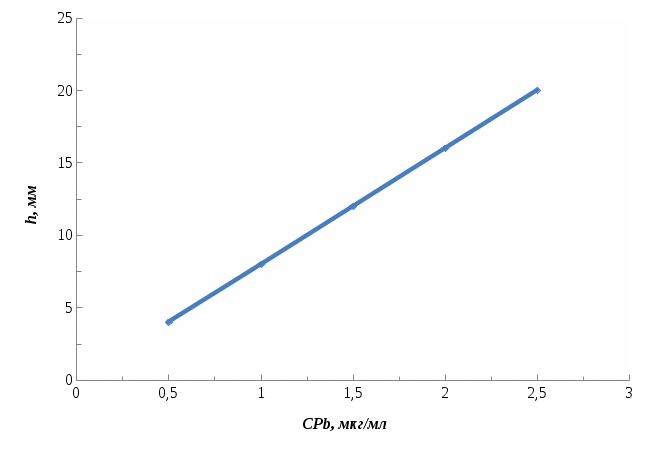  Согласно графику CхPb = 1,12 мкг/мл W(Pb) = (CхPb∙10-6∙V(колбы)∙100)/m(навески) = (1,12∙10-6∙50∙100)/5,134 = 0,0011 % Ответ: W(Pb) = 0,0011 %. № 105 Анализируемый раствор метиламина CH3NH2 объемом 20,00 мл разбавили в мерной колбе до 100,0 мл, затем 10,00 мл полученного раствора оттитровали потенциометрически 0,1000Н раствором HCl. Определите концентрацию (моль/л) исходного раствора метиламина по следующим данным – таблица 41. Таблица 41
Решение: Для построения дифференциальной кривой титрования необходимо рассчитать значения ∆рН/∆V:
Строим дифференциальную кривую титрования в координатах ∆рН/∆V = f(V):  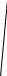   Согласно кривой VT = 18,2 мл C(CH3NH2) = (C(HCl)∙VT∙V(колбы))/(V(CH3NH2)∙V(аликвоты)) = (0,1∙18,2∙100)/(20∙10) = 0,91 моль/л Ответ: C(CH3NH2) = 0,91 моль/л. № 107 Определите процентное содержание индифферентных примесей в образце медного купороса, если после растворения его навески 0,4556 г CuSO4·5H2O в азотной кислоте и электролиза полученного раствора выделено на платиновом катоде 0,1145 г меди. Решение: m(CuSO4·5H2O) = (m(Cu)∙М(CuSO4·5H2O))/М(Cu) = (0,1145∙249,684)/63,55 = 0,4499 г W(прим.) = (m(навески) – m(CuSO4·5H2O))∙100/m(навески) = (0,4556 – 0,4499)∙100/0,4556 = 1,25 % Ответ: W(прим.) = 1,25 %. № 130 XXI. Рассчитайте массовую долю (%) компонентов смеси по следующим данным, полученным методом газовой хроматографии (в соответствии с номером задачи) – таблица 42. Таблица 42
Решение: 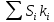 = 216∙1,13 + 312∙1,11 = 590,4 = 216∙1,13 + 312∙1,11 = 590,4Рассчитаем процентный состав газовой смеси: W(пропан) = S(пропан)∙k(пропан)∙100/ 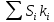 = 216∙1,13∙100/590,4 = 41,34 % = 216∙1,13∙100/590,4 = 41,34 %W(бутан) = S(бутан)∙k(бутан)∙100/ 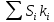 = 312∙1,11∙100/590,4 = 58,66 % = 312∙1,11∙100/590,4 = 58,66 %Ответ: W(пропан) = 41,34 %; W(бутан) = 58,66 %. № 140 XXIII. Для хроматографического определения никеля на бумаге, пропитанной раствором диметилглиоксима, приготовили три стандартных раствора. Навеску NiCl2·6H2O массой m (г) растворили в мерной колбе вместимостью 50,0 мл. Для построения градуировочного графика 5,00; 10,00 и 20,00 мл полученного раствора разбавили водой до 50,0 мл. Анализируемый раствор, содержащий никель, также разбавили водой до 50,0 мл и измерили высоту пиков, образовавшихся при хроматографировании – таблица 44 (в соответствии с номером задачи). Определите массу (мг) никеля в исследуемом растворе. Таблица 44
Решение: M(NiCl2·6H2O) = 237,69 г/моль M(Ni) = 58,69 г/моль m1(Ni) = (m(NiCl2·6H2O)∙V1(аликвоты)∙M(Ni)∙1000)/(M(NiCl2·6H2O)∙V(колбы)) = (0,22∙5∙58,69∙1000)/(237,69∙50) = 5,43 мг m2(Ni) = (0,22∙10∙58,69∙1000)/(237,69∙50) = 10,86 мг m3(Ni) = (0,22∙20∙58,69∙1000)/(237,69∙50) = 21,72 мг Строим калибровочный график h – f(m(Ni)):   Согласно графика mх(Ni) = 15,01 мг Ответ: mх(Ni) = 15,01 мг. № 148 XXIV. Какая масса кобальта останется в растворе, если через колонку, заполненную m (г) катионита, пропустили V(мл) раствора CoSO4 с концентрацией CНАЧ. Полная динамическая емкость в условиях разделения равна 3,2 мэкв/г (фактор эквивалентности – ½). Получили следующие данные (в соответствии с номером задачи) – таблица 45. Таблица 45
Решение: νнач.(Co2+) = Снач∙V = 0,1∙0,5 = 0,05 моль = 0,1 моль-экв. νсорб.(Co2+) = ПДОЕ∙m(катионита) = 3,2∙10-3∙10 = 0,032 моль-экв. νост.(Co2+) = νнач.(Co2+) – νсорб.(Co2+) = 0,1 – 0,032 = 0,068 моль-экв. Мэкв.(Со) = М(Со)/2 = 58,93/2 = 29,465 г-экв./моль m(Со) = Мэкв.(Со)∙νост.(Co2+) = 29,465∙0,068 = 2,0036 г Ответ: m(Со) = 2,0036 г. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
