Задание по Аналитической химии. Задание 1. Титриметрический метод анализа. Вариант 6 1 Сущность метода обратного титрования. Примеры. Расчеты
 Скачать 152.6 Kb. Скачать 152.6 Kb.
|
|
Вариант 6 1 Сущность метода обратного титрования. Примеры. Расчеты.. Если по каким-либо причинам прямое титрование невозможно, то в данном случаи применяют метод обратного титрования или титрование по остатку. Этот прием состоит в том, что к определенному объему раствора определяемого компонента приливают точно измеренный, объем стандартного раствора, взятый в избытке. Избыток не вошедшего в реакцию стандартного раствора оттитровывают стандартным раствором - титрантом. Например, для определения содержания CaO к определенному объему анализируемого раствора приливают точно отмеренное количество стандартизованного раствора HCl, взятого с избытком, а затем непрореагировавший остаток HСl оттитровывают раствором NaOH известной концентрации. Зная объем титранта, израсходованный на реакцию с определяемым компонентом CaO, можно вычислить содержание вещества. При определении содержания CaO в образце мела навеску в 0,1500 г обработали 50,00 мл 0,0999 М HCI, остаток кислоты оттитровали 10,00 мл NaOH (k =1,01). Вычислить массовую долю CaO в образце мела. Решение: CaO + изб. 2HCI = CaCI2 +H2O +ост. HCI ост. HCI + NaOH = NaCl + H2O Из условия задачи видно, что определение CaO проводилось методом обратного титрования. 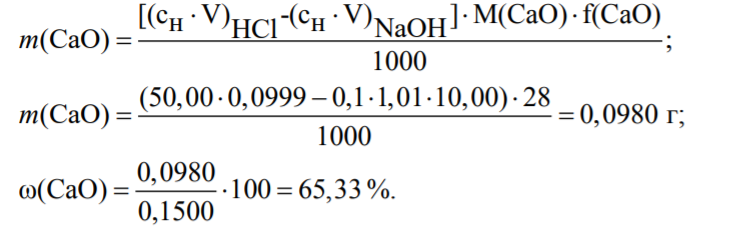 2 Какой объем 10%-й H2SO4 потребуется для нейтрализации раствора, содержащего 16 г NaOH? Дано: ω (H2SO4) =10% m (NaOH) = 16 г Найти V(H2SO4) =? Решение: H2SO4 + 2 NaOH => Na2SO4 + 2H2O; Определим малярные массы для дальнейшего определения количество гидроксида натрия: M (NaOH) = 23+16+1 = 40 г/моль; M (H2SO4) = (1·2) +32+(16·4) =98 г/моль; Зная малярную массу веществ, найдем количество вещества: n(NaOH) = m (NaOH) / M (NaOH) = 16,0 / 40 = 0,4 моль; n(H2SO4) = n (NaOH) / 2 = 0,4 / 2 = 0,2 моль; Определим массу серной кислоты m(H2SO4) = n (H2SO4) · M (H2SO4) = 0,2 · 98 = 19,6 г; 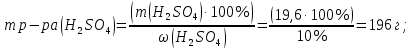 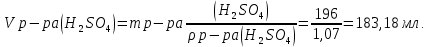 Ответ: Объем раствора H2SO4 составляет 183,18 мл 3 Навеску соли аммония, массой 1,0000 г, обработали раствором NaOH. Выделившийся аммиак поглотили 50,00 см3 1,072 М раствора HCl. Избыток кислоты оттитровали 25,40 см3 раствора NaOH с титром, равным 0,00412 г/мл. Вычислить массовую долю (%) аммиака в образце. Дано: m (NH4(+)) = 1 г V(HCl) = 0,05 м3 См(HCl) =1,072 М V(HCl) = 0,02540 м3 T(NaOH) = 0,004120 Найти: ω (NH3) -? Решение: NH4(+) + NaOH = NH3↑ + Na(+) + H2O NH3 + HCl = NH4Cl NaOH + HCl = NaCl + H2O Определим количество соляной кислоты n(HCl) = См · V = 1,072 · 0,05 = 0,0536 моль См (NaOH) = (1000 · T) / M = (1000 · 0,004120) / 40 = 0,103 моль/л n (NaOH) = См · V = 0,103 · 0,02540 = 0,0026162 моль Зная количество соляной кислоты и гидроксида натрия, определим количество образовавшегося аммиака n (NH3) = n(HCl) - n(NaOH) = 0,0536 - 0,0026162 = 0,0509838 моль Определив количество, найдем массу m(NH3) = n · M = 0,0509838 · 17 = 0,8667 = 86,67% 4 Какую навеску карбоната натрия для стандартизации соляной кислоты необходимо взять, чтобы приготовить 250 см3 0,1000 М раствора Дано: V(р-ра Na2CO3 )= 250 мл = 0.25 л Сэкв(Na2CО3)= 0.1000 Найти: m(Na2CO3)- ? Решение: Определим химическое количество эквивалентов карбоната натрия nэкв(Na2CO3 ) = V(р-ра Na2CO3 ) ·Сэкв(Na2CО3) =0,25·0,1000 = 0,025 моль m(Na2CO3)= nэкв(Na2CO3 ) · M(Na2CО3) определим малярную массу: M(Na2CО3) = (23·2)+12+(16·3)=106 г/моль исходя из этого m(Na2CO3)= 0,025моль · 106 г/моль =2,65 г Ответ: 2.65 |
