растворы. Растворы (О.Х., 1 семестр леция). Вещества, образующие раствор, называются иначе его компонентами
 Скачать 2.88 Mb. Скачать 2.88 Mb.
|
|
| Название кристаллогидрата | Химическая формула |
| Сода кристаллическая | Na2CO3 · 10 Н2О |
| Медный купорос | CuSO4 · 5 Н2О |
| Железный купорос | FeSO4 · 7 Н2О |
| Глауберова соль | Na2SO4 · 10 Н2О |
| Английская соль | MgSO4 · 7 Н2О |
| Гипс | CaSO4 · 2 Н2О |
| Алебастр | CaSO4 · 0,5 Н2О |
При нагревании (иногда достаточно сильном) кристаллогидраты разрушаются, а кристаллизационная Н2О испаряется.
Физическая и химическая стадии процесса растворения протекают одновременно. Суммарный тепловой эффект при растворении вещества определяется соотношением между двумя этими стадиями.
Если на физической стадии энергии затрачивается больше, чем её выделяется на химической стадии, то при растворении такого вещества температура раствора будет понижаться, а энергия, в целом, затрачиваться. Это наблюдается, например, при растворении NaCl, NH4NO3.
Если же на физической стадии энергии расходуется меньше, чем выделяется на химической стадии, то при растворении таких веществ температура раствора, наоборот, будет повышаться, а энергия, в целом, выделяться. Особенно хорошо это наблюдается при растворении в воде NaOH, KOH, H2SO4.
Если на физической стадии затрачивается примерно столько же энергии, сколько выделяется на химической, то температура раствора при растворении такого вещества практически не будет меняться.
При растворении газов теплота всегда выделяется, т.к. на физической стадии энергия не расходуется.
Тепловые эффекты растворения большинства веществ незначительны, поэтому заметного разогревания или охлаждения растворов, как правило, не наблюдается. Однако в некоторых случаях, например, при растворении в Н2О гидроксидов щелочных металлов или H2SO4, происходит настолько сильное разогревание раствора, что он может даже закипеть. Поэтому при приготовлении водных растворов кислот и щелочей требуется особая осторожность. В частности, при получении разбавленного раствора H2SO4 нужно приливать небольшими порциями концентрированную кислоту в Н2О, а не наоборот.
При растворении NaCl или NH4NO3 температура раствора может, понизиться до минусовой.
Теплоту, выделяемую или поглощаемую при растворении 1 моля вещества называют его теплотой растворения (Qраств.).
Растворимость веществ.
Факторы, влияющие на растворимость
Одни вещества лучше растворяются в том или ином растворителе, другие хуже. Считается, что абсолютно нерастворимых веществ нет. Каждое вещество способно к растворению, пусть даже в некоторых случаях и в очень незначительных количествах (например, ртуть в воде, бензол в воде).
К сожалению, до настоящего времени, нет теории, с помощью которой можно было бы предсказать и вычислить растворимость любого вещества в соответствующем растворителе. Обусловлено это сложностью и многообразием взаимодействия компонентов раствора между собой и отсутствием общей теории растворов (особенно концентрированных). В связи с этим необходимые данные по растворимости веществ получают, как правило, опытным путем.
Количественно способность вещества к растворению характеризуется чаще всего растворимостью или коэффициентом растворимости (S).
Растворимость (S) показывает сколько граммов вещества может максимально раствориться при данных условиях (температуре, давлении) в 100 г растворителя с образованием насыщенного раствора.
При необходимости коэффициент растворимости определяется и для другого количества растворителя (например, для 1000 г, 100 см3, 1000 см3 и т.д.).
По растворимости все вещества в зависимости от своей природы делятся на 3 группы: 1) хорошо растворимые; 2) мало растворимые; 3) плохо растворимые или нерастворимые.
Коэффициент растворимости для веществ первой группы больше 1 г (на 100 г растворителя), для веществ второй группы лежит в интервале 0,01 – 1,0 г и для веществ третьей группы S < 0,01 г.
На растворимость веществ оказывают влияние многие факторы, главными из которых являются природа растворителя и растворяемого вещества, температура, давление, наличие в растворе других веществ (особенно электролитов).
Влияние природы веществ на растворимость
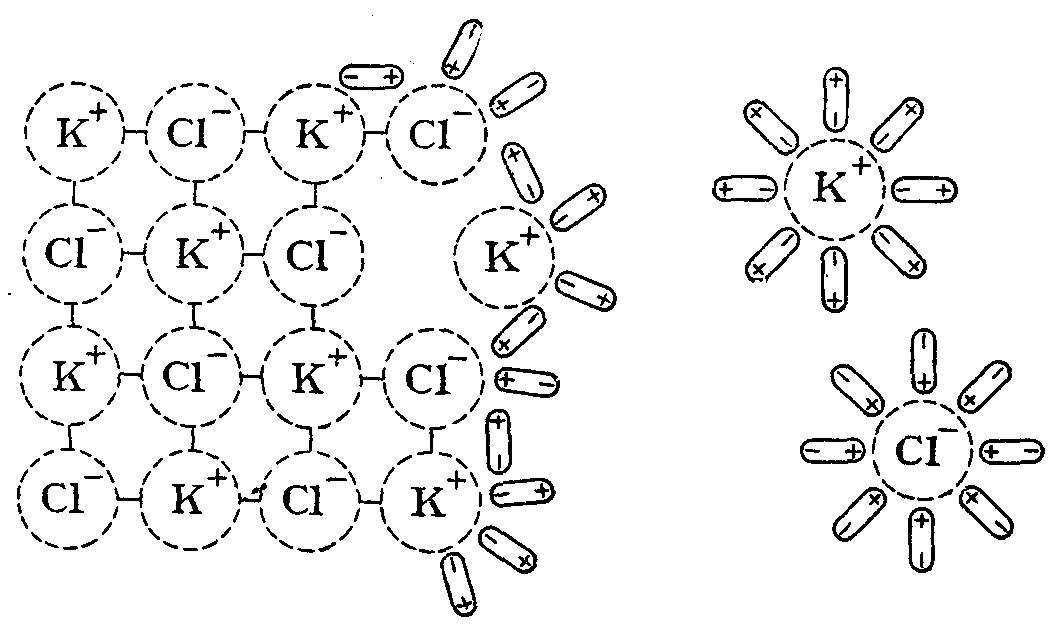
Установлено опытным путем, что в растворителе, молекулы которого полярны, лучше всего растворяются вещества, образованные ионными или ковалентными полярными связями. А в растворителе, молекулы которого неполярны, лучше растворяются вещества, образованные слабополярными или неполярными ковалентными связями. По другому эту выявленную закономерность можно сформулировать так: «Подобное растворяется в подобном».
Растворимость веществ во многом обуславливается силой и характером их взаимодействия с молекулами растворителя. Чем сильнее выражено это взаимодействие, тем больше растворимость и наоборот.
Известно, что силы, действующие между неполярными и слабополярными молекулами, невелики и неспецифичны, т.е. в количественном выражении существенно не зависят от вида вещества.
Если в неполярную жидкость В ввести однотипные неполярные молекулы А, то энергия взаимодействия частиц А и В между собой не будет значительно отличаться от энергии взаимодействия между частицами А и А или частицами В и В. Поэтому подобно тому как смешиваются любые количества одного и того же вещества, с большой вероятностью будут неограниченно смешиваться друг с другом (т.е. растворяться друг в друге) и различные неполярные жидкости.
По этой же причине и молекулярные кристаллы обычно лучше растворяются в неполярных жидкостях.
Если же энергия взаимодействия молекул А и А или В и В больше чем А и В, то одинаковые молекулы каждого компонента будут предпочтительнее связываться между собой и растворимость их друг в друге понизится (табл. 6).
Полярность любого растворителя часто характеризуют значением его диэлектрической проницаемости (ε), которая легко определяется опытным путем. Чем она больше, тем более полярным является вещество.
Таблица 6. Растворимость KI (мас%) в растворителях различной полярности
| Растворитель | Н2О | CH3OH | н-С4Н9ОН | C6H6 |
| Диэлектрическая проницаемость растворителя, ε | 80,4 | 31,2 | 10,72 | 2,3 |
| Растворимость, KI | 59,8 | 14,97 | 0,2 | 0,00016 |
Растворимость веществ значительно повышается если они способны образовывать с растворителем водородные или донорно-акцепторные связи. Примером большой растворимости, обусловленной образованием водородных связей, является раствор этилового спирта в Н2О, а образованием донорно-акцепторных связей – раствор NH3 в воде. При этом растворимость спирта не ограничена, а NH3 в Н2О растворяется в объемном соотношении 700 : 1.
Влияние давления на растворимость веществ
Влияние давления на растворимость твердых и жидких веществ практически не сказывается, т.к. объем системы при этом изменяется незначительно. Только при очень высоких давлениях изменение растворимости становится заметным. Так, например, растворимость NH4NO3 снижается почти вдвое при повышении давления до 106 кПа (т.е. приблизительно в 10 000 раз больше атмосферного).
Существенное влияние давление оказывает лишь на растворимость газов. Причем если между газом и растворителем не возникает химического взаимодействия, то согласно закона Генри растворимость газа при постоянной температуре прямо пропорциональна его давлению над раствором
S = kp
где k – коэффициент пропорциональности, зависящий от природы жидкости и газа; p – давление газа над раствором.
Закон Генри справедлив только для разбавленных растворов и в условиях низких давлений.
Если речь идет о растворении не одного газообразного вещества, а смеси, состоящей из нескольких газов, то согласно закона Дальтона растворимость каждого компонента смеси при постоянной температуре пропорциональна его парциальному давлению над жидкостью и не зависит от общего давления смеси и присутствия других газов.
Парциальное давление отдельного газа в смеси (р1) рассчитывается по формуле:
р1 = робщ. · Х1
где робщ. – общее давление газовой смеси; Х1 – мольная доля газа в смеси.
Если газовая смесь состоит из нескольких компонентов, то ее общее давление определяется суммой парциальных давлений всех газов, входящих в смесь:
робщ. = р1 + р2 + р3 + …
Газы, вступающие во взаимодействие с растворителем (например, NH3, SO2, HCl) при растворении в Н2О закону Генри и Дальтона не подчиняются. Их растворимость также увеличивается с повышением давления, но по более сложной зависимости.
Понижение давления газа над раствором ведет к уменьшению его растворимости и выделению из жидкости в виде пузырьков.
Изменением растворимости газа при резком снижении давления обусловлена так называемая кессонная болезнь, которой могут заболеть водолазы, работающие глубоко под водой. В этих условиях они дышат воздухом, находящимся под большим давлением. При этом растворимость газов в крови сильно увеличивается. Если после окончания работы подниматься на поверхность слишком быстро, то вследствие резкого уменьшения давления избыточные газы, растворенные в крови, начинают бурно выделяться. Образовавшиеся пузырьки закупоривают кровеносные сосуды, что приводит к нарушению кровообращения, многочисленным кровоизлияниям в различных тканях и органах из-за разрыва капилляров.
Поэтому подъем на поверхность с больших глубин должен быть достаточно долгим и медленным, чтобы лишний газ успевал удаляться из кровеносной системы через органы дыхания.
Аналогичная картина может возникнуть и при разгерметизации на большой высоте кабин и салонов самолетов, скафандров военных летчиков.
Влияние температуры на растворимость веществ
Растворимость большинства твердых и жидких веществ при повышении температуры в той или иной степени увеличивается. Для некоторых твердых веществ (особенно если при их растворении теплота выделяется) растворимость, наоборот, может понижаться с повышением температуры.
Зависимость растворимости веществ от температуры часто наглядно показывают при помощи графиков, которые называют кривыми растворимости (рис. 20).
Растворимость газов уменьшается с повышением температуры. Длительным кипячением можно почти полностью удалить растворенные газы из жидкости. Насыщение же жидкости газом, наоборот, целесообразнее проводить при низких температурах.
Изменением растворимости с температурой часто пользуются для очистки веществ путем перекристаллизации. При остывании горячего насыщенного раствора какой-либо соли, загрязненной посторонними примесями, значительная ее часть (соли) выделится в виде осадка, а загрязняющие примеси останутся в растворе, так как последний даже на холоде по отношению к ним не будет насыщенным.
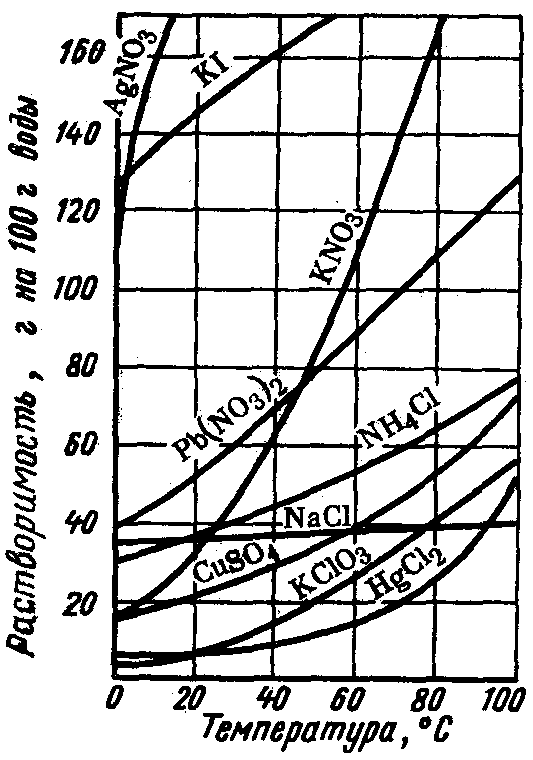

2
Рис. 20. Кривые растворимости твердых веществ (1) и газов (2) в зависимости от температуры
Подобным образом можно очищать лишь те твердые вещества, растворимость которых сильно зависит от температуры.
Влияние электролитов на растворимость веществ
Если растворитель содержит примеси, то растворимость веществ в нем уменьшается. Особенно сильно это заметно, когда в роли такого постороннего соединения выступает электролит, а растворяемым веществом является газ. Например, в 1 см3 Н2О при 20оС растворяется около 3 см3 газообразного Cl2, а в 1 см3 насыщенного раствора NaCl растворяется всего 0,3 см3 хлора.
Русский ученый – физиолог И.М. Сеченов установил количественную зависимость между растворимостью газа и концентрацией электролита в растворе (закон Сеченова):
S = S0e–kC
где S – растворимость газа в растворе электролита; S0 – растворимость газа в растворителе; С – молярная концентрация электролита в растворе; k – константа, зависящая от природы газа, электролита и температуры.
Закон Сеченова позволяет исследовать растворимость газов в крови, которая содержит в своем составе значительное число растворенных веществ, в том числе и электролитов.
Подобно газам при добавлении в раствор электролитов может понижаться растворимость и некоторых жидкостей, твердых веществ.
Это явление называют иначе высаливанием, т.к. в качестве электролита чаще всего используют соли.
Одной из причин уменьшения растворимости веществ в присутствии электролитов может быть образование прочных гидратных (сольватных) оболочек вокруг ионов, на которые распадаются электролиты. В результате этого количество свободных молекул жидкости, а значит и ее растворяющая способность, понижается.
Взаимная растворимость жидкостей
При смешивании жидкостей в зависимости от их природы, характера и силы взаимодействия между молекулами возможны 3 случая: 1) неограниченная растворимость; 2) ограниченная растворимость; 3) практическая нерастворимость.
В первом случае жидкости смешиваются друг с другом в любых соотношениях с образованием однородного раствора (вода и глицерин, вода и этиловый спирт, бензол и толуол).
При ограниченной растворимости обе жидкости растворяются друг в друге достаточно хорошо, но их взаимная растворимость не безгранична и достигает при данных условиях какого-то определенного предела. Примером таких систем являются вода и фенол, вода и анилин, диэтиловый эфир и вода.
При смешивании анилина с водой образуется 2 слоя. В верхнем слое содержится больше воды и меньше анилина, а в нижнем слое – наоборот. Таким образом, верхний слой можно рассматривать как насыщенный раствор анилина в Н2О, а нижний – воды в анилине. При постоянной температуре эти слои будут находиться в состоянии равновесия и концентрация растворенных веществ в них будет оставаться строго определенной. Добавление к этой смеси некоторого количества анилина или воды приведет только к увеличению объема нижнего или верхнего слоя, но концентрации растворенных веществ в них не изменяются.
Повышение температуры обычно вызывает увеличение взаимной растворимости жидкостей. В некоторых случаях это может привести к неограниченной растворимости, и жидкости будут смешиваться друг с другом при данных условиях в любых соотношениях.
Температура, выше которой оба компонента начинают неограниченно растворяться друг в друге, называется критической температурой растворения. Для смеси анилин – вода она равна 168оС, для смеси фенол – вода – 65,9оС.
Примером практически нерастворимых друг в друге жидкостей является вода и бензол, вода и ртуть. При смешивании эти системы разделяются на 2 слоя. Весьма вероятно, что в каждом слое в незначительном количестве будет присутствовать и другая жидкость (т.к. абсолютно нерастворимых веществ нет). Но ее концентрация будет настолько мала, что ею можно пренебречь.
Если в такую двухслойную систему, состоящую из двух практически не смешивающихся жидкостей, внести небольшое количество какого-нибудь третьего вещества, то через некоторое время оно распределится между двумя слоями.
Например, если в систему вода – сероуглерод (CS2) поместить навеску I2 и смесь тщательно перемешать, то йод можно будут обнаружить и в водном и в сероуглеродном слоях. Однако концентрация I2 в СS2 будет значительно выше чем в Н2О. При введении дополнительного количества I2 изменится концентрация его в каждом слое, но отношение концентраций при данной температуре сохраняется постоянным. Оно также не изменится если прибавить к полученной трехкомпонентной системе сероуглерод или воду.
Таким образом при постоянной температуре отношение равновесных концентраций растворенного вещества, распределившегося между двумя несмешивающимися жидкостями, является величиной постоянной, независящей от общего количества компонентов. Эта закономерность называется иначе законом распределения Нернста. Математически он записывается следующим образом:
где С1 и С2 – концентрации растворенного вещества в первом и втором растворителе соответственно; K – коэффициент распределения.
На различной растворимости одного и того же вещества в несмешивающихся жидкостях основан метод его извлечения из разбавленного раствора.
По этому методу к исходному разбавленному раствору добавляют другой растворитель, несмешивающийся с растворителем в первом растворе, но хорошо растворяющий извлекаемое вещество. При этом из первоначального разбавленного раствора растворенное вещество переходит в слой добавленного растворителя и концентрируется в нем. Этот процесс называется экстракцией.
В
 альтер Фридрих Нернст (1864—1941) — немецкий ученый. Известен своими работами в области физической химии растворов. В 1898 г. им разработана теория гальванического элемента. Наибольшую известность Нернсту принесли термодинамические исследования веществ при низких температурах, в результате которых было установлено, что при температуре абсолютного нуля энтропия однородного твердого тела стремится к нулю (тепловая теорема Нернста). В 1920 г. В. Нернст был удостоен Нобелевской премии.
альтер Фридрих Нернст (1864—1941) — немецкий ученый. Известен своими работами в области физической химии растворов. В 1898 г. им разработана теория гальванического элемента. Наибольшую известность Нернсту принесли термодинамические исследования веществ при низких температурах, в результате которых было установлено, что при температуре абсолютного нуля энтропия однородного твердого тела стремится к нулю (тепловая теорема Нернста). В 1920 г. В. Нернст был удостоен Нобелевской премии. Экстракцию из растворов применяют для разделения близкокипящих жидкостей, жидкостей с малой летучестью паров и высокой температурой кипения, веществ, разлагающихся при нагревании, т.е. в тех случаях, когда разделение перегонкой малоэффективно или вообще невозможно. Например, пенициллин и ряд других антибиотиков нельзя концентрировать выпариванием из разбавленных растворов, т.к. эти соединения при нагревании разрушаются. Для получения концентрированных растворов антибиотиков проводят их экстракцию бутил- или этилацетатом.
Способы выражения состава растворов
Состав любого раствора может быть выражен как качественно, так и количественно. Обычно, при качественной оценке раствора применяют такие понятия как, насыщенный, ненасыщенный, пересыщенный (или перенасыщенный), концентрированный и разбавленный раствор.
Насыщенным называется раствор, в котором содержится максимально возможное при данных условиях (t, р) количество растворённого вещества. Насыщенный раствор часто находится в состоянии динамического равновесия с избытком растворённого вещества, при котором процесс растворения и процесс кристаллизации (выпадения вещества из раствора) протекают с одинаковой скоростью.
Для приготовления насыщенного раствора растворение вещества необходимо вести до образования осадка, не исчезающего при длительном хранении.
Ненасыщенным называется раствор, который содержит вещества меньше, чем его может раствориться при данных условиях.
Перенасыщенные растворы содержат в себе по массе больше растворённого вещества, чем его может раствориться в данных условиях. Образуются перенасыщенные растворы при быстром охлаждении насыщенных растворов. Они неустойчивы и могут существовать ограниченное время. Очень быстро лишнее растворённое вещество выпадает в осадок, а раствор превращается в насыщенный.
Следует отметить, что при изменении температуры насыщенный и ненасыщенный растворы могут легко обратимо превращаться друг в друга. Процесс выделения твёрдого вещества из насыщенного раствора при понижении температуры называется кристаллизацией. Кристаллизация и растворение играют огромную роль в природе: приводят к образованию минералов, имеют большое значение в атмосферных и почвенных явлениях. На основе кристаллизации в химии распространён метод очистки веществ, который называется перекристаллизацией.
Для приблизительного количественного выражения состава раствора используют понятия концентрированный и разбавленный растворы.
Концентрированным называется раствор, в котором масса растворённого вещества соизмерима с массой растворителя, т.е. не отличается от него более чем в 10 раз.
Если же масса растворённого вещества более чем в десять раз меньше массы растворителя, то такие растворы называются разбавленными.
Однако следует помнить, что деление растворов на концентрированные и разбавленные условно, и чёткой границы между ними нет.
Точный количественный состав растворов выражают при помощи массовой доли растворённого вещества, его молярной концентрации, а также некоторыми другими способами.
Массовая доля растворённого вещества (w) – это безразмерная физическая величина, равная отношению массы растворённого вещества к общей массе раствора,т.е.
Обычно выражается в долях единицы или в процентах. Массовая доля, выраженная в %, называется процентной концентрацией. Она показывает, какая масса вещества растворена в 100 г раствора.
Молярная концентрация (С) или молярность – это величина, равная отношению количества растворённого вещества к объему раствора (в литрах), т.е.
Молярность измеряется в моль/л и показывает сколько моль вещества растворено в одном литре раствора. Молярность обозначается обычно буквой М. Если в одном литре раствора содержится 1 моль вещества, то такой раствор называется одномолярным (1М), если 0,1 моль вещества – децимолярным (0,1М), если 0,01 моль вещества – сантимолярным (0,01М), если 0,001 моль вещества – миллимолярным (0,001М).
Титром (Т) называется отношение массы вещества в граммах к объёму раствора в мл, т.е.
Титр имеет размерность г/мл, он показывает, сколько грамм вещества растворено в 1 мл раствора.
Моляльная концентрация или моляльность (m) – это величина, равная отношению количества растворённого вещества к массе растворителя, выраженной в кг, т.е.
Моляльность имеет размерность моль/кг и показывает, какое количество вещества растворено в 1 кг растворителя.
Мольная доля (Х) – это величина, равная отношению количества растворённого вещества к общему количеству вещества в растворе:
Мольная доля – это безразмерная величина и измеряется в долях единицы или в %.
Молярная концентрация химического эквивалента вещества (С) или нормальная концентрация – это величина, равная отношению количества химического эквивалента растворённого вещества к объему раствора (в литрах), т.е.
Молярная концентрация химического эквивалента вещества измеряется в моль/л и показывает сколько моль эквивалента вещества растворено в одном литре раствора. Она обозначается обычно буквой н. Если в одном литре раствора содержится 1 моль химического эквивалентавещества, то такой раствор называется однонормальным (1н), если 0,1 моль вещества – децинормальным (0,1н), если 0,01 моль вещества – сантинормальным (0,01н), если 0,001 моль вещества – миллинормальным (0,001н).
Термодинамические аспекты процесса растворения. Идеальные растворы
Согласно второму началу термодинамики в изобарно-изотерических условиях (р, Т = const) вещества могут самопроизвольно растворяться в каком-либо растворителе, если при совершении этого процесса энергия Гиббса системы уменьшается, т.е.
G < 0 или H – TS < 0
При растворении жидких и твердых веществ энтропия системы обычно возрастает (S > 0), т.к. растворяемые вещества из более упорядоченного состояния переходят в менее упорядоченное состояние. Особенно сильно это выражено при растворении твердых веществ. Вклад энтропийного фактора (ТDS) при этом становится преобладающим по сравнению с энтальпийным (DН) и приводит к уменьшению энергии Гиббса даже если растворение вещества сопровождается поглощением энергии (DН > 0).
Роль энтропийного фактора еще больше усиливается при повышении температуры, потому что в этом случае множитель Т становится бóльшим и произведение ТDS существеннее увеличивается. Именно поэтому растворимость твердых и жидких веществ с повышением температуры, как правило, возрастает.
Если при растворении твердого либо жидкого вещества энергия выделяется (DН < 0), то оба фактора (и энтальпийный и энтропийный) действуют в одинаковом направлении и способствуют уменьшению энергии Гиббса.
При растворении газов энтропия системы, как правило, уменьшается (DS < 0), т.к. вещество при этом из менее упорядоченного состояния переходит в более упорядоченное. Таким образом уменьшение энергии Гиббса в этом случае возможно только за счет большего вклада энтальпийного фактора. Причем изменение энтальпии должно быть меньше нуля (DН < 0). Именно это (т.е. выделение энергии) и наблюдается при растворении газов, но величина теплового эффекта данного явления обычно не превышает 15-20 кДж/моль, поэтому даже при небольшом увеличении температуры вклад энтропийного фактора начинает преобладать, а растворимость газов в жидкости уменьшается.
Растворы, в процессе образования которых тепловые и объемные эффекты отсутствуют, т.е. DН = 0 и DV = 0 (изменение объема) называются идеальными.
Такие растворы получаются при смешивании компонентов А и В, у которых силы взаимодействия между однородными (А и А, В и В) и разнородными (А и В) молекулами равны.
Образование растворов в данном случае сопровождается лишь хаотическим распределением частиц без изменения характера и величины сил взаимодействия между собой. Поэтому тепловые эффекты отсутствуют.
Свойства идеальных растворов подобно свойствам разреженных газовых смесей не зависят от природы растворенного вещества, а определяются лишь его концентрацией (т.е. количеством) в растворе. При этом единственной причиной образования таких растворов (как и газовых смесей) является увеличение энтропии (DS > 0).
В идеальных растворах свойства отдельных компонентов не отличаются от их свойств в чистом индивидуальном виде.
Реальные растворы не обладают свойствами идеальных растворов, но могут в той или иной степени приближаться к ним. Особенно это характерно для разбавленных растворов, в которых можно пренебречь взаимодействием между частицами растворенного вещества, т.к. они в нем достаточно разобщены, т.е. находятся на большом расстоянии друг от друга.


 митрий Иванович Менделеев
митрий Иванович Менделеев