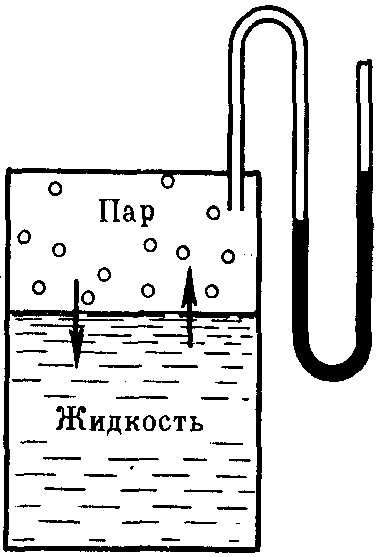|
|
растворы. Растворы (О.Х., 1 семестр леция). Вещества, образующие раствор, называются иначе его компонентами
Давление насыщенного пара растворителя
над раствором. Закон Рауля
Если в замкнутый сосуд, из которого предварительно удалили воздух, поместить чистый растворитель, например, воду (рис. 27), то в результате естественного процесса испарения над жидкостью образуется пар. Он будет состоять из молекул жидкости, оторвавшихся от ее верхнего слоя в результате своего хаотического теплового движения и перешедших в газовую фазу. На совершение данного процесса необходимо затратить определенное количество энергии, чтобы преодолеть силы притяжения между молекулами жидкой фазы. Эндотермический процесс испарения обратим. По мере накопления молекул в газовой фазе над поверхностью жидкости одновременно начнет протекать и обратный процесс – конденсация пара, т.е. переход молекул растворителя обратно в жидкость. Причем конденсация является экзотермическим процессом и сопровождается выделением теплоты.
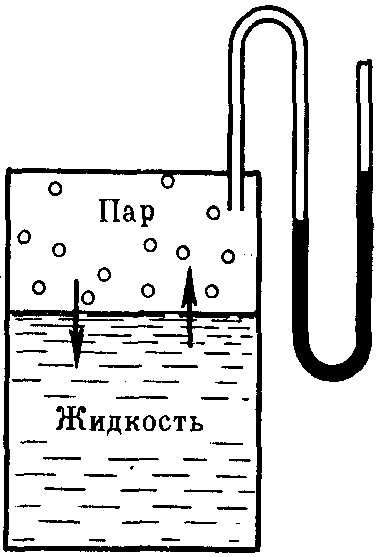
Рис. 27. Равновесие жидкость — пар (схема)
Со временем скорости обоих процессов уравняются и в системе установится динамическое равновесие, при котором число молекул растворителя, испарившихся с поверхности жидкости за единицу времени, будет равно числу молекул, перешедших в жидкость из газообразной среды. Но при этом какое-то постоянное и не меняющееся во времени число молекул растворителя будет находиться над его поверхностью, образуя насыщенный пар. Давление этого пара на жидкость называют давлением насыщенного пара чистого растворителя (р0). Его можно измерить с помощью манометра (рис. 27).
При неизменной температуре и внешнем давлении р0 остается постоянным и зависит только от природы жидкости и поэтому является одной из ее физических характеристик.
Так, при 293 K (20оС) давление насыщенного пара Н2О равно 2,319 кПа; этилового спирта – 5,85 кПа; диэтилового эфира – 58,93 кПа.
При повышении температуры согласно принципа Ле-Шателье равновесие смещается в сторону эндотермического процесса испарения. В результате чего количество молекул жидкости над ее поверхностью начнет увеличиваться. Это приведет к возрастанию давления насыщенного пара, когда система снова придет в равновесие.
Если растворить небольшое количество какого-нибудь нелетучего вещества1 (молекулы которого не могут переходить в газовую фазу) концентрация свободных молекул растворителя в верхнем слое жидкости уменьшится, т.к. часть мест там займут частицы растворенного вещества. Они к тому же будут удерживать вокруг себя (связывать) ближайшие молекулы растворителя, формируя из них сольватные оболочки.
В этом случае равновесие между жидкостью и ее насыщенным паром устанавливается при более низком давлении (р) по сравнению с давлением насыщенного пара над чистым растворителем (р0).
Опытным путем было установлено, что для растворов понижение давления насыщенного пара растворителя (р0 – р = р) не зависит от природы растворенного вещества, а определяется только его концентрацией.
Французский физик Франсуа Рауль установил математическую зависимость между р и мольной долей растворителя, которая называется законом Рауля:
р = р02,
где 2 – мольная доля растворителя в раствор.

Франсуа Мари Рауль (1830 – 1901) – французский химик и физик, член-корреспондент Парижской АН (1890). С 1867 работал в Гренобльском университете (профессор с 1870). Член-корреспондент Петербургской АН (1899). Исследуя в 1882–1888 понижение температуры кристаллизации, а также понижение давления пара (или повышение температуры кипения) растворителя при введении в него растворённого вещества, открыл закон Рауля, применяемый для определения молекулярных масс веществ в растворённом состоянии.
Таким образом, согласно закону Рауля давление насыщенного пара растворителя над раствором прямо пропорционально мольной доле растворителя.
Часто закон Рауля математически записывают по-другому:
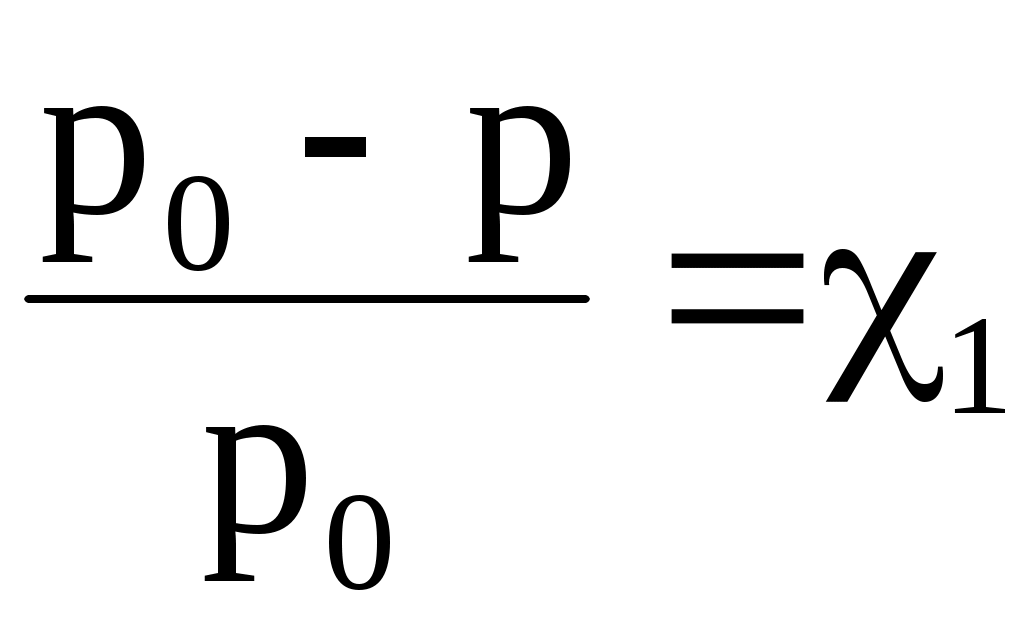 или или 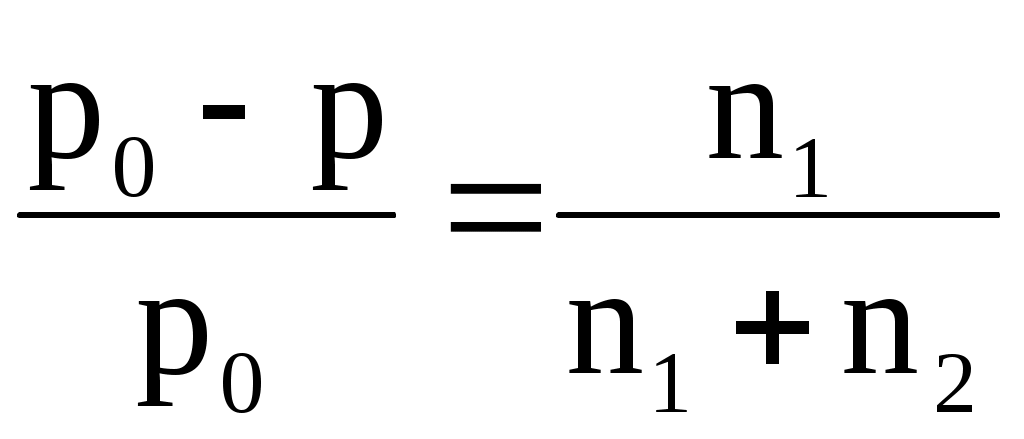 , ,
где 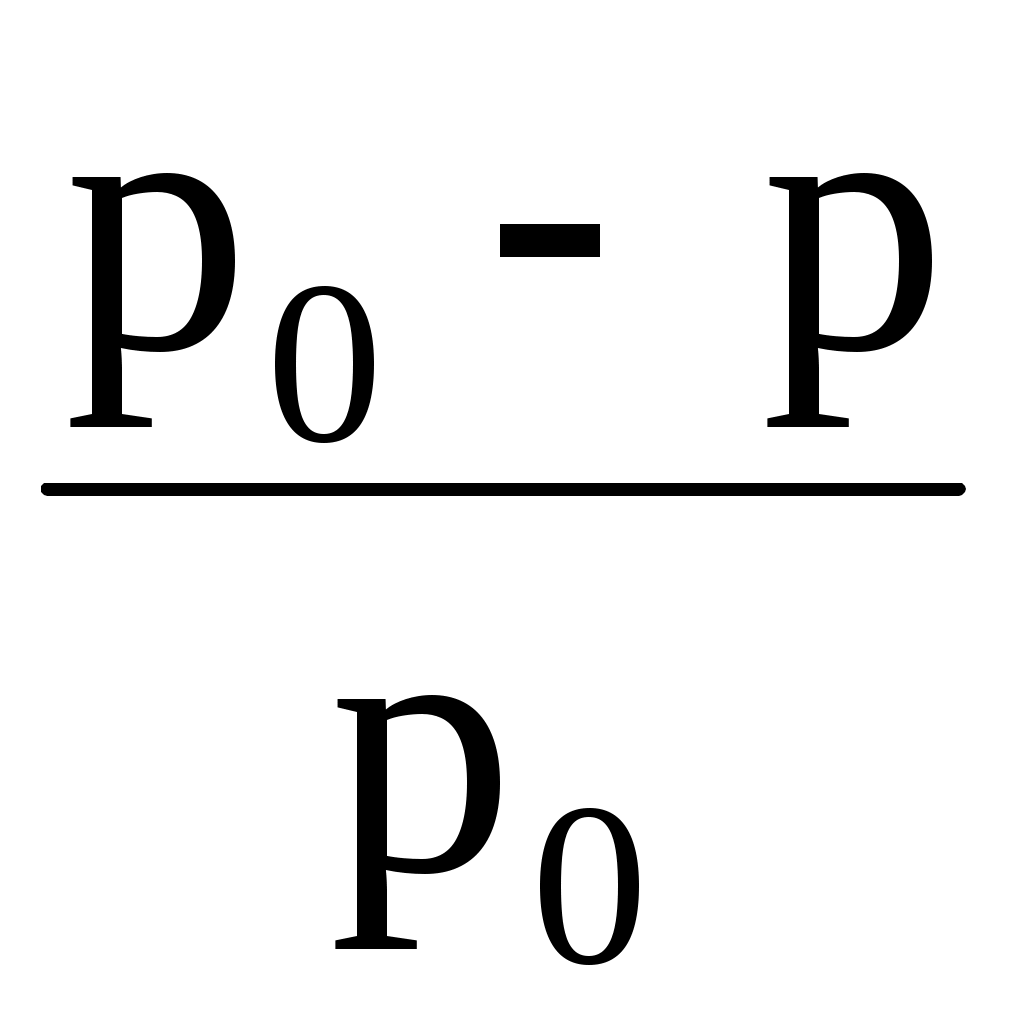 – относительное понижение давления насыщенного пара растворителя над раствором; 1 – мольная доля растворенного вещества; n1 – химическое количество (моль) растворенного вещества; n2 – химическое количество растворителя. – относительное понижение давления насыщенного пара растворителя над раствором; 1 – мольная доля растворенного вещества; n1 – химическое количество (моль) растворенного вещества; n2 – химическое количество растворителя.
В этом случае его формулировка звучит несколько иначе:
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
Растворы, которые строго подчиняются закону Рауля, являются идеальными. Для реальных растворов неэлектролитов закон Рауля соблюдается тем точнее, чем более разбавленным является этот раствор. По мере повышения концентрации растворенного вещества для большинства растворов наблюдаются отклонения от закона Рауля.
Не подчиняются закону Рауля растворы электролитов (кислот, оснований, солей). Причем, даже в тех случаях, когда они являются разбавленными. Причина этого явления будет нами рассмотрена позже.
Следствия из закона Рауля
Из закона Рауля вытекают два важных следствия:
1) растворы кипят при более высокой температуре чем чистый растворитель;
2) растворы замерзают при более низкой температуре чем чистый растворитель.
Рассмотрим их более подробно.
Кипение является физическим процессом перехода жидкости в газообразное состояние или пар, при котором пузырьки газа образуются по всему объему жидкости.
Жидкость закипает, когда давление ее насыщенного пара становится равным внешнему давлению. Если внешнее давление (например, атмосферное) не изменяется, а сама жидкость является индивидуальным и химически чистым веществом, то кипение ее в открытом подогреваемом сосуде происходит при постоянной температуре до тех пор, пока полностью не исчезнет жидкая фаза.
Так при атмосферном давлении равном 101,325 кПа температура кипения очищенной (дистиллированной) воды равна 100оС или 373,16 K.
Если же в Н2О растворить какое-нибудь нелетучее вещество, то давление ее насыщенного пара понизится. Чтобы получившийся раствор закипел, необходимо нагреть его до температуры выше, чем 373,16 K, т.к., только при таких условиях давление насыщенного пара растворителя снова станет равным атмосферному.
Замерзание или кристаллизация представляет собой физическое явление, сопровождающееся превращением жидкости в твердое вещество. Причем кристаллические структуры образуются во всем объеме жидкости.
Процесс замерзания начинается, если давление насыщенного пара над жидкостью становится равным давлению насыщенного пара над ее твердыми кристалликами.
Если внешнее (атмосферное) давление остается постоянным, а жидкость не содержит посторонних примесей, то в процессе кристаллизации температура охлаждаемой жидкости будет оставаться постоянной до тех пор, пока жидкая фаза полностью не превратится в твердую.
При атмосферном давлении равном 101,325 кПа дистиллированная вода замерзает при 0оС (273,16 K). Давление насыщенного пара воды надо льдом и жидкостью в этом случае равно 613,3 Па.
Для водного раствора давление насыщенного пара растворителя при 0оС будет меньше чем 613,3 Па, а надо льдом остается неизменным. Опущенный в такой раствор лед будет быстро таять, вследствие конденсации над ним избыточного количества пара.
Лишь при понижении температуры снова можно уравнять давление насыщенного пара над жидкой и твердой фазой и вызвать процесс кристаллизации.
Опытным путем было установлено, что повышение температуры кипения (tкип.) и понижение температуры замерзания раствора (tзам.) по сравнению с чистым растворителем прямо пропорционально моляльной концентрации растворенного вещества. Математически это можно записать следующим образом:
tкип. р-ра – tкип. р-теля = tкип. = Em
tзам. р-теля – tзам. р-ра = tзам. = Km
где m – моляльная концентрация растворенного вещества; E и K – соответственно, эбуллиоскопическая (лат. ebbulio – выкипаю) и криоскопическая (греч. «криос» - холод) константы, значения которых зависят только от природы растворителя (табл. 7).
Таблица 7. Эбуллиоскопические E и криоскопические K константы некоторых растворителей (град/моль)
Растворитель
|
Е
|
K
|
1. Вода
|
0,516
|
1,86
|
2. Этиловый спирт
|
1,23
|
-
|
3. Бензол
|
2,57
|
5,12
|
4. Уксусная кислота
|
3,1
|
3,9
|
5. Анилин
|
3,69
|
5,87
|
Эбуллиоскопическая и криоскопическая константы растворителя показывают на сколько градусов повышается температура кипения и понижается температура замерзания раствора, полученного при растворении в одном килограмме растворителя одного моля неэлектролита (m = 1 моль/кг).
Для определения значений E и K сперва опытным путем определяют Dtкип. и Dtзам. сильно разбавленных растворов (m << 1), а затем полученные данные пересчитывают или экстраполируют для растворов с m = 1 моль/кг.
Значения E и K можно рассчитать и теоретически с помощью соотношения Вант-Гоффа:
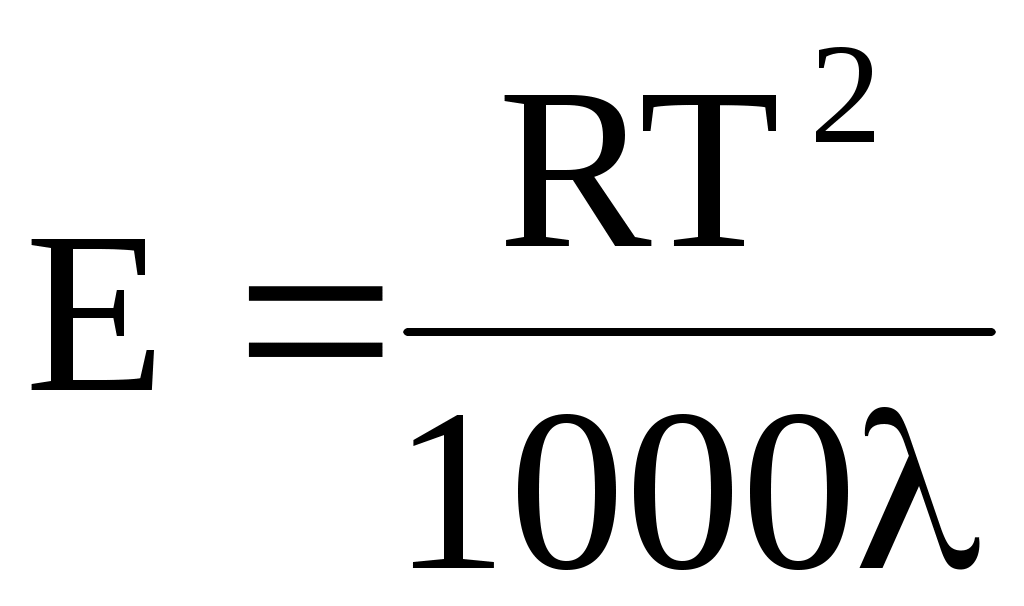
где R – универсальная газовая постоянная; T – температура кипения растворителя; - удельная теплота испарения растворителя.
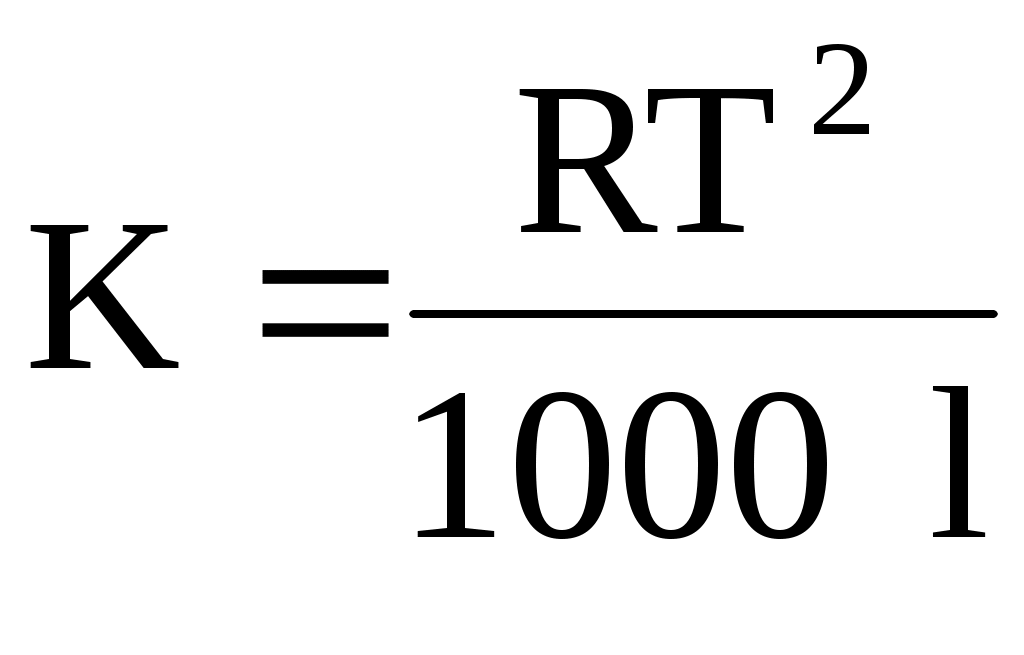
где T – температура плавления растворителя; l – удельная теплота плавления растворителя.
Таким образом, растворы разных по своей природе веществ, но с одинаковой моляльной концентрацией будут кипеть и замерзать при одной и той же температуре.
Следует обратить внимание на важное отличие раствора от чистого растворителя. Если последний кипит и замерзает при постоянной температуре, то растворы делают это в интервале температур, т.е. в процессе их выкипания температура все время повышается, а при замерзании – уменьшается. Это связано с тем, что удаление из жидкой фазы растворителя в виде пара или твердых кристаллов приводит к увеличению моляльной концентрации раствора, т.к. растворенное вещество в процессе кипения и замерзания в неизменном количестве остается в жидкой фазе (вплоть до ее полного выкипания или замерзания), а масса жидкого растворителя уменьшается.
При практических измерениях температуры замерзания или кипения раствора фиксируют момент появления в нем первых твердых кристаллов (для tзам.) или пузырьков газа (для tкип.).
Свойство растворов понижать температуру замерзания позволяет использовать их в роли хладоносителей.
Так, растворы некоторых органических и неорганических веществ используют в качестве антифризов для охлаждения двигателей внутреннего сгорания при работе их в самых разных климатических условиях.
Понижение температуры замерзания растворов имеет большое значение для живых организмов. Так, жидкость в их клетках представляет собой раствор различных неорганических и органических веществ. Его температура замерзания лежит ниже 0оС (273,16 K), поэтому клетки не погибают в условиях переохлаждения.
Благодаря данному явлению растения сохраняются в зимний период. Причем, чем выше концентрация веществ в клеточной жидкости, тем более низкие внешние температуры может переносить растение.
При этом для понижения температуры замерзания раствора в охлаждаемых клетках усиливается процесс гидролиза более высокомолекулярных соединений до низкомолекулярных (например, углеводов – до глюкозы).
Применение методов криоскопии и эбуллиоскопии
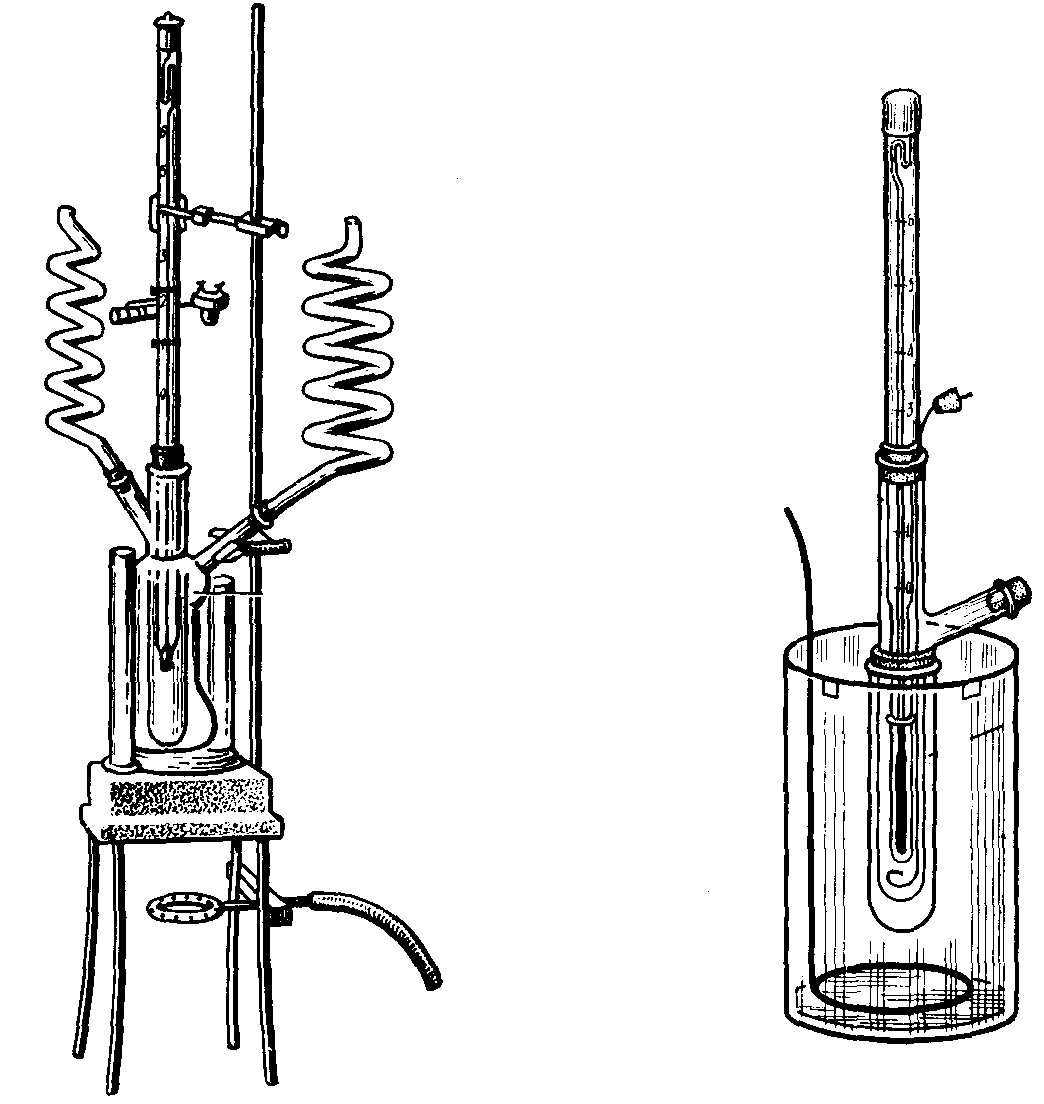
Определение понижения температуры замерзания или кипения раствора позволяет решать целый ряд вопросов, касающихся свойств данного раствора и растворенного вещества. Метод исследования, основанный на измерении температуры замерзания растворов, называется криоскопическим методом или криоскопией, а метод, основанный на измерении температуры кипения растворов получил название эбуллископического метода или эбуллиоскопии (рис. 28).
а б
Рис. 28. Аппараты для эбуллиоскопического (а) и криоскопического (б) определения молекулярных масс
В лабораторной практике криоскопический метод нашел значительно большее распространение по сравнению с методом эбуллиоскопии, т.к. измерять температуры замерзания растворов значительно проще и безопаснее чем температуры их кипения.
Так криоскопический метод часто используется для определения молекулярной массы вещества. Согласно следствию из закона Рауля
Dtзам. = K · m = 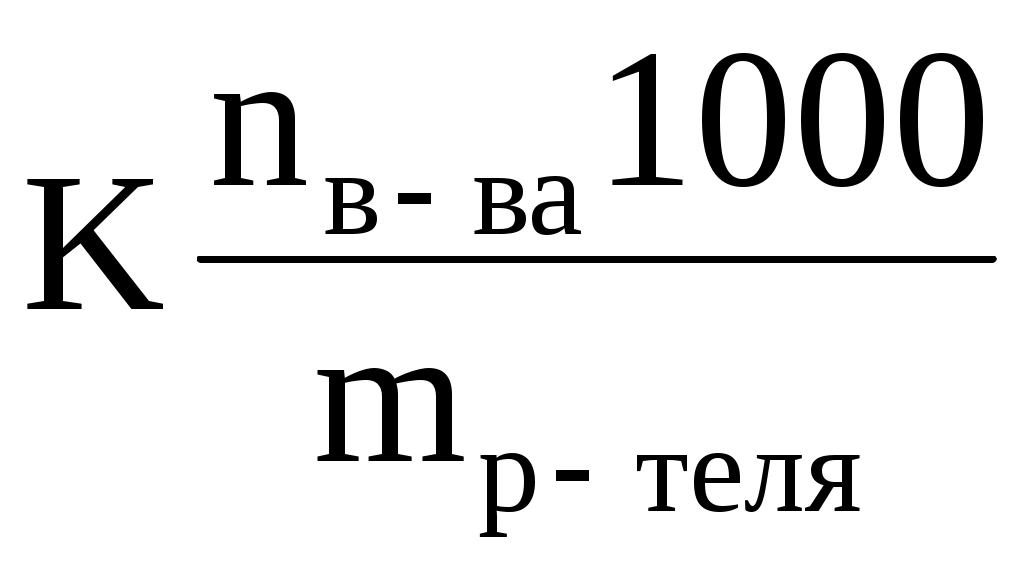
где nв-ва – химическое количество растворенного вещества;
mр-теля – масса растворителя (в граммах).
Учитывая, что 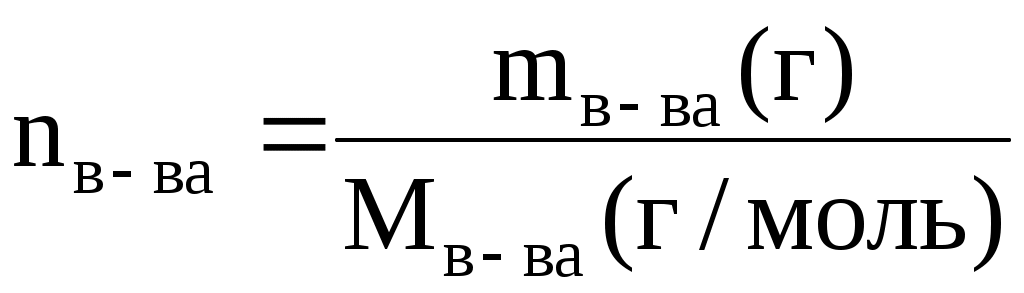 и подставив это выражение в вышестоящее уравнение можно решить его относительно Мв-ва и подставив это выражение в вышестоящее уравнение можно решить его относительно Мв-ва
Мв-ва = K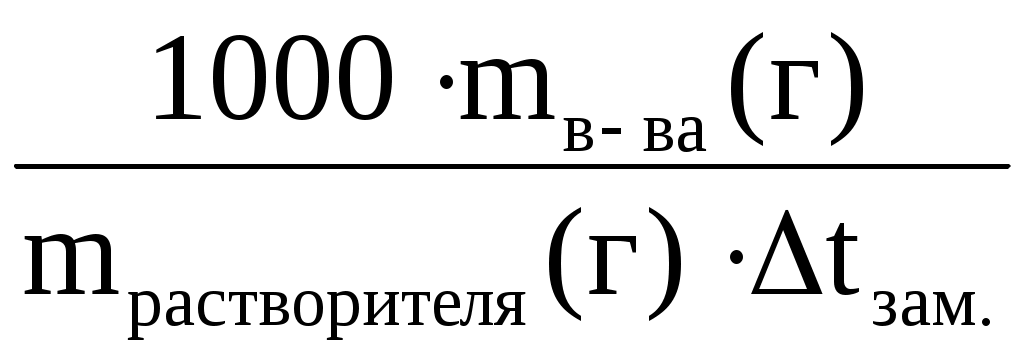
Измерение осмотического давления раствора с помощью осмометра часто бывает не совсем точным, т.к. на практике трудно подобрать подходящую мембрану, которая обладала бы идеальной полупроницаемостью. В этом случае более правильное значение росм. можно получить косвенным путем, например, с помощью метода криометрии.
Измерив Dtзам. раствора, можно рассчитать его моляльную концентрацию 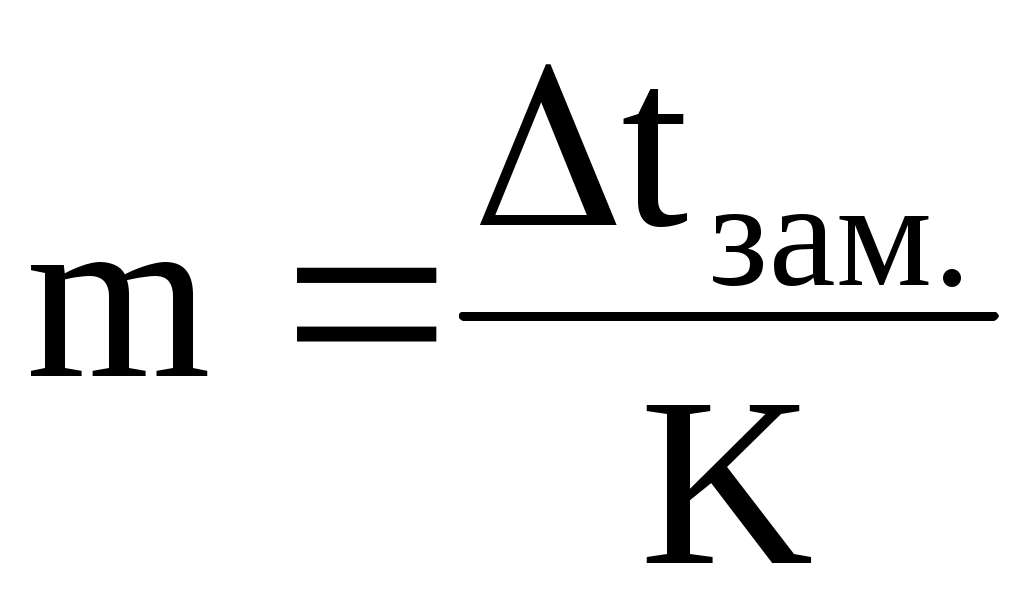 . .
Для разбавленных растворов (плотность которых близка к плотности воды) без большой погрешности можно принять, что их молярная концентрация С, выраженная в моль/дм3, равна моляльной концентрации m выраженной в моль/кг. Тогда в уравнение Вант-Гоффа для осмоса вместо С можно подставить m (моляльную концентрацию)
росм. = 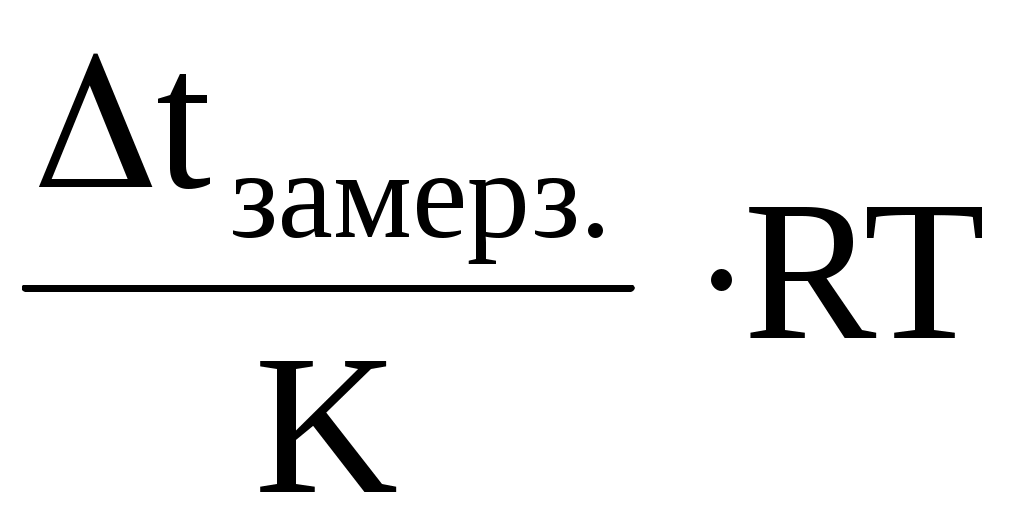
и рассчитать значение осмотического давления раствора.
С помощью метода криометрии можно определять суммарную моляльную концентрацию всех веществ, содержащихся в биологических жидкостях
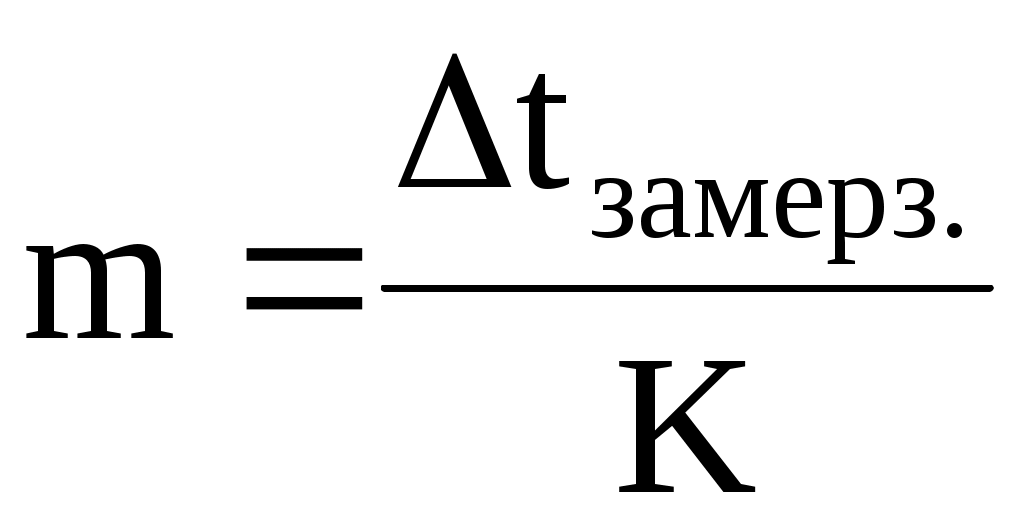 , ,
а также степень диссоциации слабых электролитов и изотонический коэффициент Вант-Гоффа.
|
|
|
 Скачать 2.88 Mb.
Скачать 2.88 Mb.